鼠尾草酸对α-淀粉酶的抑制作用
王 静,刁翠茹,王华丽,李 祥,汪名春,王 浩,*
(1.天津科技大学食品科学与工程学院,天津 300457;2.国家食品安全风险评估中心标准三部,北京 100022;3.安徽农业大学茶与食品科技学院,安徽 合肥 230036)
糖尿病是常见的、有遗传倾向的内分泌系统疾病,随着人们生活方式的改变,糖尿病的发病率逐渐上升,且发病人群日趋年轻化,糖尿病作为21世纪全球最大的健康问题之一,已成为仅次于癌症和心血管疾病的第三大疾病。II型糖尿病是糖尿病的主要形式,在高收入国家中II型糖尿病患者占糖尿病总患者87%~91%[1]。餐后高血糖浓度是II型糖尿病及其并发症的主要特征之一,可通过抑制碳水化合物的吸收来控制。一些抗糖尿病药物,如阿卡波糖、米格列醇和伏格列波糖,通过抑制α-淀粉酶和α-葡萄糖苷酶的活性发挥作用,其虽然有效地抑制了餐后血糖浓度的上升,但持续使用往往伴随着不良的副作用,如胀气、腹部不适、恶心、呕吐、肠鸣及腹泻等,且机体的药物耐受性也会逐渐增强[2]。因此,从天然产物中筛选获得更安全、高效的抑制剂,成为II型糖尿病治疗的研究热点。迄今为止,已有大量的研究报道了各种植物提取物通过抑制碳水化合物水解酶的活性来达到抗糖尿病的目的[3-4]。因此寻找天然的无副作用的α-淀粉酶抑制剂至关重要。
鼠尾草酸是一种从迷迭香中提取的油溶性多酚类双萜化合物(图l),具有高效、安全无毒、耐高温等特性[5]。Ninomiya等发现鼠尾草酸等迷迭香提取物除了可以通过有效调节脂肪的吸收来控制人体质量从而达到减肥的目的外,还可以用于治疗炎症、消化不良、糖尿病等[6]。已有研究发现鼠尾草酸对α-淀粉酶具有良好的抑制作用[7],但具体抑制机制尚不清楚,因此本实验将针对鼠尾草酸对α-淀粉酶的抑制机制做进一步的研究。主要从酶学动力学、荧光猝灭以及分子模拟几个方面研究鼠尾草酸对α-淀粉酶的抑制机理,以期为其在保健食品和医药领域的应用提供有益参考。
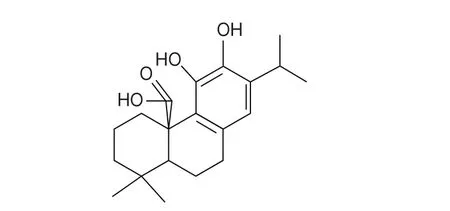
图 1 鼠尾草酸结构式Fig. 1 Structural formula of carnosic acid
1 材料与方法
1.1 材料与试剂
鼠尾草酸(纯度≥90%) 湖南先伟实业有限公司;猪胰腺α-淀粉酶 美国Sigma Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HWS24电热恒温水浴锅 上海一恒科技有限公司;TP-114分析天平、UB-7 pH计 美国丹佛仪器有限公司;LF-1404019荧光光谱仪 美国Thermo Scientific公司;T6紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1α-淀粉酶活力的测定
α-淀粉酶活力测定根据Adisakwattana等的方法[8]略作改动。100 µLα-淀粉酶液和50 µL不同质量浓度的抑制剂,于37 ℃预孵化10 min。然后加入100 µL的底物(可溶性淀粉溶液)使反应开始,5 min后加入750 µL 3,5-二硝基水杨酸溶液,沸水浴10 min后使反应停止,取出后冰浴至室温,取反应液稀释,在540 nm波长处测定光密度值。
1.3.2 酶促反应动力学分析
酶促反应动力学的测定参照李波等的方法进行[9]。固定底物(可溶性淀粉)浓度,改变α-淀粉酶质量浓度,在不同α-淀粉酶质量浓度条件下测定酶促反应的初速率,并对体系中的α-淀粉酶质量浓度作图,得到酶促反应速率-酶质量浓度曲线。固定α-淀粉酶质量浓度,改变底物质量浓度([S]),确定鼠尾草酸对α-淀粉酶抑制的动力学类型。
1.3.3 荧光光谱测定
使用LF-1404019荧光光谱仪分析α-淀粉酶与鼠尾草酸的相互作用。用0.1 mg/mL的酶液与不同质量浓度(0、0.8、1.2、1.6、2.0 mg/mL)的鼠尾草酸混合,在280 nm波长处测定混合物的荧光强度。发射波长为300~450 nm,狭缝宽度为10 nm,扫描速率为960 nm/min[10-11]。
1.3.4 分子对接分析
采用分子对接模拟的方法预测鼠尾草酸与α-淀粉酶的结合模式和作用力[12]。α-淀粉酶蛋白结构从RCSB Protein Data Bank(http://www.rcsb.org/pdb)获取,鼠尾草酸三维分子晶体由Sybylh1.1软件画出。在对接之前,鼠尾草酸配体与α-淀粉酶蛋白受体使用Discovery studio 3.5软件的“Prepare Ligand tool”和“Prepare Protein tool”模块默认设置进行处理,从消化酶晶体结构中去除水分子。用AutoDock 4.2分子模拟软件对淀粉酶结合位点上的抑制配体进行自动分子对接研究[14]。本研究使用DS3.5软件的CDOCKER进行酶蛋白与小分子的分子对接操作,并使用下列参数:Top Hits-10、Random Conformations-10、Orientations to Refine-10、Force field-CHARMm和Use Full Potential-False。
1.4 数据统计与分析
所有实验均重复3 次,结果用平均值±标准差表示。采用Origin 8.0软件进行绘图与方程拟合。
2 结果与分析
2.1 鼠尾草酸对α-淀粉酶的抑制作用
鼠尾草酸对α-淀粉酶的抑制可以通过半数抑制浓度(half inhibitory concentration,IC50)来体现,即鼠尾草酸引起的α-淀粉酶活力损失50%的结果。以鼠尾草酸质量浓度为横坐标,抑制率为纵坐标,绘制抑制曲线[15],结果如图2所示,随着鼠尾草酸质量浓度的增加,鼠尾草酸对α-淀粉酶活力的抑制呈明显的质量浓度依赖性。
你是否经常遇到这样的情况:快递送货到家,自己却在单位上班无法签收,或是快递已到楼下,而自己5分钟前已飞奔在路上。这样的尴尬场景在有了速递易、丰巢柜等快递柜后有了很大改善。
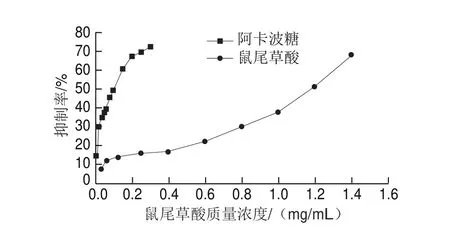
图 2 阿卡波糖和鼠尾草酸对α-淀粉酶的抑制活性Fig. 2 Inhibitory effect of acarbose and carnosic acid on α-amylase activity
抑制剂的IC50取决于酶的活力和来源、底物类型和浓度以及其他实验条件(如反应时间、温度、pH值等)[16-18]。本实验采用pH 5.6作为α-淀粉酶的反应条件,研究鼠尾草酸对α-淀粉酶的活力的抑制作用。通过线性拟合计算出鼠尾草酸对α-淀粉酶的IC50为1.12 mg/mL,与阳性对照药物阿卡波糖(IC50=0.089 mg/mL)相比,鼠尾草酸对α-淀粉酶活性的抑制效果略低,但依然具有较强的抑制作用,可能作为潜在的α-淀粉酶抑制剂。
2.2 酶促反应动力学分析结果
2.2.1 鼠尾草酸的可逆与不可逆抑制
固定底物的浓度,在不同鼠尾草酸质量浓度(0、0.8、1.2、1.6、2.0 mg/mL)条件下测定酶促反应的初速率,以α-淀粉酶的质量浓度为变量并对其作图[19],得到的酶促反应速率-酶质量浓度曲线通过原点,如图3所示。根据抑制剂与酶的结合方式不同,抑制剂对酶的抑制类型分为可逆抑制和不可逆抑制:当加入不可逆抑制剂时,速率直线不通过坐标原点,与Y轴有一正截距;当加入可逆抑制剂时,速率直线通过坐标原点,斜率较不加抑制剂时低。由图3可以看到,加入鼠尾草酸后的速率直线通过了坐标原点,依此推测鼠尾草酸对α-淀粉酶的抑制为可逆性抑制。
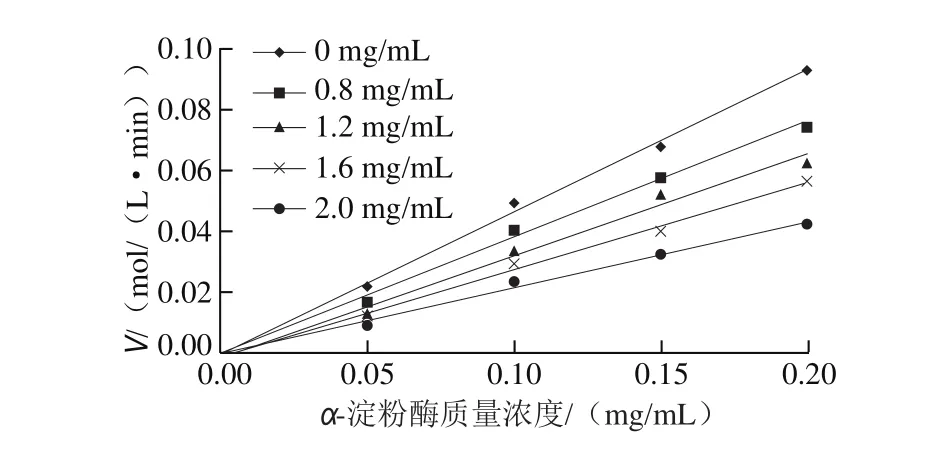
图 3 鼠尾草酸对α-淀粉酶的可逆性抑制作用Fig. 3 Reversible inhibition of carnosic acid against α-amylase
2.2.2 鼠尾草酸对α-淀粉酶的酶促反应动力学分析结果
以可溶性淀粉作为底物分析鼠尾草酸对α-淀粉酶的酶促反应动力学。固定α-淀粉酶的质量浓度,在不同鼠尾草酸质量浓度(0、0.8、1.2、1.6、2.0 mg/mL)下,改变底物的质量浓度,测定不同底物质量浓度下反应体系的反应速率,得到α-淀粉酶在有无鼠尾草酸存在时的Lineweaver-Burk曲线(图4)。

图 4 鼠尾草酸对α-淀粉酶的双倒数曲线Fig. 4 Lineweaver-Burk plots for the inhibition type of carnosic acid against α-amylase
Michaelis常数Km和最大反应速率Vmax由公式(1)计算得到。由表1可知,与无抑制剂相比,在添加鼠尾草酸后,α-淀粉酶催化可溶性淀粉的反应方程中Km增大,而Vmax基本保持不变,因此推测鼠尾草酸对α-淀粉酶的抑制作用类型属于竞争性抑制。

式中:Km是当酶反应速率达最大反应速率一半时的底物质量浓度/(mg/mL);Ki为抑制剂常数;[I]表示抑制剂的质量浓度/(mg/mL);[S]表示底物质量浓度/(mg/mL);V表示酶的反应速率/(mol/(Lgmin));Vmax表示最大反应速率/(mol/(Lgmin))。
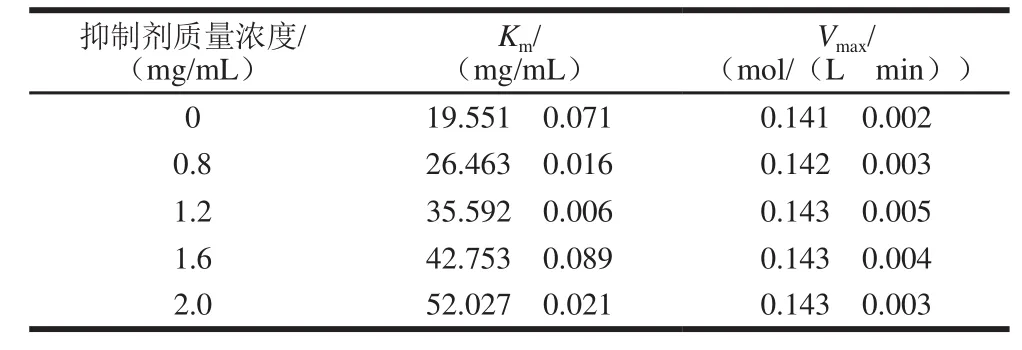
表 1 鼠尾草酸对α-淀粉酶抑制的Vmax和KmTable 1 Vmax and Km values of carnosic acid for inhibiting α-amylase
2.3 鼠尾草酸对α-淀粉酶的荧光猝灭效应
蛋白质荧光主要来自色氨酸残基,而α-淀粉酶分子含有至少16 个色氨酸残基,因此淀粉酶色氨酸残基的天然荧光强度及其变化值可直接反映蛋白质本身和周围环境的变化[20]。实验结果如图5所示(鼠尾草酸的质量浓度从曲线a~j分别为0、0.062 5、0.125、0.175、0.25、0.35、0.5、0.8、1.0、2.0 mg/mL)。由荧光光谱中可以看出,随着鼠尾草酸质量浓度的增加,α-淀粉酶的荧光强度逐渐降低,荧光光谱发生明显猝灭现象。荧光强度的降低表明,经鼠尾草酸处理后会引起α-淀粉酶疏水键的断裂,导致色氨酸等非极性氨基酸残基暴露于极性环境中[21]。同时,最大发射波长从348 nm到340 nm,有微弱的蓝移,表明鼠尾草酸与α-淀粉酶相互作用导致色氨酸的极性变化和本征荧光强度的猝灭。
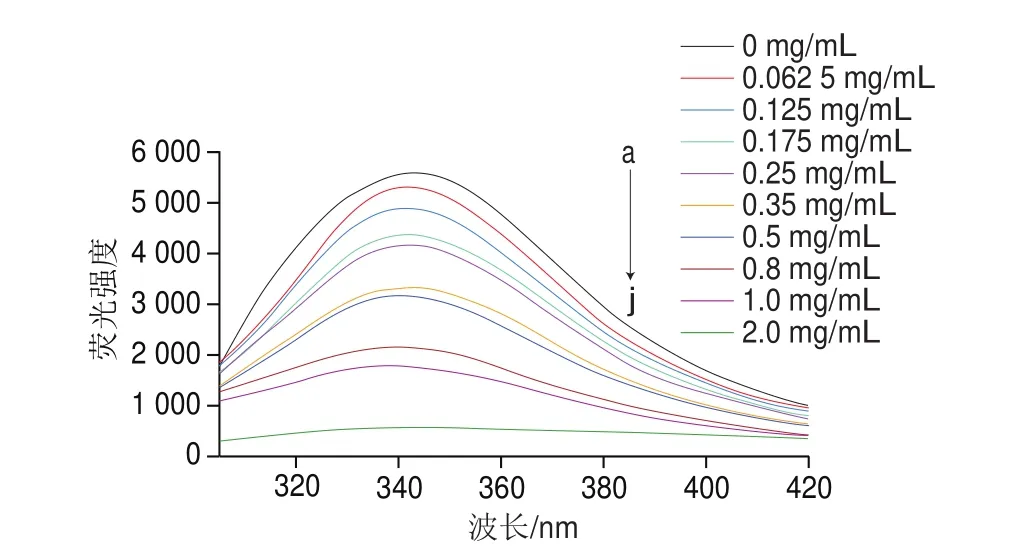
图 5 不同质量浓度的鼠尾草酸对淀粉酶荧光光谱的影响Fig. 5 Effect of different concentrations of carnosic acid on fluorescence spectrum of α-amylase
2.4 结合常数等相关参数的分析结果

式中:F0与F分别为未加入与加入猝灭剂后体系的荧光发射强度;[Q]为猝灭剂质量浓度/(mg/mL);Kq为荧光猝灭速率常数;τ0是不存在猝灭剂时物质的荧光平均寿命,一般生物大分子的荧光平均寿命为1h10-8s。
利用公式(2)对图5中数据进行线性拟合计算,可得Kq为1.1h1011L/(molgs)。此Kq大于最大散射碰撞猝灭速率常数2h1010L/(molgs),因此进一步确定鼠尾草酸猝灭α-淀粉酶的过程不是由分子碰撞引起的动态猝灭,而是形成复合物的静态猝灭过程[23]。
如果荧光剂与猝灭剂之间存在静态猝灭,可根据双对数回归曲线(公式(3))计算出结合位点n。
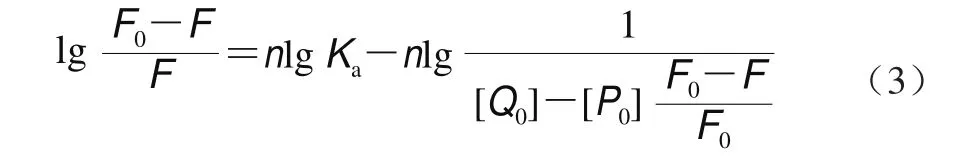
式中:[P0]为α-淀粉酶的质量浓度/(mg/mL);Ka为荧光与猝灭剂的表观结合常数;n为结合位点数;[Q0]为鼠尾草酸的质量浓度/(mg/mL)。
将图5中数据代入公式(3),经线性拟合后计算可得n≈1.114 1(表2),说明鼠尾草酸与α-淀粉酶所形成的复合物中二者的比例接近1∶1,暗示α-淀粉酶上可能只有一个鼠尾草酸结合位点。

表 2 鼠尾草酸对α-淀粉酶的荧光参数Table 2 Fluorescence parameters of α-amylase in the presence of carnosic acid
2.5 分子对接分析结果
由上述研究可知,鼠尾草酸与α-淀粉酶发生可逆的竞争性抑制,且鼠尾草酸与α-淀粉酶只有一个结合位点,因此可以推测鼠尾草酸竞争性结合在α-淀粉酶的活性中心。为了进一步确定鼠尾草酸在α-淀粉酶上的结合情况,进行了鼠尾草酸与α-淀粉酶的分子对接分析。结果如图6所示。作为竞争性抑制剂,鼠尾草酸可逆地结合到酶变构位点上,扰乱了α-淀粉酶的构象动力学,形成可逆的酶-抑制剂复合物,减少了底物与酶的结合。为进一步查看鼠尾草酸与α-淀粉酶作用的微环境,列出了结合位点附近对结合作用贡献较大的氨基酸残基(图6B),分别是Leu162、Gln63、Tyr62、Asp300、Gly306、Ser105、Ala198、His101、Tyr151、Val163、Ile235和Glu233,其中鼠尾草酸与Tyr151在空间上非常靠近。鼠尾草酸通过结合到Tyr151附近的疏水腔,引起周围氨基酸残基微环境发生变化,导致Tyr151周围包埋度增加,空间结构更加严密,从而表现出α-淀粉酶内源荧光的猝灭变化。

图 6 鼠尾草酸与α-淀粉酶的分子对接Fig. 6 Molecular docking model for carnosic acid with α-amylase

图 7 α-淀粉酶与鼠尾草酸相互作用的相应氨基酸残基Fig. 7 Amino acid residues for interaction between α-amylase and carnosic acid
从图7中可以看出,鼠尾草酸和α-淀粉酶之间形成了两个氢键。鼠尾草酸苯环上酚羟基的一个氧原子与附近氨基酸残基Glu233形成氢键,鼠尾草酸羧基上的氧原子与附近氨基酸残基Tyr151形成氢键,从而提高了鼠尾草酸-酶蛋白复合物的稳定性。Tyr151和Glu233为α-淀粉酶中催化活性中心的关键残基,这意味着鼠尾草酸能够与淀粉竞争α-淀粉酶的活性区域及改变酶的结构,并与活性中心残基形成氢键,从而会导致α-淀粉酶的催化效率降低[24],这与上述实验结果是一致的,也是鼠尾草酸对α-淀粉酶的抑制机理。
3 讨 论
糖尿病是一种由高血糖引起的慢性疾病,高糖饮食会导致血糖水平迅猛上升。膳食淀粉水解是血液中葡萄糖的主要来源,α-淀粉酶是淀粉分解和肠道吸收的关键酶,能催化淀粉、直链淀粉、支链淀粉、糖原和各种麦芽糊精的α-D-1,4-糖苷链,使其断裂成较短的低聚糖,其他的淀粉酶也参与了淀粉的分解过程,但是α-淀粉酶的贡献是这个过程开始的先决条件[25]。抑制α-淀粉酶活性可以有效控制血糖浓度,是治疗糖尿病的有效方法之一。α-淀粉酶抑制剂通过抑制α-淀粉酶的活性阻碍食物中碳水化合物的水解和消化,减少糖分的摄取,从而降低血糖水平[26]。α-淀粉酶已经作为治疗糖尿病的一个靶点,用来控制碳水化合物的消化和低聚糖的吸收[27]。多酚类、黄酮类物质如茶多酚、苦荞提取物等作为α-淀粉酶的抑制剂已经被广泛研究[28-29]。鼠尾草酸作为一种脂溶性天然抗氧化剂应用范围广泛,已用于油脂及含脂食品、生物医药、化工、化妆品和饲料等方面,除了可以延缓油脂或含油食品的氧化,提高食品的稳定性和延长贮存时间外,还具有良好的生理和药理活性[5]。从天然来源产物中寻找有效的α-淀粉酶抑制剂,对糖尿病的防治具有重要意义。
本研究探讨了鼠尾草酸对α-淀粉酶的抑制作用,并采用荧光光谱法和分子对接研究了两者之间相互作用的机理。酶促动力学研究结果显示,鼠尾草酸对α-淀粉酶活性的抑制具有明显的浓度依赖性,且鼠尾草酸以可逆的竞争性抑制方式与α-淀粉酶的活性位点结合,这与Sheng Zhanwu等的研究结果[7]相一致。当蛋白质和某些小分子发生反应时,体系的荧光性质会发生改变[30]。α-淀粉酶最大吸收波长在280 nm附近,主要由色氨酸(Trp)和酪氨酸(Tyr)侧链的光吸收引起,其波长或吸收强度变化可反映Trp和Tyr残基所处微环境的改变。鼠尾草酸对α-淀粉酶的荧光谱图结果显示,随着鼠尾草酸质量浓度的增加,其对α-淀粉酶的内源性荧光猝灭程度越来越强,通过对实验数据的计算可知,鼠尾草酸与α-淀粉酶之间存在一个结合位点,竞争性地与α-淀粉酶的活性中心结合,形成鼠尾草酸-α-淀粉酶复合物,从而抑制了α-淀粉酶的活性。同时,采用分子对接的方式模拟鼠尾草酸与α-淀粉酶的结合,结果发现鼠尾草酸与底物竞争性地结合在酶的活性中心。有研究表明鼠尾草酸是良好的供氢体,其苯环上含有两个羟基,苯环上的电子离域作用使酚羟基容易发生离子化,氢键在鼠尾草酸与α-淀粉酶的结合过程中发挥了有很大的作用[30]。鼠尾草酸通过与周围氨基酸残基发生相互作用,触发变构调节,使酶的构象发生紊乱,从而导致α-淀粉酶催化活性降低。
综上所述,鼠尾草酸能够很好地抑制α-淀粉酶的活性,从而阻碍食物中碳水化合物的水解和消化,减少糖分的摄取。为鼠尾草酸深层次研发利用提供理论依据。迷迭香作为一种天然的绿色植物,含有大量的活性成分,现代药理研究表明,该类成分多数具有降血糖、抗氧化和心血管等方面作用,对其进行深入研究,有望将其开发成为新一代治疗心脑血管系列疾病的药物[31]。迷迭香提取物作为一种天然抗氧化剂,由于其安全、高效的抗氧化性和较好的热稳定性,具有巨大的应用潜力。

