AMS测量海水129I的气载分离制样
王荣元,刘广山,姜 山,谢林波,邓春梅
(1.国家海洋局北海环境监测中心,山东 青岛 266033;2.山东省海洋生态环境与防灾减灾重点实验室,山东 青岛 266033;3.厦门大学环境与生态学院,福建 厦门 361005;4.中国原子能科学研究院,北京 102413)
129I是碘的所有同位素中半衰期最长的核素,其半衰期为15.7 Ma[1]。129I可分为天然来源和人工来源两部分。人类核活动是目前自然界中129I的主要来源,占到了地球129I总储量的90%以上[2-3]。
129I被认为是一种指示性核素,可应用于探知核设施的活动情况和探查未申报的核事件,在环境监测方面具有重要意义。另外,宇生的129I可用于研究5~80 Ma范围的宇宙射线变化、天体物质和深海沉积物年代等[4-5];地下成因的129I可应用于研究裂变产物的地球化学行为及迁移特征;最大点源释放的129I可以示踪水团组成和环流[6]。近年来人工129I对环境的影响深受关注,在环境监测的同时也为129I在其他方面的应用提供数据[7]。
环境中天然129I的丰度(129I/127I原子数比)≤10-12,由于核工业的发展,人工129I输入环境,使地表环境中的129I丰度提高,Snyder等(2010)研究发现,全球表层水体129I浓度从人为活动影响之前的104atoms/L提高到现代的1014atoms/L[8]。一般认为大洋表层水的129I丰度在10-10量级左右[9]。目前条件下,除非常临近核设施的环境外,只能用AMS进行环境中129I的测量。
AMS测定海水中129I的制样方法有多种,主要分为溶剂萃取法、离子交换提纯法、直接沉淀法和气载分离制样法。Buragh等(2000)先用NaHSO3将不同价态的碘还原成I-,添加氧化剂H2O2将I-氧化成碘单质,然后萃取浓缩碘单质,进而用NaHSO3反萃取,最后用AgNO3沉淀I-[10],此实验方案只针对体积较小(一般低于500 ml)的水样处理。Yiou(2004)等曾将银粉末加入到装有100 ml海水有密闭盖子的塑料离心管中,再加入硝酸,进而得到沉淀,后将沉淀转移至瓷坩埚中烘干,最后得到测量所需要的样品[11]。对于大体积水样,蒋崧生等(2000)利用强碱性阴离子交换树脂富集大体积水样品中的碘,然后再对碘离子进行沉淀[7]。Ashton等(1999)用氢氧化钠从混凝土样品中浸取氯和碘,然后加入适当的氧化剂有选择的将卤化物转化成卤素,气态的卤素转移至装有氢氧化钠的溶液中被其吸收,向吸收了气态碘的氢氧化钠溶液中加入适量的盐酸羟胺,然后加入硝酸银溶液产生沉淀,沉淀经洗涤、烘干、称重后,计算出载体的回收率,碘的活度在井型晶体探测器中检测[12]。
本研究在前述工作的基础上,通过改进实验方案,提出了一种AMS测量海水129I的气载分离制样方法,设置了2套吸收装置,操作简单,全程回收率在50%~70%,可以处理体积小于5 L的海水样品;同时本方法可用于固态、液态、气态样品中129I的制样,适用范围广。使用此方法成功制取了采集自南极、北极、东太平洋和黄海的4个样品,并进行了AMS检测。
1 材料与方法
1.1 样品
4个海水样品采集自南极、北极、东太平洋和黄海,样品信息和采样站位见表1。
1.2 主要仪器
加速器质谱(原美国高压工程公司生产的HI-13串列加速器,端电压可以达到13MV,采用Cs+溅射负离子源)、高纯氮气、三孔烧瓶、离子交换柱。

表1 海水采样站位、采样时间
1.3 主要试剂
碘载体:KIO3(AR)、0.5 mol/L NaNO2溶液:称取NaNO2(AR)固体17.25 g置于1 L烧杯中,用500 mL去离子水溶解,搅拌均匀,转移入试剂瓶中备用。
0.5 mol/L Na2SO3溶液:称取NaSO3(AR)固体31.5 g置于1 L烧杯中,用500 mL去离子水溶解,搅拌均匀,转移入试剂瓶中备用。0.1 mol/L H2SO4溶液:量取约2.72 mL浓硫酸(AR),边搅拌边缓慢加到去离子水中,稀释至500 mL,搅拌均匀,待达到室温时转移入试剂瓶中备用。4.0 mol/L HNO3溶液:量取约25 mL浓硝酸(AR),用去离子水稀释至100 mL,搅拌均匀,转移入试剂瓶备用。
0.1 mol/L AgNO3溶液:称取1.70 g AgNO3(AR)固体置于200 mL烧杯中,用100 mL超纯水溶解,搅拌均匀,转移入棕色试剂瓶中备用。0.5 mol/L KNO3溶液:称取KNO3固体50.6 g置于1.5 L烧杯中,用1 L去离子水溶解,搅拌均匀,转移入试剂瓶中备用。2.0 mol/L KNO3溶液:称取KNO3固体202.2 g置于1.5 L烧杯中,用1 L去离子水溶解,搅拌均匀,转移入试剂瓶中备用。
20 g/L淀粉溶液:将1 g可溶性淀粉溶于5 mL冷水中,用力搅拌均匀后,缓缓倾入45 mL沸水中,随加随搅拌,继续加热至沸,2 min后,即得到所需溶液。树脂(Bio-Rad AG-8,美国伯乐分析纯)、聚碳酸酯滤膜(MILLIPORE,0.4 μm,Ф=47 mm)。

图1 制样流程
1.4 制样流程
制样流程图见图1。准确移取海水样品2 L于2.5 L烧杯中,准确称取KIO3载体约13.500 mg,加入烧杯中,搅拌均匀。用6 mol/L H2SO4溶液调节溶液的pH,使pH<2。后将溶液转入三孔烧瓶中,加入1 mL 0.5 mol/L Na2SO3溶液,开启鼓气装置,使溶液混合均匀,反应完全(图2)。约15 min后,停止鼓气。向三孔烧瓶中缓慢加入1 mL 0.5 mol/L NaNO2溶液(过量),使其充分的加入到体系中,然后再开启鼓气装置,使溶液混合均匀,反应完全。开启加热装置,加热2 h后,关闭加热装置,取下吸收瓶,合并吸收液。
将吸收液通过阴离子交换树脂,淋洗液单独收集;先用100 mL 0.5 mol/L KNO3溶液淋洗离子交换柱,洗脱NO2-、Cl-、SO42-、SO32-,淋洗液单独收集;再用200 mL 2.0 mol/L KNO3溶液淋洗离子交换柱,将树脂吸附的I-洗脱下来,淋洗液单独收集。溶液用4 mol/L HNO3溶液酸化,加入2 mL 0.1 mol/L AgNO3溶液生成AgI沉淀,黑暗处放置过夜。用聚碳酸酯膜(已知质量)抽滤,依次用milli-Q水-硝酸溶液-milli-Q水洗涤沉淀,取下滤膜并折叠,放入塑料培养皿中,用锡箔纸包裹避光,60 ℃烘箱中烘干,称重,计算载体的回收率。AgI沉淀将用于AMS分析测试使用(图3)。

图2 两种吸收装置

图3 AgI沉淀和最终样品
2 结果和讨论
2.1 样品分析结果和讨论
应用此装置和方法进行了大洋水中129I的制样和AMS测量,4个样品中129I丰度处于10-8水平(表2)。北冰洋丰度最高为6.11×10-8;南大洋次之,为4.64×10-8;中太平洋的129I丰度最低,为2.36×10-8~2.72×10-8。这些结果与文献报道的相近海域129I丰度水平一致,低于人工放射性严重影响海域的129I丰度水平。
北冰洋是受人为活动影响较大的海域,其内部超过90%以上的129I主要来自于Sellafield和La Hague核燃料后处理厂的排放。有研究认为,高浓度的放射性水团随挪威沿岸流部分进入巴伦支海(129I浓度水平可达到1010atoms/L水平),甚至能够达到拉普捷夫海和加拿大海盆北部[18-19]。本研究结果显示在加拿大海盆表层海水中129I浓度达到了1010atoms/L水平,与前述研究结果吻合,证实了加拿大海盆表层水中高浓度的129I来自于挪威沿岸流携带的高浓度放射性水团。
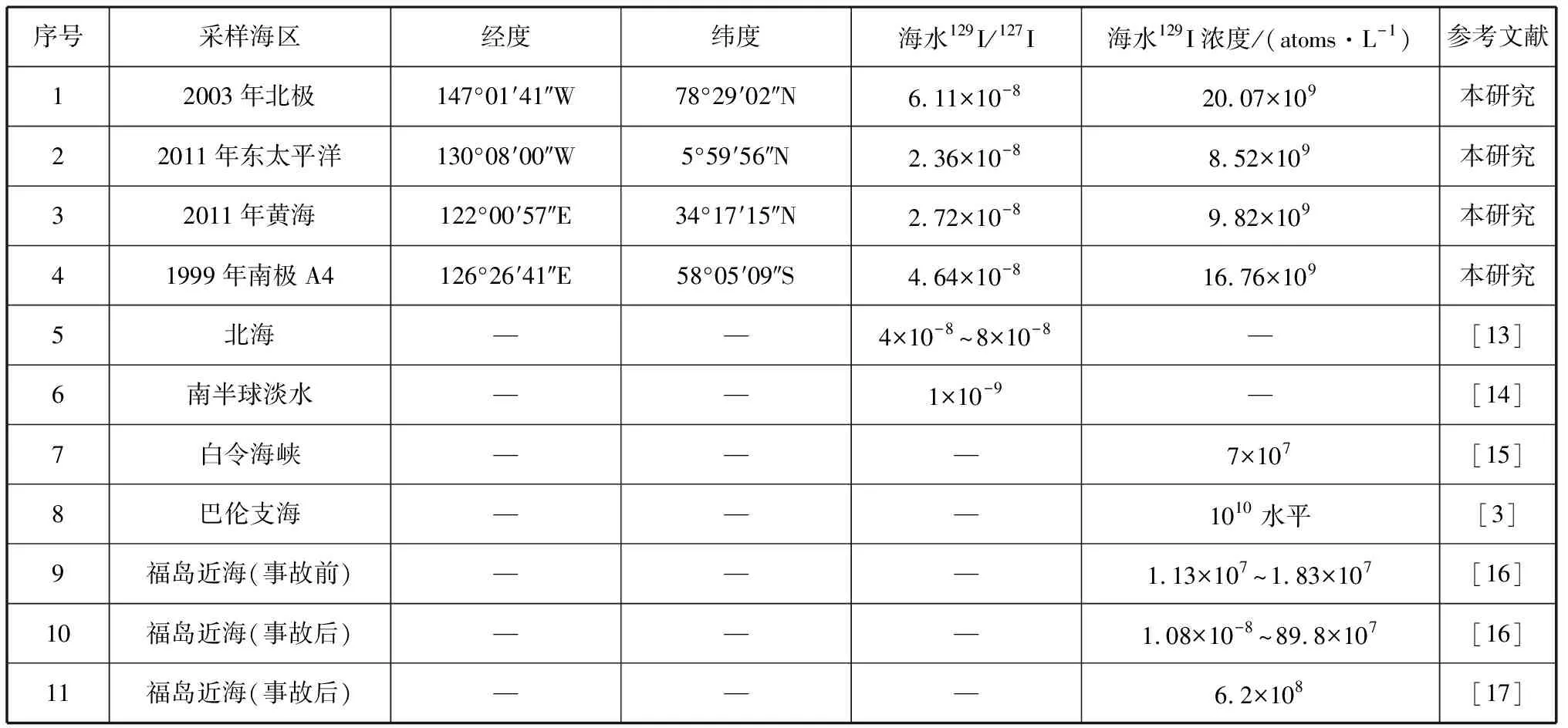
表2 大洋水中129I的检测结果
2011年3月福岛核事故向环境中释放了大量的放射性污染物,本研究2011年11—12月在太平洋中东部和中国黄海两个站位采集了表层海水进行分析,结果显示福岛事故后海水129I浓度是事故前129I浓度的102倍。结果表明,福岛核事故产生的放射性污染物在洋流和大气运移的作用下,对太平洋产生了一定影响。
2.2 样品制备方法讨论
目前海水中129I分离制样的主流方法为溶剂萃取法和离子交换提纯法。溶剂萃取法主要通过氧化还原反应将海水样品中多种形态的碘转化成单质形态,然后使用有机试剂CCl4或CHCl3进行多次萃取反萃取,最后加入AgNO3形成AMS测定需要的样品形式,此方法的回收率可达到80%~95%,但由于有机试剂具有较大毒性,对实验人员存在一定的危害,同时此方法的操作步骤较为繁琐。离子交换提纯法主要使用离子交换树脂实现对大体积海水的纯化,得到较小体积的洗脱液,然后使用溶剂萃取法制取AMS测定需要的样品,此方法的回收率可达到60%~80%,但由于离子交换树脂存在一定的柱容限制,需要根据样品的数量更换离子交换树脂,成本较大,同时离子交换是一个缓慢的过程,耗时较长。
通过对比分析发现,本研究构建的空气吹出制样方法配合使用双瓶吸收装置或纤维吸附装置,避免了有机试剂的使用;整个制样流程在密闭环境中进行,减少了碘的损失;将大体积海水样品浓缩后使用离子交换树脂进行纯化,缩短了纯化时间;此方法的适用范围较广,生物和沉积物样品经消化后,即可按照海水的制样流程进行样品的制备。
3 结论
研究中以milli-Q水作为试剂空白,加入2mg载体KIO3,在没有优化加入试剂量和载气流量等实验条件下的情况下,鼓气4 h,分光光度法测量吸收液中总碘含量,得到此装置气载分离碘的回收率>50%,纤维吸附装置分离碘的回收率达到70%。
气载分离制样方法和装置应用于AMS测定海水中129I的制样切实可行,并且能够取得良好地效果,但在后续的实验中还需进一步完善实验流程,优化实验条件;设计更为合理的实验装置,缩短样品制备时间,满足吸收装置简单易更换的要求。

