深海贝莱斯芽孢杆菌DH82的抑菌活性物质初步分离纯化及其抑菌谱检测
王青华,唐 旭,孙晓晖,万婧倞,黄仕新,徐长安
(自然资源部第三海洋研究所、自然资源部海洋生物资源综合利用工程技术研究中心,福建 厦门 361005)
细菌、真菌性病害是动植物养殖、种植产业的重要灾害,严重制约了动植物养殖、种植生产的持续发展。迄今,传统化学药物和抗生素的应用仍然是控制病害的主要措施,但长期、大剂量、大面积的不正当使用,造成病原菌耐药、药物残留等问题日渐显现,对人类的健康造成极大的安全隐患[1-2]。随着人民生活水平提高,人民对无公害食品的要求日益高涨,开发和利用生防菌防治水产病害的方法受到了广泛的关注。
深海有着极其丰富的物种多样性,其多种复杂独特的生境,包括热液口、冷泉等,造就了有着独特功能的海洋微生物,是国家重要的战略储备资源,同时具有巨大的研发空间和应用开发潜力[3-4]。芽孢杆菌是广泛存在于自然界之中的非致病性细菌,繁殖能力和环境耐受性强,能产生多种抑菌物质,具有巨大的开发利用价值[5-6]。相对于陆地芽孢杆菌,深海芽孢杆菌生活在非常特殊的高温、高压、高污染环境里,决定了其次级代谢产物更丰富、结构新颖和具有特异的生物活性,同时赋予深海芽孢杆菌产生具有新型抑菌活性物质的能力[7]。
据报道,研究者已从深海芽孢杆菌中获得了不少生物活性物质。张少博等(2013)从深海独岛枝芽孢杆菌(Virgibacillusdokdonensis)A493分离到新的氨基糖苷类抑菌活性物质,其抑菌谱有特异性[8];吕倩等(2014)从南海深海里筛选到Bacillusmethylotrophicus,该菌产抗真菌活性的bacillomycin Lc类脂肽[9];Li等(2016)从深海枯草芽孢杆菌(B.subtilis)B5中提取到一种新的macrolactin A衍生物,该成分能防控茶病原真菌包括茶拟盘多毛孢(Pestalotipsistheae)和胶孢炭疽菌(Colletotrichumqloeosporioides)[10];龙彬等(2014)从深海解淀粉芽孢杆菌(B.amyloliquefacien)分离出12个化合物,其中化合物9(4-羟基脯氨酸-亮氨酸)对番木瓜炭疽菌(C.papayae)和香蕉黑星菌(Phyllosticamusarum)有中等抑菌活性[11]。作者从深海微生物中筛选到一株贝莱斯芽孢杆菌DH82(BacillusvelezensisDH82),前期研究发现其产的抗菌蛋白有较好热稳定性,不受木瓜蛋白酶、蛋白酶K、胃蛋白酶及胰蛋白酶影响。
贝莱斯芽孢杆菌是一类非常重要的有生防潜力的细菌[12]。近年来,人们把贝莱斯芽孢杆菌对陆地动、植物病原细菌类或病原真菌防治分别进行研究,很少把病原细菌和病原真菌整合在一起进行防治研究,并且针对贝莱斯芽孢杆菌产生的抑菌物质对水产病原菌的防治效果的报道更是寥寥无几[13-15]。本研究就贝莱斯芽孢杆菌DH82产生抗菌蛋白进行初步分离及其对水产病原细菌和植物病害真菌的拮抗作用进行了研究,以期为抗菌蛋白进一步开发应用奠定基础。
1 材料及方法
1.1 材料
1.1.1 菌株 出发菌:出发菌DH82分离自蛟龙号第150潜次中西太平洋雅浦海沟6 000 m深的海水样品,经16S rDNA(GenBank登录号:MK203035)和gyrB同源性序列对比分析,结合其形态学和生理生化特性,鉴定出发菌DH82为贝莱斯芽胞杆菌BacillusvelezensisDH82,在改良LB(Luria Broth)斜面固体培养基4 ℃保存。
指示病原细菌:迟缓爱德华氏菌(Edwardsiellatarda)、副溶血弧菌(Vibrioparahaemolyticus)、溶藻弧菌(V.alginolyticus)由厦门大学生物实验室提供,在LB斜面固体培养基4 ℃保存;坎氏弧菌(V.campbellii)、嗜水气单胞菌(Aeromonashydrophila)、肠炎沙门氏菌(Salmonellaenteritidis)由中国海洋微生物菌种保藏管理中心MCCC 提供,在LB斜面固体培养基4 ℃保存;哈维氏弧菌(V.harveyi)由中国海洋微生物菌种保藏管理中心MCCC提供,在改良Zobell 2216E斜面固体培养基4 ℃保存;大肠杆菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonasaeruginosa)、金黄色葡萄球菌(Staphylococcusaureus)由本实验室提供,在LB斜面固体培养基4 ℃保存。无乳链球菌(Streptococcusagalactiae)由广东微生物菌种保藏中心提供,在TSB(Tryptic Soy Broth)斜面固体培养基4 ℃保存。
指示病原真菌:层生镰刀菌(Fusariumproliferatum)、笄霉属(Choanephora)和水贼镰刀菌(Fusariumequisetum)分离自感染植物病害的蔬菜,由本实验室提供,在PD(Potato Dextrose)斜面固体培养基4 ℃保存。灰葡萄孢菌(Botryiscinerea)由中国典型培养物保藏中心提供,在PD斜面固体培养基4 ℃保存。
1.1.2 培养基 LB培养基(1 000 mL):蛋白胨10 g、酵母粉5 g、氯化钠10 g、pH=7.3,改良Zobell 2216E培养基(1 000 mL):蛋白胨5 g、酵母提取物1 g、天然过滤海水∶纯水=2∶1、pH=7.6,用于病原细菌培养;改良LB 培养基(1 000 mL):胰蛋白胨10 g、酵母粉5 g、氯化钠5 g、pH=7.3,用于菌株DH82种子液培养及发酵;PD培养基(1 000 mL):马铃薯200 g、蔗糖20 g、pH=6.7,用于病原真菌的活化及培养。
1.2 方法
1.2.1 抗菌蛋白的初步分离纯化 ①菌株DH82的发酵上清液制备。将菌株DH82活化菌液接种至500 mL培养基(1 L 锥形瓶),接种量5 mL,37 ℃,180 r/min,24 h后,发酵液离心(4 ℃,10 000 r/min,10 min)弃菌体,过0.22 μm微孔滤膜,得到发酵上清液。② 硫酸铵的分级沉淀。取500 mL发酵上清液,向其中缓慢加入固体硫酸铵至饱和度分别为30%、40%、50%、60%、70%、80%、90%,4 ℃,过夜沉淀,4 ℃,10 000 r/min,离心20 min,收集沉淀。用纯水复溶沉淀,于3 000 Da透析袋中除盐,透析18 h,以迟缓爱德华氏菌为指示菌,用改良琼脂扩散法检测各组分抑菌活性[16-17]。③ Sephadex G-75柱层析。Sephadex G-75用超纯水浸泡24 h,充分溶胀后,装柱(1.6 cm×50.0 cm);用超纯水平衡24 h,上样,上样量为5 mL,超纯水洗脱,流速2 mL/min,核酸蛋白检测仪(HD-5电脑紫外检测仪购上海泸西分析仪器厂有限公司)280 nm检测,分管收集,每管收集8 mL,以迟缓爱德华氏菌为指示菌,检测抑菌活性,收集具有抑菌活性的洗脱部分。
1.2.2 抗菌蛋白抑菌谱测定 ①改良琼脂扩散法测定。取1.5 mL新鲜的指示病原细菌液(在18 mm×180 mm试管于37 ℃培养12 h)接种于150 mL的LB/改良Zobell 2216E(46 ℃)固体培养基中,迅速摇匀倒入培养皿中(9 cm 规格),凝固后用无菌打孔器(直径8.58 mm)在抑菌板上打孔,并用灭过菌的牙签挑出培养基块。每孔加入50 μL待检测液,在超净台中吹干后置于37 ℃,培养12 h后观察是否有抑菌圈,测量抑菌圈的直径。②滤纸片法测定[18]。滤纸裁剪成直径为8.58 mm的圆形滤纸片,121 ℃高压灭菌,干燥备用。用无菌水冲洗产孢子的病原真菌,把孢子浓度配置成1×104CFU/mL,然后按10%接种量接到冷却至46 ℃的PD固体培养基上,迅速混匀倒平板。用无菌镊子取无菌的滤纸片放置在抑菌板上,用移液枪在每个滤纸片上滴加待检测液,设置3个重复。对照组只加无菌水,28 ℃倒置培养至对照组的菌落长满平板,测量各抑菌活性物质的抑菌圈直径。③分离纯化蛋白抑菌谱检测。纯化后的抗菌蛋白液采用琼脂扩散法和滤纸片法对上述指示病原菌进行抑菌活性检测,检测方法分别参照上文。
1.2.3 最小抑菌浓度(MIC)测定 ①菌悬液的制备。病原细菌的菌悬液制备:将病原细菌接种在LB固体平板37 ℃,12~24 h;用接种环刮取少量菌体,放入生理盐水中,漩涡震荡混匀,用麦氏比浊管(购自广东环凯微生物科技有限公司)计算细菌的浓度,分别稀释至浓度为2×104CFU/mL。病原真菌的菌悬液制备:将病原真菌接种在PD固体平板28 ℃,4~6 d;用沾无菌水的接种环刮取少量孢子,放入无菌水,漩涡震荡混匀,血球计数板计数,稀释至浓度为2×104CFU/mL。②蛋白质含量测定。蛋白质含量采用改良型BCA(Bicinchoninic acid)法测定。改良型BCA法蛋白质浓度测定试剂盒购自生工生物工程(上海)股份有限公司。配置相应浓度的标准蛋白质溶液,取5 μL相应浓度的标准蛋白质溶液或样品加5 μL已配置好溶液F(烷基化试剂+Tris缓冲液),混匀,于37 ℃,30 min后加200 μL BCA工作液,混匀,于37 ℃,30 min,冷却至室温后,在562 nm处测定吸光度,做标准曲线,在标准曲线上计算出各蛋白质含量。③最小抑菌浓度(MIC)测定。抗菌蛋白对病原菌作用效果通过进行最小抑菌浓度的测定获得[19]。在96孔板每孔加入培养指示菌的空白培养基100 μL,在A/B/C三排的第一孔加配好待检测液100 μL,然后对待检测液进行二倍稀释。即第一孔加入待测液后,用移液枪充分吹打三次,使待测液与培养基充分混匀,吸取100 μL加入第二孔,充分吹打混匀,照此重复直至最后一孔,吸取100 μL弃去;再在每一孔加入稀释好的菌悬液100 μL;在同一块板上的G排做好阴性对照(仅加200 μL空白肉汤)和在H排上做一排阳性对照(加100 μL菌液100 μL空白培养基),96孔板放入恒温培养箱,病原细菌:37 ℃,18~24 h;病原真菌:28 ℃,48~72 h,观察抑菌效果。
2 结果与分析
2.1 抗菌粗蛋白沉淀的最佳硫酸铵饱和度
不同硫酸铵饱和度提取的粗蛋白对迟缓爱德华氏菌的抑菌效果。如图1所示,硫酸铵饱和度为70%时,所提取的粗蛋白抑菌活性最高。随着硫酸铵饱和度不断增加,所提取的蛋白抑菌活性没有继续增加,说明硫酸铵饱和度为70%时,抗菌粗蛋白几乎已经沉淀完全。因此,提取抗菌粗蛋白的最佳硫酸铵饱和度为70%。

图1 不同硫酸铵饱和度提取的粗蛋白抑菌活性
2.2 抗菌粗蛋白Sephadex G-75柱层析
将菌株DH82的发酵上清液经硫酸铵饱和度70%盐析,提取的抗菌粗蛋白液经Sephadex G-75柱层析分离,从图2看出,抗菌粗蛋白被分离出2个峰。峰Ⅰ所对应的收集管T8、T9,其管液检测均有抑菌活性,该峰蛋白命名为PrI;峰Ⅱ所对应的收集管为T12、T13、T14,其管液检测均有抑菌活性,该峰蛋白命名为PrII。表明峰蛋白PrI和峰蛋白PrII都是有抑菌活性的目标蛋白。
2.3 抗菌蛋白抑菌谱
2.3.1 峰蛋白PrI和PrII对水产病原细菌的拮抗作用 将峰蛋白PrI和PrII对上述常见指示水产病原细菌进行拮抗实验,得到其抑菌作用效果。如表1所示,峰蛋白PrI和PrII分别对迟缓爱德华氏菌、嗜水气单胞菌、坎氏弧菌、溶藻弧菌、无乳链球菌和金黄色葡萄球菌有较好抑菌活性,其中峰蛋白PrII对哈维氏弧菌也具有较好抑菌活性;峰蛋白PrI和PrII分别对副溶血弧菌、铜绿假单胞菌、肠炎沙门氏菌、大肠杆菌作用未检出,其中峰蛋白PrI对哈维氏弧菌作用也未检出;表明峰蛋白PrI和PrII对某些常见水产病原细菌具有较好抑菌活性。
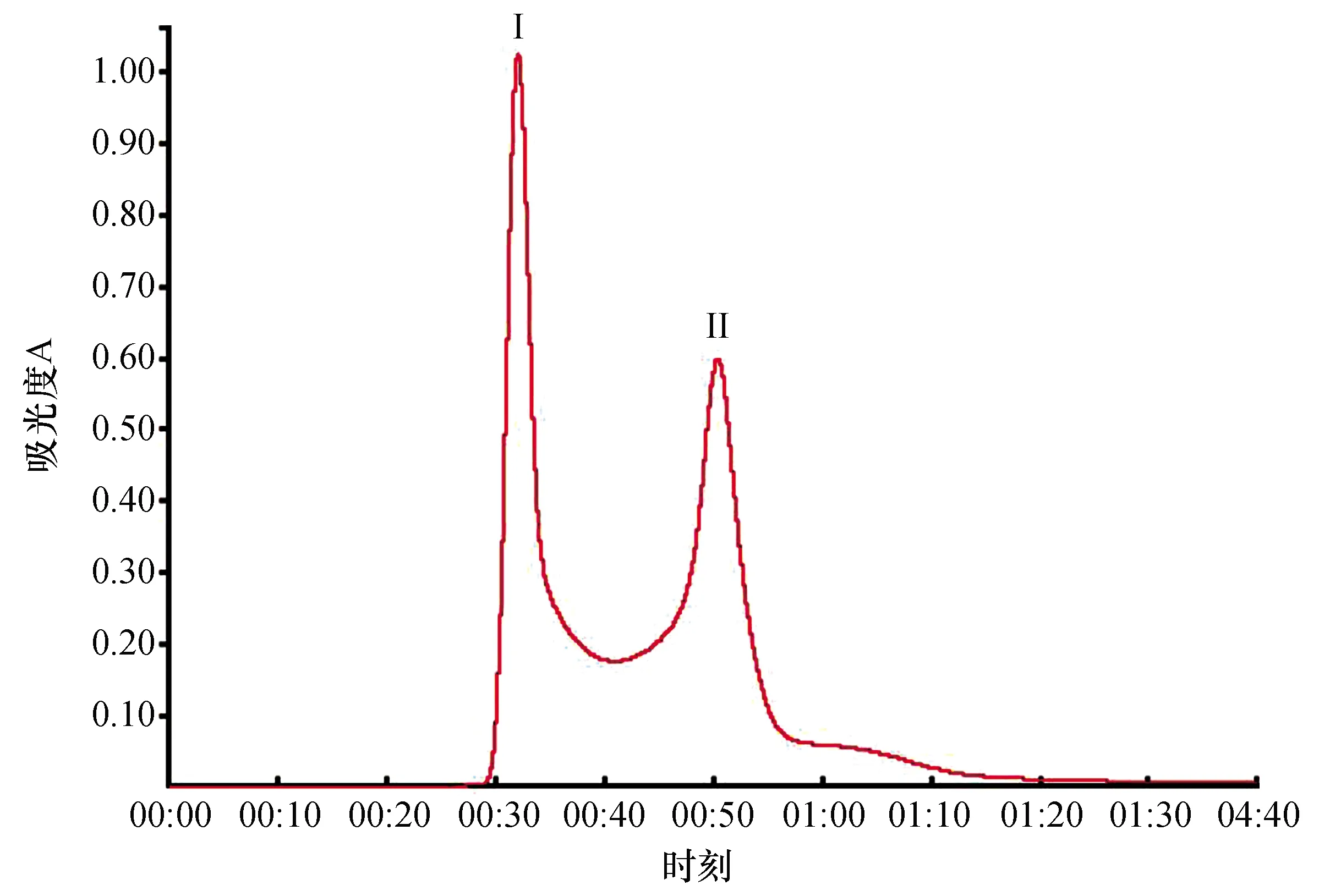
图2 抗菌粗蛋白Sephadex G-75层析图
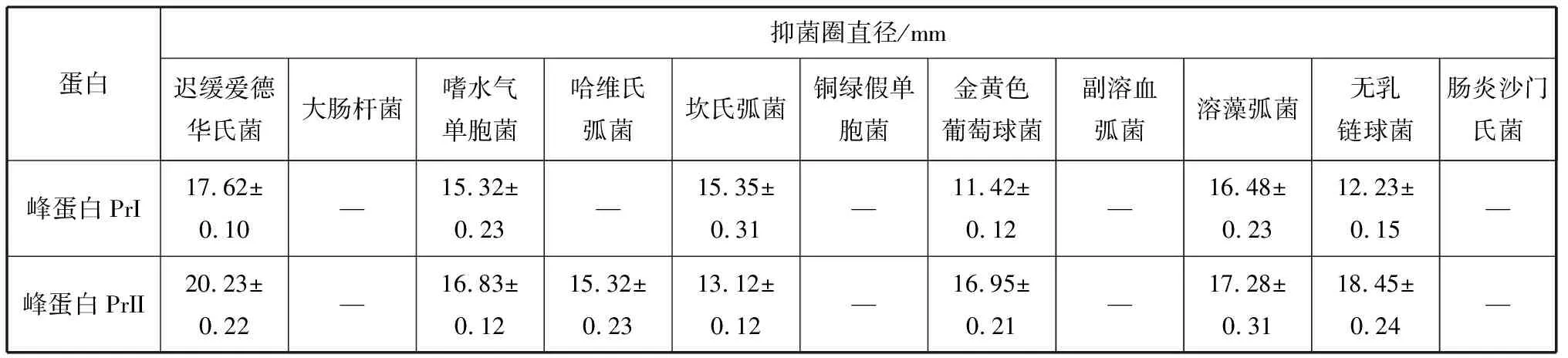
表1 峰蛋白PrI和PrII对11种水产病原细菌的拮抗作用
2.3.2 峰蛋白PrI和PrII对植物病原真菌的拮抗作用 将峰蛋白PrI和PrII对上述4种指示植物病原真菌进行拮抗实验,其抑菌效果由表2所示,峰蛋白PrI和PrII分别对层生镰刀菌、笄霉属和灰葡萄孢菌抑菌作用未检出,但峰蛋白PrII对水贼镰刀菌有较好抑菌活性,峰蛋白PrI对水贼镰刀菌抑菌作用未检出。

表2 峰蛋白PrI 和PrII对4种植物病原真菌的拮抗作用
2.4 抗菌蛋白对病原菌的最低抑菌浓度(MIC)
2.4.1 标准曲线的绘制 使用改良BCA法进行蛋白浓度测定,以标准牛血清蛋白溶液的蛋白浓度(μg/mL)作为横坐标,以其吸光度为纵坐标,绘出标准曲线,如图3所示,得出线性回归方程y=0.000 2x-0.001 5,相关系数是0.999 3。
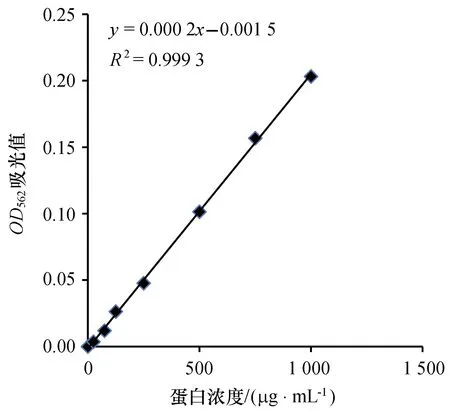
图3 牛血清蛋白标准曲线
2.4.2 峰蛋白PrI和PrII对水产病原细菌的最低抑菌浓度(MIC) 峰蛋白PrI和PrII分别对7种常见水产病原细菌的最低抑菌浓度值如表3所示。可以看出,峰蛋白PrI对迟缓爱德华氏菌和溶藻弧菌的MIC最低,对金黄色葡萄球菌的MIC最高。峰蛋白PrII对迟缓爱德华氏菌的MIC最低,对嗜水气单胞菌、溶藻弧菌、无乳链球菌和金黄色葡萄球菌的MIC都较低,对哈维氏弧菌的MIC最高。
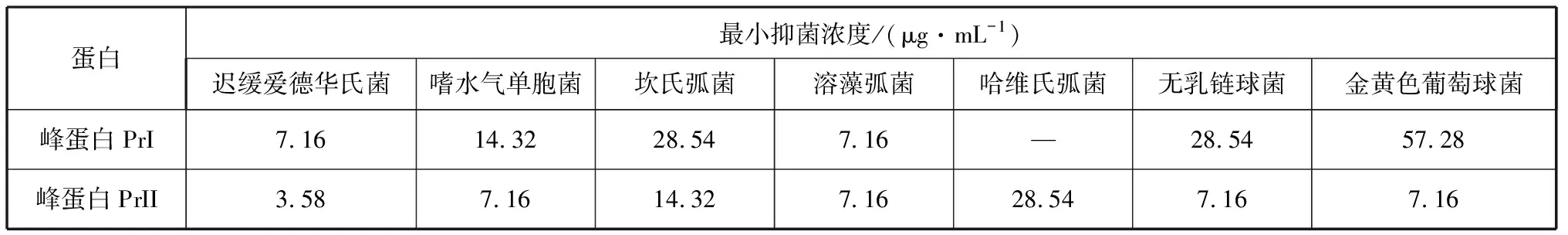
表3 峰蛋白PrI和PrII拮抗7种水产病原细菌的MIC测定
2.4.3 峰蛋白PrII对植物病原真菌的最低抑菌浓度(MIC) 峰蛋白PrII对水贼镰刀菌的MIC为7.16 μg/mL,表明峰蛋白PrII在较低MIC就能抑制水贼镰刀菌。
2.5 讨论
贝莱斯芽孢杆菌是具有广谱抑菌活性的拮抗细菌,其主要通过产生抗菌物质包括抗菌蛋白和脂肽类抗生素来发挥抑菌活性[20-21]。贝莱斯芽孢杆菌DH82沉淀抗菌粗蛋白的硫酸铵最佳饱和度是70%,与李姝江等(2013)盐析抗菌粗蛋白的所需硫酸铵最佳饱和度50%有一定差异[20],与黄铭慧(2017)盐析的抗菌粗蛋白所需硫酸铵最佳饱和度70%一致[22]。
贝莱斯芽孢杆菌DH82发酵上清液经Sephadex G-75柱层析分离得到的两个峰蛋白PrI和PrII对常见水产病原细菌抑菌谱都相对较广,且对迟缓爱德华氏菌和溶藻弧菌的最小抑菌浓度(MIC)都较低,可为针对这两种病原细菌进一步开发杀菌剂奠定基础。峰蛋白PrII对引起植物病害的水贼镰刀菌有较好的抑菌活性,对灰葡萄孢菌、笄霉属、层生镰刀菌均无抑菌活性,这与一些文献报道不一致,如Kaki等(2013)从金盏花根际分离的贝莱斯芽孢杆菌分泌的脂肽对尖孢镰刀菌(F.oxysporum)和葡萄孢菌有抑制作用[21];另外,有研究者报道了贝莱斯芽孢杆菌对镰刀菌属有拮抗作用,并用于禾谷镰刀菌(F.graminearum)引起的小麦赤霉病和对尖孢镰刀菌引起的植物枯萎病的防控[23-25],但在对水贼镰刀菌引起的枯萎病防治还未有报道,这些差异有待以后进一步研究探讨。峰蛋白PrII对嗜水气单胞菌、无乳链球菌、金黄色葡萄球菌和水贼镰刀菌的MIC都较低(7.16μg/mL),这在常见水产病原细菌和个别植物真菌病害防治上有较好的利用价值。另外,随着生物质谱技术和分离技术快速发展[26-27],可用这些技术来进一步分离和纯化该抗菌蛋白,为克隆表达相关抑菌功能基因奠定基础,并进而利用基因工程技术规模化制备生产该抗菌蛋白,为生产绿色水产品和农产品服务。
3 结论
本研究结果表明,贝莱斯芽孢杆菌DH82的抗菌粗蛋白中分离出两个具有抑菌活性的峰蛋白PrI和PrII,峰蛋白对常见水产病原细菌有较广谱的抑菌活性,对迟缓爱德华氏菌和溶藻弧菌的最小抑菌浓度(MIC)都较低,其中峰蛋白PrII对植物病害真菌水贼镰刀菌也有较好的抑菌活性,且峰蛋白PrII对嗜水气单胞菌、无乳链球菌、金黄色葡萄球菌和水贼镰刀菌的MIC都较低。因此,贝莱斯芽孢杆菌DH82作为生防菌在常见水产细菌性病害的防治及由水贼镰刀菌感染引起的植物枯萎病防治上有较好的开发利用价值。

