四氢噻吩与硫酸镁热化学还原生成H2S机制
王新伟, 马 强, 韩超杰, 林日亿
(1.中国石油大学(华东)新能源学院,山东青岛 266580; 2.青岛市化石能源高效清洁利用工程研究中心,山东青岛 266580;3.中国石油天然气管道工程有限公司,河北廊坊 065000; 4.潍坊市政工程设计研究院有限公司,山东潍坊 261061)
注蒸汽热采是稠油/超稠油油藏开发最有效的方式之一,然而高温高压水蒸汽的注入会诱发储层中的地层水、原油以及岩石之间发生复杂的化学反应而产生硫化氢(H2S)和二氧化碳(CO2)等酸性气体[1-2]。随着注汽开发时间的延长以及注汽品质的提高,储层温度不断升高,井口硫化氢的浓度也越来越高[3],给稠油油田的安全生产带来巨大隐患。因此,探索稠油热采次生硫化氢的生成机制及影响因素,进而制定有效的硫化氢防治措施,对于稠油资源的安全高效开发具有重要意义。自然界中H2S成因大体分为3大类[4]:一是硫酸盐还原菌对硫酸盐异化还原代谢(bacterial sulfate reduction,BSR)的生物成因;二是有机质热裂解(thermal decomposition of sulfides,TDS)及硫酸盐热化学还原(thermochemical sulfate reduction,TSR)的热化学成因;三是火山喷发的无机成因。稠油注汽热采初期未出现H2S,说明原始油藏并不含H2S气体,即无机成因可能性不大;注汽开发的高温高压环境又不利于还原菌的繁衍,生物成因的可能性也不大。目前,普遍认同热化学成因是稠油热采H2S生成的主要来源[3,5-7]。朱光有等[5]研究表明,四川盆地气田的H2S主要来源于TSR反应,且H2S的生成量与石膏层的分布密切相关。针对辽河油田齐40块进行的H2S成因实验模拟研究表明[3],原油中TDS反应是H2S的主要来源,其次是TSR反应,两种成因受开采时间、开采方式及油藏温度等多种因素控制。黄毅等[8]采用硫同位素分馏原理对硫元素去向进行追踪,同样表明辽河油田稠油热采H2S主要来源于TDS反应,TSR反应为辅。综上可见,热化学反应确实是稠油热采中次生H2S的主要来源,其中TDS有机质的热裂解反应路径较为简单,而TSR反应因参与反应的物质成分复杂、路径各异,至今未获得确切的TSR反应路径及其影响因素。Orr等[9]研究表明,硫酸根离子SO42-和烃类气体在较高温度下发生TSR反应生成H2S气体。Goldhaber等[6]采用稳定硫同位素法证实了TSR反应生成的H2S中34S来源于硫酸根,且TSR反应速率受限于固态硫酸盐矿物的溶解速率。Bildstein等[10]通过实际地质条件下TSR反应模拟,同样获得TSR反应动力学受溶液酸碱性、催化剂、有机化合物的组分以及硫酸盐的溶解度等多重因素制约。Ma等[11]研究表明,由于对称结构的SO42-是非常稳定的,在没有催化剂作用下,SO42-反应的可能性是极低的。地层条件下TSR反应直接生成H2S的是原油有机物与HSO4-和[MSO4]CIP反应,而不是与“游离”的SO42-反应。Zhang等[12]通过碳氢化合物与硫酸盐的实验模拟研究表明,发生TSR反应的过程可简化为3个反应,即HC与HSO4-反应生成H2S,H2S和HC反应生成含硫有机物,不稳定含硫有机物再与HSO4-和[MSO4]CIP生成H2S。Amrani等[16]通过正辛烷和CaSO4的TSR实验发现,有机硫和无机硫化物均能使TSR反应速率提高,有机硫化物对反应速率的影响远高于H2S和硫单质。Qiao等[13]进行了原油中大小分子烃类对TSR反应的影响研究。张水昌等[7]进行了TSR反应的启动机制及控制因素研究。He等[14]通过石膏和硫酸镁与稠油的TSR反应研究表明,非烃类气体是由石膏和MgSO4反应生成的,含石膏的TSR反应强度和速率较含MgSO4反应小。综上研究表明,油藏中的TSR反应为烃-水-岩三者之间的复杂化学反应,影响因素多,反应的机制和路径尚不清楚,四氢噻吩是稠油中具有代表性的含硫有机化合物,MgSO4的TSR反应最强。因此,笔者以四氢噻吩和硫酸镁为反应物,进行高温高压TSR模拟实验,通过反应后气相、液相分析,探索TSR反应的机制及路径。
1 实 验
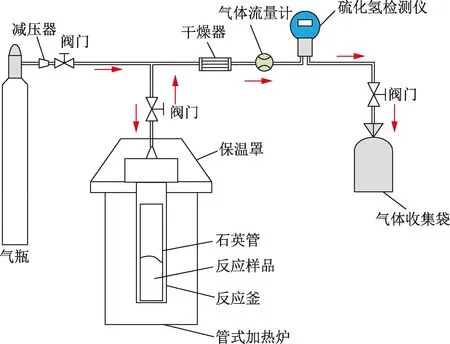
图1 实验装置Fig.1 Experimental setup
采用静态法进行TSR模拟实验,实验系统如图1所示,实验系统温度控制精度为0.1 ℃,压力精度为0.1 MPa。所需的表征测试仪器如表1所示。实验药品四氢噻吩和无水硫酸镁为阿拉丁公司的分析纯产品,去离子水和载气纯度高于99.9%。
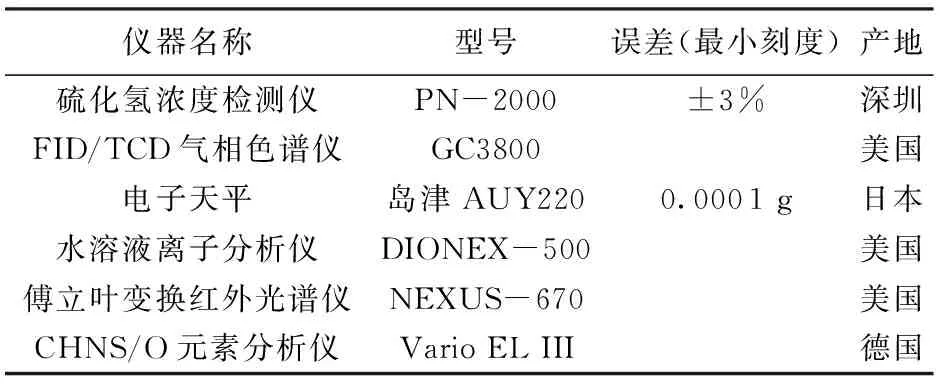
表1 主要实验仪器
实验过程:①确定反应物配比。限于H2S浓度检测仪的量程及精度,经初步探索确定C4H8S,MgSO4和H2O质量分别为2.0,3.0和10.0 g。将配好的样品放入石英管中,并将石英管放入50 ℃恒温环境直至MgSO4全部溶于水。然后将石英管放入耐高温高压的哈氏合金钢反应釜中,密封,向反应釜内充入1.0 MPa的高纯氮气,再慢慢排放,重复3~5次,以充分排除反应釜内的空气。②设定实验温度分别为250、275和300 ℃,采用管式炉加热反应釜,反应釜同管式炉一同升温并保持恒温一定时间(24、48 h等);实验结束后,静待反应釜冷却至室温。③产出物检测分析。将冷却至室温的反应釜内气体先通过干燥器干燥后由H2S检测仪测量H2S浓度,并由气体流量计记录生成气体的总体积,最后用集气袋将气体收集,由色谱分析仪分析气体成分,并对反应后的固液油进行分离,分别检测成分,判断TSR反应产物。
2 结果及其讨论
2.1 气体产物
高温高压条件下不可避免地发生含硫有机物的TDS反应,且TSR反应路径多,难以确定复杂模拟体系H2S气体的具体来源,因而,增加TDS反应和可能的TSR反应共4组实验工况作为比较,进行24 h模拟实验后生成气体的成分检测结果如表2所示。
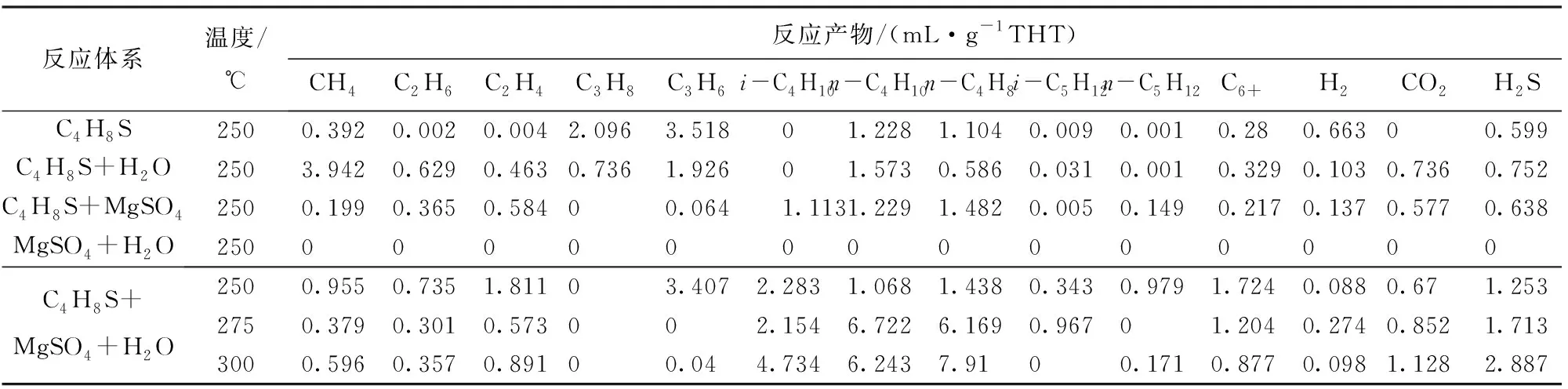
表2 模型化合物的TSR反应气相产物分析
由表2可见,单纯的MgSO4和水在实验条件下并未反应生成H2S,这与文献[11]中结论相同,游离态的SO42-相对于[MSO4]CIP更难引发TSR反应。原因在于游离态的SO42-结构为正四面体,电荷中心位于质子中心,结构相对稳定,因而O-S键不易发生断裂,不容易启动TSR反应;而[MSO4]CIP由于异性电荷的静电作用,使得SO42-结构变形,电子中心偏移,致使O-S键能降低,易发生断裂,从而更易启动TSR反应。MgSO4+C4H8S实验与单纯的C4H8S热裂解实验产生的H2S浓度相当,说明MgSO4不能与C4H8S发生TSR反应,在MgSO4和C4H8S反应体系中主导反应为热裂解反应。由C4H8S的热裂解反应和C4H8S+H2O的水热裂解反应结果对比可见,水热裂解反应较热裂解反应产生的H2S浓度大,这是因为高温高压条件下水溶性反应产物的自催化性得到增强[15],反应活性增大。另外,在C4H8S+H2O水热裂解过程中,极性水分子电离形成H+和OH-,易与C-S键中的极性离子形成电子云,降低C-S断裂的活化能,促进H2S的生成[16]。
从C4H8S+MgSO4+H2O三组TSR反应实验结果可见,H2S生成量与实验温度呈正相关,原因在于反应活化能不变的情况下,温度升高反应速率增大。C4H8S为4个碳组成的环状结构,而反应产物中出现C3以下的单链有机气体,说明TSR反应的同时发生热裂解反应。反应产物中检测到C5以及C6+有机化合物,说明TSR反应中不仅存在水解反应,同时存在缩聚反应,两者呈竞争关系[17-18]。C4H8S热裂解实验和C4H8S+H2O水热裂解实验主要气体产物为C3和甲烷,按自由基理论可知这些产物由C4H8S热解产生,但C4H8S+MgSO4+H2O共存的体系反应产物中不含有C3,说明TSR反应要优先于水热裂解反应或水热裂解反应的C3又进行了缩聚反应。
2.2 油相产物
为获得C4H8S+MgSO4+H2O体系反应后液相物质中硫化物的形式变化,采用安捷伦7890A-SCD气相色谱仪对汽油、柴油中硫化物标样的保留时间进行了测量,结合文献[19]和[20]确定各硫化物的具体成分为硫化氢、羰基硫、甲硫醇、乙硫醇、二甲基硫醚、异丙硫醇、叔丁基硫醇、丙硫醇、甲基乙基硫醚、2-丁硫醇、噻吩、异丁硫醇、二乙基硫醚、丁硫醇、C2/C3噻吩、2-甲基噻吩、3-甲基噻吩、C4/C5噻吩、二乙基二硫醚、苯并噻吩、2-甲基苯并噻吩、3-甲基苯并噻吩、四氢噻吩、4-甲基苯并噻吩、5-甲基苯并噻吩、C2苯并噻吩、C3苯并噻吩、C4/C5苯并噻吩、二苯硫醚;其保留时间分别为2.063、2.196、3.309、3.883、4.083、4.613、5.366、5.697、5.886、7.491、7.55、7.91、8.849、9.706、10.87~16.80、12.143、12.443、17.20 ~ 19.40、19.79、19.987、21.371、22.615、23.643、25.341、26.341、30.32~38.17、38.88~42.58、43.37~48.52、47.502 min。
通过收集C4H8S+MgSO4+H2O反应体系的油相产物,对其硫化物进行定性检测,结果如图2所示。
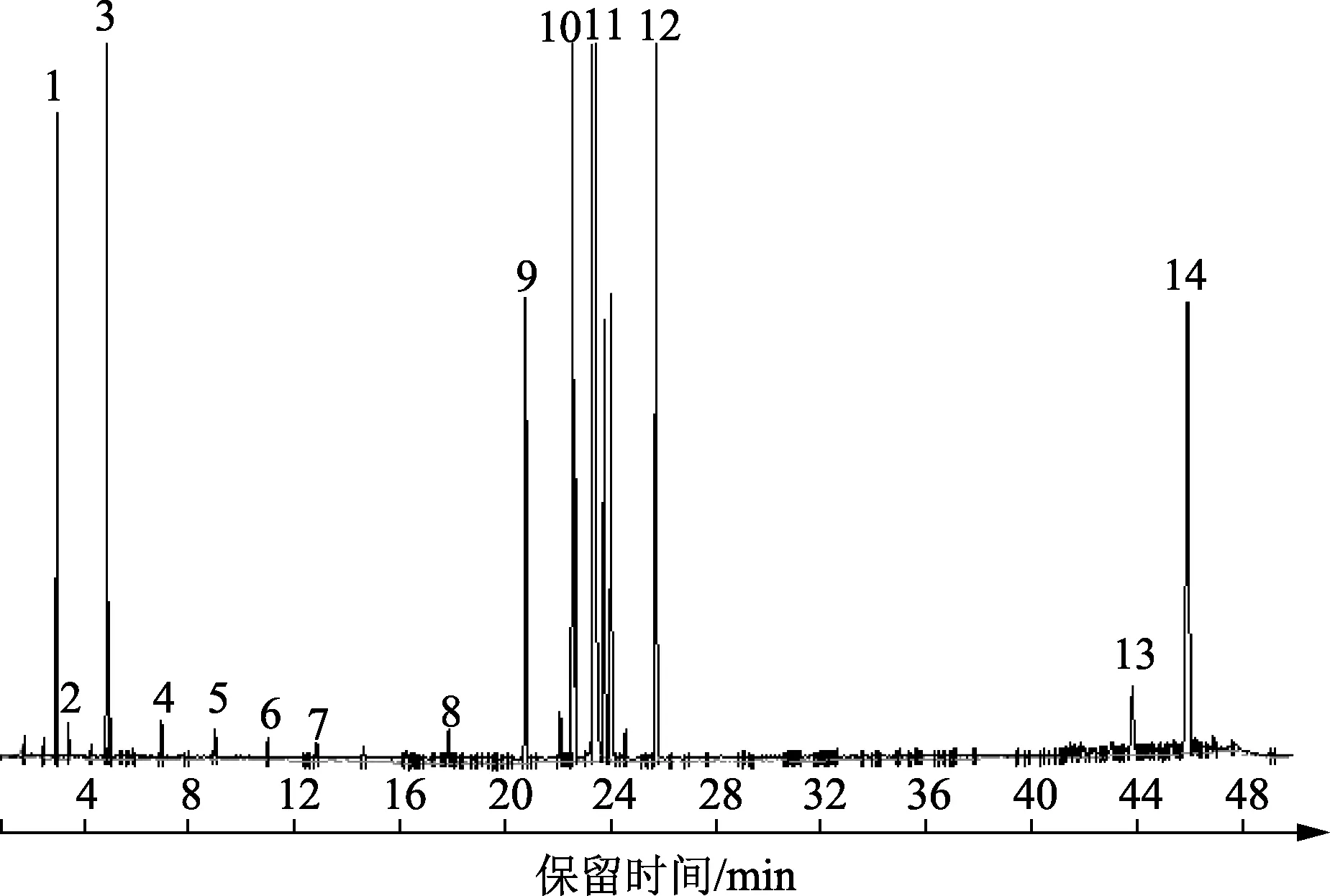
图2 四氢噻吩与硫酸镁反应后油相产物中硫化物的GC-SCD定性谱图Fig.2 GC-SCD qualitative spectra of sulfide in oil phase after reaction between thiolane and magnesium sulfate
由图2可知,C4H8S+MgSO4+H2O反应体系油相产物中硫化物有羰基硫、甲硫醇、异丙硫醇、2-丁硫醇/二乙基硫醚、丁硫醇、C2/C3噻吩、2-甲基噻吩、C4噻吩、2-甲基苯并噻吩、3-甲基苯并噻吩、四氢噻吩、4-甲基苯并噻吩、C4苯并噻吩、C5苯并噻吩/二苯硫醚,其在图2中分别对应编号1~14。从硫化物类型看,C4H8S+MgSO4+H2O反应后生成的硫化物类型主要为噻吩类,少数的硫醇、硫醚类和羰基硫物质。其中,2-甲基噻吩中C-S-C结构,S原子两侧的键均可能发生断裂,进而生成同分异构体进一步发生二次水解,生成硫化氢和二醇化合物[16]。
2.3 TSR反应路径探讨
结合C4H8S在高温高压条件下的水热裂解反应过程和烷烃类、硫醇类的TSR反应过程,推演C4H8S+MgSO4+H2O的TSR反应过程,如图3所示。
由于S的电负性大于C,因此C4H8S中S带负电,C带正电,故反应过程中高温水所电离出的H+与Mg2+形成络合离子攻击S原子,使电子云发生偏移,从而使C-S键键能降低。同时,经水解作用打开杂环结构,使得C-S键键能进一步减小;受热断裂生成H2S,H2S与游离态SO42-反应生成硫代硫酸盐,硫代硫酸盐与烃类等有机物反应生成有机硫化物,经热解、水解等复杂过程生成H2S、CO2、烃类气体和稳定的硫化物。而脱除H2S后的有机物受HSO4-和[MgSO4]CIP的攻击形成硫酸酯,硫酸酯一方面由于其不稳定性与烃类反应;另一方面与H2S结合生成更不稳定的硫化物,再经热解及水解等复杂过程生成H2S、CO2、烃类气体和稳定的硫化物,这与Ma等[11]的研究结果相似。反应过程中H2S具有自催化作用,一是与游离态的SO42-形成硫代硫酸根,二是与烃类结合形成有机硫化物,还会与生成的中间体硫酸酯结合生成新的硫化物。C4H8S在反应过程中缩聚形成苯并噻吩等噻吩类物质,生成的部分噻吩衍生物又进行二次水解生成H2S。C4H8S的水解和二次水解反应在整个的反应路径中居于靠前的位置,反应物浓度较高。
3 H2S生成动力学
由于H2S是通过烃类还原硫酸盐或有机硫化物中C-S键断裂产生的,H2S的生成率可以直接反映实验进行的程度,因此,H2S的生成率可作为TSR反应动力学参数的表征。从稠油及模型化合物反应生成H2S规律可见,C4H8S+MgSO4+H2O体系反应生成H2S速率与反应温度呈正相关,适用于反应动力学方程[21-22],表达式为
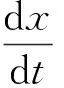
(1)
其中
式中,x为H2S的产率,%;t为时间,d;n为总包反应的反应级数;k为反应速率,1/d;T为反应温度,K;A为指前因子,1/d;R为摩尔气体常量,J/(K·mol);E为表观活化能,J/mol。
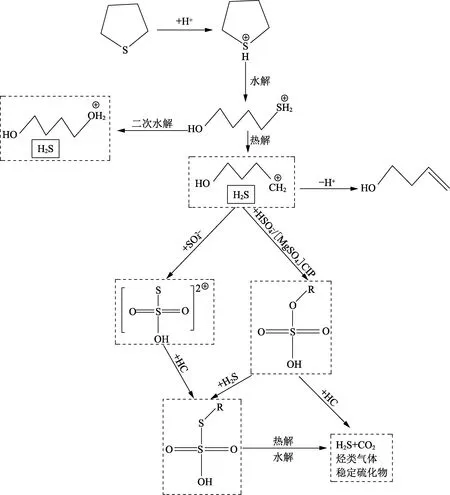
图3 四氢噻吩与硫酸镁TSR反应过程推演Fig.3 Pathway for TSR of thiolaneand magnesium sulfate
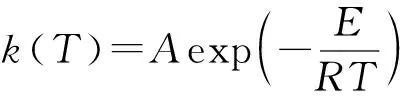
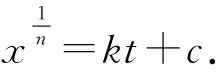
(2)
已知H2S生成率和时间,改变反应级数n,求得对应的线性回归系数,根据最大的回归系数确定该反应体系的反应级数,得到不同反应条件下的反应速率k,将式(2)变换为
(3)
根据不同的反应速率和反应温度,绘制回归曲线,得到斜率和截距,计算求得各反应体系生成H2S的动力学参数。模拟实验条件及实验结果,如表3所示。
改变反应级数,求出各反应温度下的线性回归系数,结果如图4所示。
由图4可见,当n=0.8时,回归系数最接近于1。因此,可以确定此反应级数为0.8。根据H2S生成率和时间的关系进行线性拟合,得到C4H8S+MgSO4+H2O体系在250、300、350 ℃条件下的反应速率分别为7×10-5、1×10-4和2×10-4d-1。
由图5拟合直线的斜率和截距求得C4H8S+MgSO4+H2O体系反应生成H2S的指前因子为0.042 d-1,表观活化能为28.102 kJ/mol。
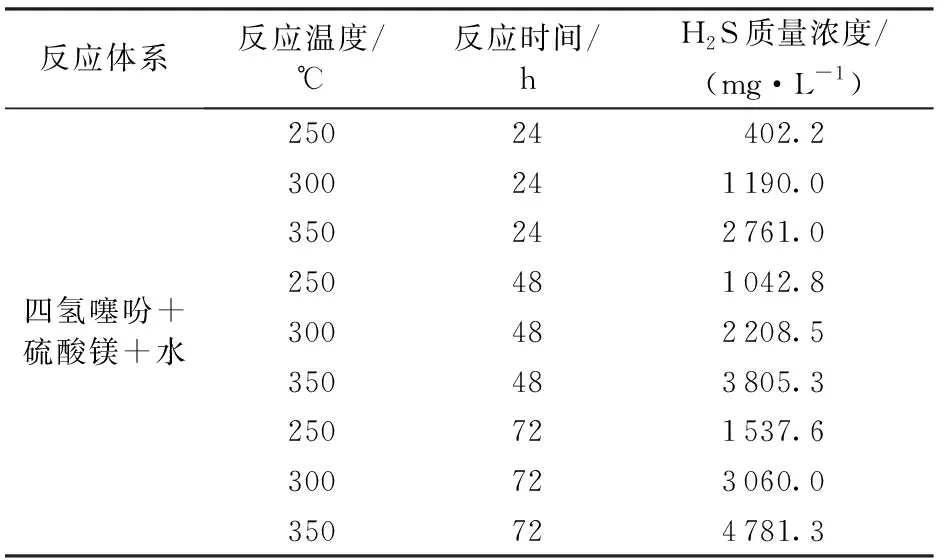
表3 四氢噻吩与硫酸镁反应的H2S生成浓度Table 3 Generation of H2S for reaction between thiolane and magnesium sulfate
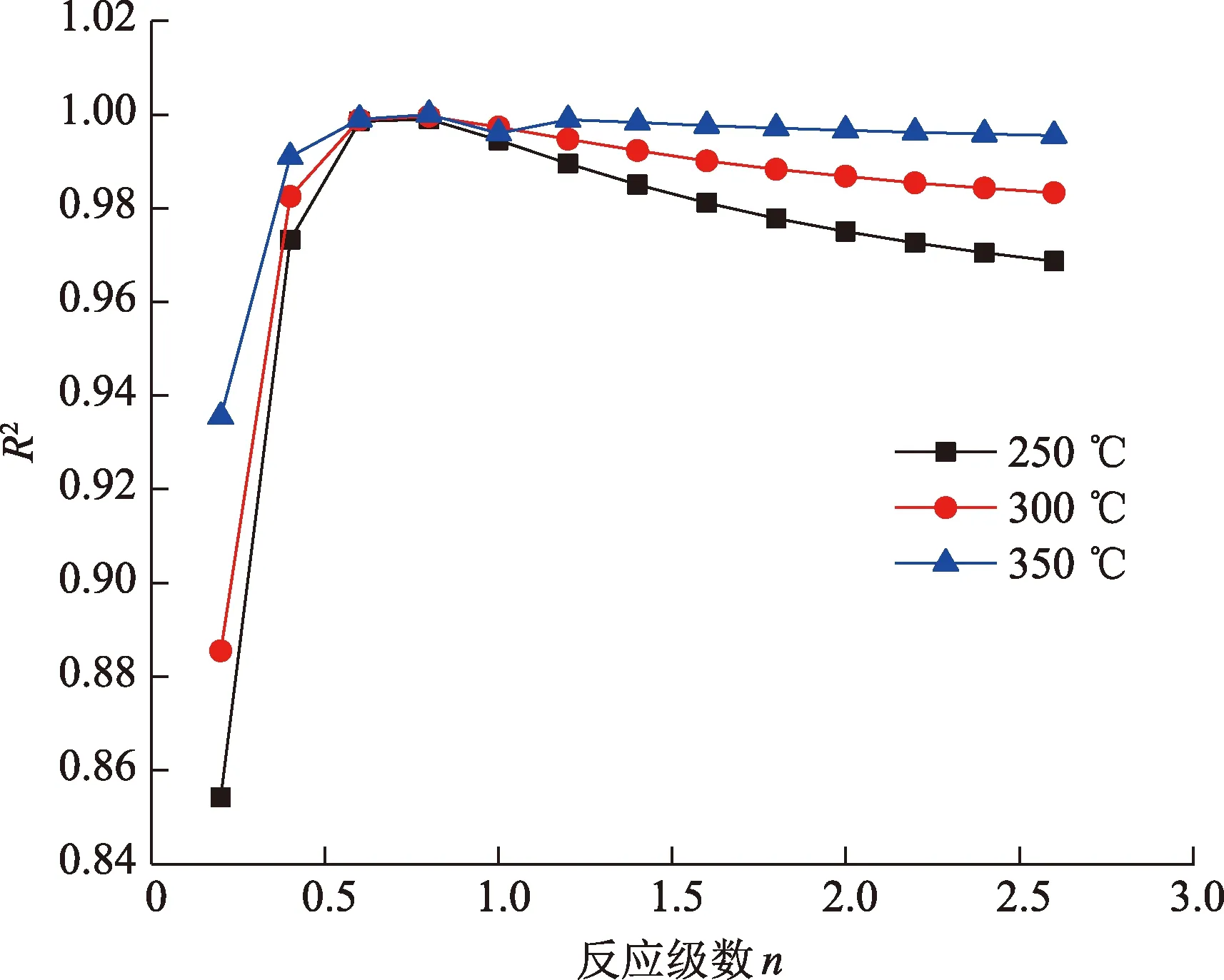
图4 不同反应级数下反应线性回归系数Fig.4 Regression coefficient of experimental data with different reaction order
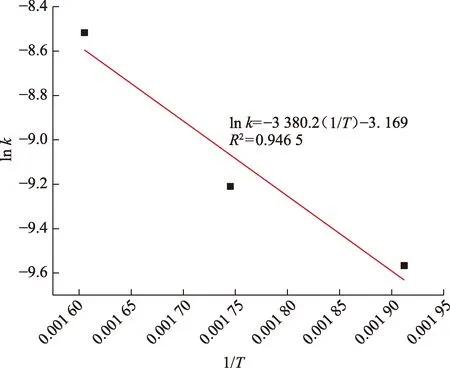
图5 四氢噻吩与硫酸镁反应的回归直线Fig.5 Regression line of reaction between thiolane and magnesium sulfate
4 结 论
(1)C4H8S+MgSO4+H2O体系TSR反应过程包括SO42-质子化、烃类消除反应、硫化氢自催化作用、硫代硫酸盐向有机硫化物的转化、硫化物的热解和水解反应等过程。水解和二次水解在反应过程中居于反应进程前端,反应物浓度较高。
(2)C4H8S+MgSO4+H2O体系TSR反应产物主要为烃类(C1~C5等)、有机硫化物(羰基硫、硫醇、噻吩和硫醚类硫化物)、MgO以及无机气体(H2、CO2、H2S)、C1~C4+烃类,说明TSR过程中不仅发生了裂解反应,同时还存在着聚合反应,两个反应共存。
(3)C4H8S+MgSO4+H2O体系TSR反应生成H2S反应级数为0.8,反应活化能为28.102 kJ/mol。

