紫檀芪对3T3-L1前脂肪细胞分化的影响
王 腾,孙华磊,葛惠娜,刘欣欣,李 星,李文杰
郑州大学公共卫生学院营养与食品卫生学教研室 郑州 450001
肥胖是一种复杂的多因素疾病,它是由脂肪过度堆积所引起,而随着经济发展和生活方式的改变,全球肥胖和超重人口已经从1980年的8.6亿上涨至2013年的21亿[1],国内情况也不容乐观[2]。目前所使用的治疗肥胖的药物,都存在一定的不良反应[3]。紫檀芪(pterostilbene,PTE)是一种天然多酚化合物,主要存在于蓝莓、葡萄等浆果中,具有抗炎、抗氧化、抑制肿瘤细胞增殖和转移等多种功能,有研究[4]证实PTE能够抑制前脂肪细胞增殖和脂质的堆积,从而减少脂肪组织,但PTE干预是否能够影响前脂肪细胞分化尚未明确。因此,本研究通过建立3T3-L1前脂肪细胞分化模型,在细胞分化过程中进行PTE干预,探讨PTE对前脂肪细胞分化的影响以及可能的机制。
1 材料与方法
1.1试剂和仪器PTE(纯度98%,上海士锋生物科技有限公司),DMEM培养液(美国HyClone公司),胎牛血清(美国Gibco公司),羧甲基纤维素钠、青霉素、链霉素、胰蛋白酶、3-异丁基-1-甲基-黄嘌呤(IBMX)、地塞米松、胰岛素、油红O(北京索莱宝生物科技有限公司),全细胞蛋白提取裂解液、BCA蛋白浓度测定试剂盒(武汉赛维尔生物科技有限公司),SDS-PAGE凝胶配制试剂盒(北京鼎国昌盛生物科技有限公司),葡萄糖检测试剂盒、游离脂肪酸测定试剂盒(南京建成生物工程研究所),β-actin、过氧化物酶体增殖物激活受体(PPAR)γ、CCAAT增强子结合蛋白(C/EBP)α多克隆抗体(武汉三鹰生物技术有限公司),恒温CO2培养箱(日本SANYO公司),超净工作台(山东博科生物产业有限公司),酶标仪(美国BioTek公司),蛋白凝胶成像仪(美国通用电气仪器公司)。
1.2培养基配制基础培养基:量取DMEM培养液90 mL、胎牛血清10 mL于容量瓶中,加入1 mL青链霉素混合液(含青霉素10 kU/mL、链霉素10 g/L),混匀后用0.22 μm微孔过滤器过滤,4 ℃储存待用。
诱导培养基A:准确量取2 mmol/L地塞米松贮存液50 μL、2 g/L胰岛素贮存液0.5 mL、50 mmol/L IBMX贮存液1 mL,溶入98.5 mL基础培养基中,混匀。现用现配。
诱导培养基B:准确量取2 g/L胰岛素贮存液0.5 mL,溶入99.5 mL基础培养基中,混匀。现用现配。
1.3细胞分化及干预3T3-L1前脂肪细胞购自中科院上海细胞库。①细胞分化:待细胞在基础培养基中生长至90%~100%融合时,更换新的培养基,继续培养。48 h后更换为诱导培养基A,继续培养48 h后更换为诱导培养基B,48 h后更换为基础培养基,后每2 d更换1次基础培养基,10~12 d后3T3-L1前脂肪细胞即可分化为成熟脂肪细胞。②干预:实验设置PTE低(15 μmol/L)、中(30 μmol/L)、高(60 μmol/L)剂量组[4-5]和对照组。细胞分化过程中,在更换诱导培养基A的同时,干预组分别加入相应浓度的PTE溶液,对照组加入等体积溶剂羧甲基纤维素钠,48 h后停止干预,并按照诱导细胞分化步骤继续诱导细胞分化。
1.4细胞分化程度和脂质堆积测定诱导细胞分化成熟后,吸弃培养基,加入100 g/L多聚甲醛固定细胞20 min,加入适量新配制的油红O染液室温染色20 min,洗去背景色,显微镜下观察细胞染色情况。然后使用异丙醇洗去油红O染液,收集洗脱染液的异丙醇,使用酶标仪在510 nm处测量光密度(OD)值,以此间接反映细胞的分化程度。每组设6个复孔,实验重复3次。
1.5细胞糖消耗量测定细胞诱导分化后,吸弃旧的培养基,用新的基础培养基继续培养。24 h后收集各组细胞的培养基,使用葡萄糖检测试剂盒采用葡萄糖氧化酶-过氧化物酶法测定其中葡萄糖含量,操作步骤严格按照试剂盒说明书进行。后用无细胞培养基中葡萄糖含量减去所测的葡萄糖含量,即为细胞的糖消耗量。每组设6个复孔,实验重复3次。
1.6游离脂肪酸生成量测定细胞诱导分化后,更换新的基础培养基继续培养。24 h后收集各组细胞的培养基,使用游离脂肪酸测定试剂盒测定其中游离脂肪酸含量,测量过程严格按照试剂盒说明书进行。每组设6个复孔,实验重复3次。
1.7细胞中PPARγ、C/EBPα蛋白表达的Western blot测定诱导细胞分化成功后,细胞裂解液处理细胞3~5 min,提取细胞蛋白,采用BCA试剂盒测定蛋白浓度,调整上样蛋白量,并加入上样缓冲液。60 V电压电泳30 min,然后120 V电泳至溴酚蓝指示剂距分离胶底部 1 cm,300 mA恒流2 h转移蛋白印迹至PVDF膜上,50 g/L脱脂奶粉液封闭90 min,加入一抗(PPARγ 抗体1∶3 000、C/EBPα 抗体1∶1 000稀释),4 ℃封闭过夜。洗涤后,与二抗室温摇床孵育2 h,ECL显色。使用Alpha软件进行灰度值分析,以β-actin(1∶3 000稀释)为内参,目的蛋白与内参蛋白条带灰度值的比值即为目的蛋白的相对表达量。实验重复3次。
1.8统计学处理采用SPSS 21.0对数据进行统计分析。不同组间油红O染色OD值、糖消耗量、游离脂肪酸以及PPARγ、C/EBPα蛋白相对表达量的比较均采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1PTE对3T3-L1前脂肪细胞分化的影响结果见图1、表1。镜下可见未分化的3T3-L1前脂肪细胞呈梭形,分化后的成熟脂肪细胞则变为圆形或者近似圆形,且胞质内有脂滴聚集,经油红O染色可以观察到成熟脂肪细胞内的脂滴被染色。

A:前脂肪细胞(×100);B:诱导分化12 d后的脂肪细胞(×200);C:油红O染色的脂肪细胞,箭头所示为脂滴堆积(×200)
2.2各组细胞糖脂代谢的比较结果见表1。与对照组相比,各PTE剂量组细胞糖消耗量升高;高剂量组细胞的糖消耗量高于PTE低和中剂量组。与对照组相比,各PTE剂量组细胞游离脂肪酸生成量均降低,并且PTE高剂量组低于低和中剂量组。
2.3各组细胞中PPARγ和C/EBPα蛋白表达的比较结果见图2、表2。除PTE低剂量组C/EBPα外,与对照组相比,各PTE剂量组的PPARγ和C/EBPα蛋白表达水平均下降,并且PTE高剂量组降低最明显。
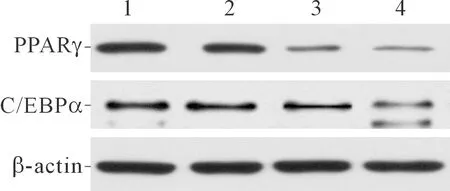
1:对照组;2:PTE低剂量组;3:PTE中剂量组;4:PTE高剂量组

表2 各组细胞中PPARγ、C/EBPα蛋白相对表达量的比较(n=3)
3 讨论
正常脂肪细胞分化过程为多功能干细胞→脂肪母细胞→前脂肪细胞→成熟脂肪细胞[6],前脂肪细胞储存在人体各个脂肪库中,能够吸收、聚集脂质,从而分化为成熟脂肪细胞,成熟脂肪细胞中脂质的过度堆积会导致肥胖。有研究[7]证实前脂肪细胞的过度分化与肥胖的发生、发展密切相关,因此抑制前脂肪细胞分化可能会成为肥胖控制和治疗的有效手段。本研究通过“经典鸡尾酒法”诱导3T3-L1前脂肪细胞向成熟脂肪细胞分化[8],并在细胞分化的过程中进行PTE干预,探讨PTE对前脂肪细胞分化的影响。
前脂肪细胞分化为成熟脂肪细胞后,有两个主要的特征:一是细胞形态的变化,由梭形转变为圆形或椭圆形;二是成熟脂肪细胞开始合成甘油三酯,以脂滴的形式储存在胞质内,并且脂滴的数量和大小能够间接反映脂肪细胞的分化程度[9]。本研究通过鸡尾酒法诱导细胞分化后,细胞形态变化符合以上描述,表明诱导细胞分化成功。油红O染液可对成熟脂肪细胞中的甘油三酯进行特异性染色,OD值检测结果提示PTE干预能够减少脂肪细胞分化过程中脂质的堆积,从而间接表明PTE干预能够抑制前脂肪细胞分化。
肥胖会引起机体糖脂代谢紊乱,而糖、脂毒性往往相互影响,相互促进,形成恶性循环。脂代谢异常会抑制细胞中糖原的合成,促进糖异生,引起脂肪氧化缺陷,过量游离脂肪酸会抑制胰岛素的分泌,导致糖代谢紊乱;同时长期的糖脂代谢紊乱会刺激脂肪细胞释放多种炎性因子,妨碍胰岛信号的传导,进而加重了脂肪细胞对葡萄糖的转运和利用障碍[10]。本研究结果显示,PTE干预能提高脂肪细胞的糖消耗能力,同时减少游离脂肪酸的生成,提示PTE能够改善脂肪细胞的糖脂代谢。
前脂肪细胞分化需要多种核转录因子的参与,其中C/EBP家族和PPAR家族是目前公认最重要的转录因子[11]。PPARγ是PPAR家族中最具有脂肪细胞专一性的成员,主要在脂肪细胞中表达,PPARγ在前脂肪细胞诱导分化的第2天开始转录,目前已有研究[12]证实PPARγ能够调控前脂肪细胞分化,并且PPARγ基因敲除的前脂肪细胞会丧失分化能力;C/EBPα在前脂肪细胞分化过程中与PPARγ具有协同作用[13],C/EBPα在诱导分化的第2天开始表达,但C/EBPα的表达较PPARγ晚,能使前脂肪细胞进入分化的终末阶段,诱导细胞中脂滴的形成[14-15]。本研究结果提示,在一定浓度范围内,PTE干预能够抑制前脂肪细胞分化过程中PPARγ和C/EBPα蛋白的表达,表明PTE能够抑制前脂肪细胞的分化。
综上所述,PTE能够抑制3T3-L1前脂肪细胞分化,减少分化过程中的脂质堆积,并改善脂肪细胞的糖脂代谢,其机制可能与抑制PPARγ和C/EBPα蛋白表达有关。该研究结果为肥胖的控制和预防提供了新的思路和理论依据。

