单环刺螠不同部位中纤溶酶的分离纯化及其活性差异
尹哲, 龙莎, 张嘉颖, 於怀龙, 王立强
(华侨大学 生物医学学院, 福建 泉州 362021)
单环刺螠(Urechisunicinctus)体长色红,是常见的底栖生物,多见于我国黄渤海沿岸U型浅水区,利用价值极高.对单环刺螠的生物研究最早集中在螠速激肽Ⅰ-Ⅷ、血凝素、腺苷酸酶等成分的提取和利用方面[1-4].王佃亮等[5]在研究单环刺螠体内生物活性物质的过程中,发现其具有一种纤溶活性的蛋白酶.郭金明等[6]在前人研究的基础上,从单环刺螠组织液中提取出在体内外均具有较强抗凝、溶栓活性及生物安全性的纤溶酶,并命名为单环刺螠纤溶酶(UFE).UFE是一种胰蛋白酶样的丝氨酸蛋白酶,具有纤维蛋白溶解活性,能明显延长血液凝固时间,产生抗凝血作用[7].现有的研究对UFE的提取部位各异,质量尚未均一化,导致文献报道中结果数据的可信度与重现性较差.本课题组的前期研究表明,单环刺螠肌体中UFE的总蛋白质量与季节变化有关,具有季节累积性.基于此,本文对秋季单环刺螠体腔液、体壁肌及内脏等不同部位UFE进行分离纯化,并对其活性差异进行研究.
1 实验部分
1.1 实验动物
单环刺螠(山东省青岛市黄岛海域),清洁级,体质量为(40±10) g(生物学成年个体);SD大鼠(购自厦门大学实验动物中心,动物许可证号为SYXK(闽)2013-0006),SPF级,体质量为(200±20) g,雌雄各半.
1.2 仪器与试剂
高速离心机(美国Beckman公司);HD-21-88型核酸/蛋白质检测仪(上海琪特公司);超声波清洗机(上海市爱阔特公司);倒置荧光显微镜(日本Nikon公司);CO2恒温细胞培养箱(美国Thermo公司);真空干燥箱(上海和呈仪器制造有限公司);M600型凝血因子分析仪(北京中勤世帝科学仪器有限公司);P2-4LD型冷冻干燥机(北京博医康试验仪器有限公司).
凝血酶时间(TT)诊断试剂盒、凝血酶原时间(PT)诊断试剂盒(上海碧云天生物技术有限公司);Q-Sepharose fast flow阴离子交换层析柱(上海源叶生物科技有限公司);硫酸根(质量分数为30.26%)、糖醛酸(质量分数为25.25%)、氨基糖(质量分数为7.58%)、Folin-酚试剂、三羟甲基氨基甲烷(Tris)、酪蛋白(赛默上海飞世尔科技有限公司);SephacrylS 100凝胶柱、Sephadex G-50葡聚糖凝胶、纤维蛋白原(FIB)测定试剂(福建省泉州市华诺生物科技有限责任公司);标准血浆(上海碧云天生物技术有限公司),乏抗凝血酶-Ⅲ血浆(乏AT-Ⅲ血浆)、乏肝素辅因子-Ⅱ血浆(乏HC-Ⅱ血浆)(上海冠东生物科技有限公司);肝素钠(≥2 500.5 mkat·g-1,CAS登录号为9041-08-1,安徽省合肥市博美生物科技有限公司);其他试剂均为国产分析纯.
1.3 实验方法
1.3.1 单环刺螠分组 于秋季购买单环刺螠成虫,选择体表无伤痕,体态均一的健康个体,于充气的海水(水温为(17.6±0.3) ℃,pH值为8.01±0.02,实际盐度为32%)中暂养3 d,每日换水2次,每次换1/2水.实验分3批(A~C批),每批3组,每组10只.
1.3.2 单环刺螠前处理 将单环刺螠进行以下处理:A批,剪去一端,挤出内脏,用蒸馏水淋洗后进行组织绞碎,纱布过滤,得内脏匀浆液;B批,避开内脏,在虫体近头端处剖开长度约1 cm的小口,倒提虫体,将体腔液沥出,纱布过滤,得体腔液;C批,剪去一端,挤出内脏,将剩余体壁肌用蒸馏水淋洗后进行组织绞碎,纱布过滤,得体壁肌匀浆液.以上过程均在4 ℃下进行,处理后于-80 ℃暂存.
1.3.3 UFE的提取纯化 将3批样品在4 ℃下融化,于3 900 r·min-1离心60 min,收集上清液,分别于质量分数为90%,50%的过硫酸铵溶液中透析除盐,经0.45 μm 微孔滤膜处理后,冷冻干燥,得酶粗品.分别配制0.2 mol·L-1的酶粗品液上样SephacrylS 100凝胶柱,以双蒸水洗脱,收集凝胶柱最上层的淡黄色条带组分,冷冻干燥,获得最终酶粗品.用0.02 mol·L-1的Tris-HCl 缓冲液将酶粗品的浓度配制为0.2 mol·L-1后,按柱体积的2%(约5 mL)向Q-Sepharose 阴离子层析柱中加样,流速为1.2 mL·min-1,使用0.5 mol·L-1的NaCl及0.02 mol·L-1的Tris-HCl缓冲液梯度洗脱;收集的洗脱液以双蒸水为外相,3 500 D透析袋去离子后冷冻干燥,使双蒸水溶解层析所得冻干品的质量浓度为0.5 mg·mL-1,按柱体积的2%(约5 mL)向Sephadex G-50凝胶柱上样,流出速度为每秒0.2滴,每管收集4 mL流出组分,冷冻干燥.然后,分别检测A~C批的酶活力及比活力.酶活力单位定义:在温度为37 ℃,pH值为7.8的条件下,每分钟水解出相当于1 μg 酪氨酸的酶量为1个酶活力单位,即1个酶活力单位=酪氨酸质量/水解时间×稀释倍数.比活力指单位质量蛋白质所具有的酶活力单位数.
1.3.4 UFE酶活力的测定 用Folin-酚试剂法对酶活力进行测定,以酪蛋白为底物.取1 mL质量分数为1%的酪蛋白溶液和0.9 mL Tris-HCl缓冲液,加入0.1 mL UFE样品溶液,混匀后,于37 ℃水浴中反应20 min,加入1 mL质量分数为15%的三氯乙酸溶液终止反应;静置离心10 min,取上清液作为样品溶液.取1 mL质量分数为1%的酪蛋白溶液和0.9 mL Tris-HCl缓冲液,加入1 mL质量分数为15%的三氯乙酸溶液,再加入0.1 mL的UFE样品溶液,静置离心10 min,取上清液作为对照溶液.取上述样品溶液和1 mL对照溶液,加入5 mL Folin-酚试剂(甲)及0.5 mL Folin-酚试剂(乙),混匀于室温放置30 min后,在560 nm处测定其吸光度D560.以吸光度D560为纵坐标(Y),以蛋白质量为横坐标(X),得标准曲线为Y=102.65X-0.214 3,相关系数R2=0.999 8.
1.3.5 标准血浆、乏AT-Ⅲ血浆、乏HC-Ⅱ血浆凝固时间的测定 选择生理盐水作为对照组,按体积比1∶10分别向标准血浆、乏AT-Ⅲ、乏HC-Ⅱ血浆中加入4 mg·mL-1的UFE,以此作为实验组.将凝血酶原时间试剂和凝血酶时间试剂预温10 min后,再将各待测组预温5 min,通过凝血因子分析仪测定凝固时间.
1.3.6 血浆凝血因子活性的测定 选择生理盐水为空白对照,70 μg·mL-1肝素钠为阳性对照,3批UFE样品的质量浓度为70 μg·mL-1,使用凝血因子试剂盒测定血浆凝血因子活性.
1.3.7 大鼠血体外复钙凝血时间的测定 选择生理盐水作为空白对照,2 mg·mL-1肝素钠作为阳性对照,氯化钙溶液的质量浓度分别为3,10 mg·mL-1,UFE的质量浓度为2 mg·mL-1.大鼠股动脉取血,每5 mL血液中加入0.1 mL质量分数为5%的草酸钾溶液,以制备抗凝血.每组加入0.9 mL抗凝血,空白对照组中加入1 mL生理盐水,阳性对照组中加入1 mL肝素钠,实验组中加入1 mL UFE溶液,于37 ℃恒温水浴条件下,分别加入0.1 mL不同质量浓度的氯化钙溶液;每隔30 s检查血液状态,当血液不再流动时,记录凝血时间.
1.3.8 大鼠血液中钙离子浓度的测定 选择雌雄大鼠,正常喂养3 d后,实验组分别尾静脉注射4,16 mg·mL-1的UFE溶液,空白对照组注射0.5 mL的生理盐水,阳性对照组注射4 mg·mL-1的肝素钠;30 min后股动脉采血,于3 000 r·min-1离心15 min,并通过甲基-百里酚蓝比色法测定上清液中钙离子的质量浓度[6].
1.4 统计分析
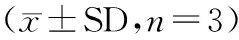

样品批次mavmexA批(内脏)40.80±1.217.87±0.37B批(体腔液)40.18±1.978.80±0.25C批(体壁肌)39.75±2.3020.37±1.07
2 结果与分析
2.1 单环刺螠不同部位的分离纯化
2.1.1 样品参数统计 单环刺螠的基本参数统计(体腔液密度为1 g·cm-3),如表1所示.表1中:n为检测次数;mav为单环刺螠的平均质量;mex为单环刺螠提取部位的质量.由表1可知:不同部位来源样品的质量不同,体腔液和内脏占单环刺螠质量的比例较为接近,体壁肌则为单环刺螠体质量的主要构成.
2.1.2 粗酶液的吸光度 不同部位来源的样品粗酶液,如图1所示.由图1可知:B批样品经过滤、离心处理后,与另外两批相比,颜色鲜红,质地粘稠.不同部位样品经SephacrylS 100凝胶柱后,其吸光度D560如图2所示.由图2可知:C批样品蛋白的D560最低,A批次之,B批的D560最高,可达0.841.因此,体腔液的外观及其粗酶液的D560值均优于其他部位.

图1 样品粗酶液 图2 不同部位样品的吸光度 Fig.1 Sample crude enzyme solution Fig.2 Optical density values of sample from different parts
2.1.3 样品纯化参数 不同部位来源样品分离纯化过程中的相关参数,如图3所示.图3中:mt为总蛋白质量;k为纯化倍数;与A批组相比,“a”表示P<0.01;与B批组相比,“b”表示P<0.01;与C批组相比,“c”表示P<0.01.由图3可知:不同部位来源样品的参数存在一定差异,体腔液中提取的总蛋白质量为39.8 mg,UFE的比活力为4 695.94 mkat·g-1,纯化倍数为13.8,均高于体壁肌、内脏中所得.

(a) 总蛋白质量 (b) 比活力 (c) 纯化倍数图3 不同部位来源样品分离纯化过程中的相关参数Fig.3 Relevant parameters during separation and purification of samples from different parts

表2 UFE抗凝血酶活性的比较(n=6)Tab.2 Comparison of UFE antithrombin activity (n=6)
2.2 不同部位来源的UFE活性差异验证
2.2.1 UFE抗凝血酶活性 比较不同部位UFE的凝血酶原时间和凝血酶时间可知其抗凝血酶活性.UFE抗凝血酶活性的比较,如表2所示.表2中:tP,tT分别为凝血酶原时间和凝血酶时间;相比标准血浆, “**”表示P<0.01;相比乏AT-Ⅲ血浆,“a”表示P<0.05,“aa”表示P<0.01;相比乏HC-Ⅱ血浆,“bb”表示P<0.01.由表2可知:加入B批UFE后,标准血浆、乏AT-Ⅲ及乏HC-Ⅱ血浆的凝血酶原时间和凝血酶时间均极显著延长(P<0.01);加入A批UFE后,标准血浆和乏HC-Ⅱ血浆的凝血酶时间极显著性延长(P<0.01),而乏AT-Ⅲ血浆的凝血酶时间和凝血酶原时间显著延长(P<0.05);加入C批UFE的作用不显著.同时,分析数据可知,在相同条件下,UFE对凝血酶时间的作用更为明显,凝血酶时间大于凝血酶原时间.
2.2.2 UFE对血浆凝血因子活性的影响 UFE对血浆凝血因子活性的影响结果,如表3所示.表3中:对照组、肝素钠组、UFE组A批、UFE组B批、UFE组C批的纤维蛋白原(FIB)的质量浓度分别为(2.69±0.20),(2.09±0.19),(2.37±0.21),(2.23±0.34),(2.49±0.26) g·L-1,与对照组相比,肝素钠组与3批UFE组的FIB质量浓度均低于对照组,未达显著水平,且不具有统计学意义;相比对照组,“*”表示P<0.05,“**”表示P<0.01;相比肝素钠组,“a”表示P<0.05,“aa”表示P<0.01.由表3可知:UFE组B批能够极显著降低各凝血因子活性(P<0.01),UFE组A批能够极显著降低除凝血因子Ⅱ之外的各凝血因子活性(P<0.01),UFE组C批能够显著降低除凝血因子Ⅱ之外的各凝血因子活性(P<0.05).此外,与肝素钠组相比,UFE组B批能够极显著地降低凝血因子Ⅱ,Ⅺ的活性(P<0.01),对其他因子不具有统计学意义.


凝血因子凝血因子活性对照组肝素钠组UFE组A批UFE组B批UFE组C批因子Ⅱ102.37±5.1853.66±6.85**89.85±5.05aa74.32±5.09**aa97.63±5.19aa因子Ⅴ101.13±6.7538.13±5.92**59.48±6.35**44.86±7.73**83.25±6.82*因子Ⅶ100.53±8.5652.17±7.10**70.37±7.49**56.97±7.67**82.85±7.30*因子Ⅷ102.08±8.0451.12±6.43**58.20±6.64**48.64±6.39**69.93±7.45*因子Ⅸ101.39±5.4634.07±4.83**60.18±5.02**aa49.07±6.84**67.39±6.84*因子Ⅹ103.07±2.4748.14±5.86**65.04±5.33**56.69±6.08**88.27±8.52*因子Ⅺ101.74±5.0728.08±6.14**57.62±6.81**aa45.67±5.89**aa65.33±4.68*因子Ⅻ102.66±8.1323.06±7.61**30.09±7.47**a27.64±8.73**48.41±8.91**aa

图4 UFE对大鼠体外复钙凝血时间的影响Fig.4 Effect of UFE on recalcification time of rat calcium in vitro
2.2.3 UFE对大鼠血体外复钙凝血时间的影响 UFE对大鼠血体外复钙凝血时间的影响,如图4所示.图4中:ρ(CaCl2)为氯化钙的质量浓度.由图4可知:与对照组相比,加入不同质量浓度的氯化钙溶液的肝素钠组均能明显延长凝血时间;相较于对照组,UFE组B批对延长凝血时间的影响最显著,UFE组A批延长凝血时间的效果弱于UFE组B批,强于UFE组C批;加入10 mg·mL-1氯化钙的各组延长凝血时间作用均强于3 mg·mL-1的氯化钙的实验组,说明氯化钙的质量浓度越高,延长作用越强,凝血时间越长.
2.2.4 UFE对大鼠血液中钙离子浓度的影响 UFE对大鼠血液中钙离子浓度的影响,如表4所示.表4中:c(Ca2+)表示钙离子浓度;相比对照组,“**”表示P<0.01;相比肝素钠组,“aa”表示P<0.01.由表4可知:UFE能够降低血液中钙离子的浓度, 并存在浓度依赖关系,浓度越高,作用越显著; 与对照组相比,各批UFE组能够极显著地降低大鼠血液中钙离子的浓度(P<0.01),肝素钠组未达到显著水平(P>0.05);不同质量浓度的UFE降低作用不同,UFE组B批(4,16 mg·mL-1)、UFE组A批(16 mg·mL-1)作用极显著(P<0.01),对钙离子的降低作用强于肝素钠组;3批UFE作用各异,UFE组B批对大鼠血液中钙离子浓度的影响最大.

表4 UFE对大鼠血液中钙离子浓度的影响(n=6)Tab.4 Effect of UFE on calcium ionconcentration in rat blood (n=6)
3 讨论
单环刺螠的体壁、消化道和体腔液中均含有丰富的氨基酸,并包含人体需要的各种必需氨基酸[8-11].现有文献报道中关于单环刺螠纤溶酶的来源部位各异,而具有针对性的抗凝机制研究鲜有报道,极大限制了UFE的精准开发与应用.该实验对不同部位纤溶酶的分离纯化及活性的对比研究,验证了前期针对纤溶酶在体内积累规律研究所获得的结果.单环刺螠生殖细胞年周期发育分为增殖期、生长期、成熟期、排放期和休止期,单环刺螠的小生殖期为9月中旬至10月中旬(秋季),生殖细胞的发生主要在体腔液中进行[12-14].该实验发现秋季单环刺螠体腔液中纤溶酶的总蛋白质量丰富,故有待进一步研究单环刺螠生殖细胞发育阶段对机体内环境的影响.该实验还发现,UFE能显著降低血浆部分凝血因子的活性,推测UFE可能与AT-Ⅲ结合,引起AT-Ⅲ构象的改变,使AT-Ⅲ更易与凝血因子结合,从而灭活或抑制凝血因子的活性;对HT-Ⅱ产生钝化作用,使降低血浆中的凝血因子Ⅱ的作用较小.Ca2+是内环境平衡必不可少的活性离子,Ca2+作为凝血因子Ⅳ在凝血过程中发挥着重要作用[15].本研究进一步验证UFE可通过降低血液中Ca2+的浓度来延长大鼠血复钙凝血时间.
通过对比不同部位提取的UFE对AT-Ⅲ、HT-Ⅱ、凝血因子和钙离子的影响可知,体腔液、体壁肌、内脏中的UFE在凝血作用机制方面的效应强度各不相同,体腔液中提取的UFE作用最强;比较不同部位来源的单环刺螠纤溶酶在总蛋白质量、活性作用方面的差异,初步证实体腔液中UFE总蛋白质量最多,且活性优于体壁肌及内脏中所得酶,可以弥补UFE质量稳定性的不足.实验随机选择多个单环刺螠的不同部位进行参数比较,后续工作可增加每一部位的阴性对照来研究每个部位的专属性.

