金线莲多糖抗衰老作用及其机制
刘青, 李永, 盛世美
(华侨大学 化工学院, 福建 厦门 361021)
衰老是生物体随着年龄增长在形态结构和生理功能方面出现的一系列退行性变化,是正常且自然的过程.有学者认为,随着衰老机体自由基产生和消除的不平衡,过量的自由基可损伤细胞膜、DNA结构,促进核酸及蛋白质分子内发生化学交联,从而影响细胞的正常功能,最终导致细胞死亡[1].随着衰老不断进行,机体免疫系统开始老化,免疫功能下降.已有研究表明,多种植物多糖具有抗衰老作用[2-3],它们的抗衰老作用与其抗氧化、免疫调理作用有关.金线莲(Anoectochilusroxburghii)又名金线兰、金石松等,为兰科(Orchidaceae)开唇兰属植物,是我国名贵中药材,具有清热凉血、祛风利湿等功效[4].金线莲多糖是金线莲的主要活性成分之一.近年来的研究发现,金线莲多糖具有良好的体外抗氧化[5]、免疫调节[6-7]、降血糖[8-9]及抗肿瘤作用[10],然而,未见金线莲多糖在抗衰老方面的报道.因此,本文将对金线莲多糖改善衰老小鼠脑功能退化作用进行研究.
1 材料与方法
1.1 金线莲多糖的提取[11]
将金线莲干品切碎,用体积分数为80%的乙醇提取,提取液过滤后,将干燥残渣放入90 ℃的蒸馏水中提取3次,每次1 h;提取液混合浓缩后,加入5倍体积的无水乙醇沉淀24 h;然后,将沉淀物溶解在60 ℃热水中,采用Sevag法去蛋白,并用水透析48 h;最后,用无水乙醛、丙酮和乙醚洗涤沉淀,得到金线莲多糖,并用苯酚硫酸法测定多糖的纯度.所得的金线莲多糖纯度为94.5%,且该多糖在260,280 nm处没有紫外吸收,将提取的金线莲多糖命名为ARP.
1.2 实验动物
SPF级昆明小鼠,雌雄各半,体质量为18~22 g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2017-0005.小鼠饲养在标准动物实验室中,所有操作均符合华侨大学实验动物管理伦理委员会的要求.
1.3 实验试剂和仪器
D-半乳糖(北京拜尔迪生物技术有限公司);维生素E胶丸(福建省厦门星鲨药业集团);过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、血清血清总抗氧化能力(T-AOC)、丙二醛(MDA)和蛋白测定试剂盒(江苏省南京建成生物工程研究所);抗体 p-NF-κB p65和β-actin(美国贝弗利Cell Signaling Technology公司);其他试剂均为国产分析纯.
用蒸馏水将1 000 mg·kg-1的D-半乳糖溶液配成40 mg·kg-1的D-半乳糖溶液用于皮下注射;将维生素E(VE)溶解在玉米油中,配成200 mg·kg-1的维生素E溶液待用.
BS110S型电子天平(德国Sartorius公司);旋转蒸发仪(瑞士Buchi 公司);752型紫外分光光度计(上海精密科学仪器有限公司);JL BeHv型动物行为分析系统(上海吉量软件科技有限公司);DDY-10型三恒电泳仪、半干转印槽、全自动电泳凝胶成像分析系统(美国Bio-Rad公司).
1.4 实验方法
1.4.1 小鼠衰老模型 小鼠78只,随机分为6组,雌雄各半,每组13只.除空白对照组外,其余各组小鼠每天颈部皮下注射D-半乳糖溶液(40 mg·kg-1),建立小鼠衰老模型[12].造模期间,阳性对照组小鼠灌胃给予维生素E(200 mg·kg-1),金线莲多糖组小鼠则分别灌胃给予不同剂量的金线莲多糖水溶液(100,200,300 mg·kg-1,分别编号ARP1,ARP2,ARP3)进行治疗.6周后,每组随机取10只小鼠进行行为学实验,包括旷场、强迫游泳和跳台实验.实验8周后,宰杀这些小鼠,取小鼠胸腺,测定胸腺指数;取小鼠大脑皮层,测定大脑皮层p-NF-κB p65的表达,以及抗氧化酶CAT,SOD活性,并测定小鼠血清中T-AOC活性和MDA浓度.每组剩下的3只小鼠,在最后一次给药后1~2 h,用于免疫学实验.
1.4.2 小鼠外观观察及体质量称量 观察实验期间各组小鼠的生长情况、外观与体质量变化.
1.4.3 旷场实验 使用开口为40 cm×40 cm×35 cm(长×宽×高)的蓝色塑胶制实验箱,将软质黑色垫板垫在箱底部,方便小鼠爬行.实验时,所有小鼠均提前适应环境3 min,每只小鼠测试一次.将小鼠放入实验箱的中心位置,在实验箱中自由探索环境5 min,记录每只小鼠在这5 min内的运动时间、运动速度和后肢直立的次数(包括攀附箱壁和两支前爪腾空的次数).
1.4.4 强迫游泳实验 使用直径为40 cm,高为30 cm的无色透明塑料制实验箱,箱内装有干净且温度适合的水供小鼠游泳.实验时,所有小鼠均提前适应环境,每只小鼠测试一次.将小鼠提尾置于实验箱中心位置的正上方,随后松手使小鼠自由落体入水,让小鼠在水中游泳5 min,记录每只小鼠5 min内的游泳时间.
1.4.5 跳台实验 采用25 cm×25 cm×30 cm(长×宽×高)的小鼠跳台反应箱,将其分为4间,箱底为可通36 V连续电刺激的铜栅.每间中间放置一直径为12 cm,高为4.5 cm的橡皮垫作为小鼠回避电击的安全区.首先,将小鼠置于跳台仪中,适应环境3 min;然后,底部铜栅通以36 V交流电.记录小鼠受到电刺激后跳上橡皮垫的反应时间,以及5 min内的错误次数(受到电击的次数).24 h后,再次将小鼠置于跳台仪中适应3 min,然后将其置于橡皮垫上,记录第1次跳上橡皮垫的潜伏期,作为记忆成绩.
1.4.6 生化检测 按照试剂盒说明书操作要求,测定小鼠大脑皮层CAT,SOD活性,血清T-AOC活性和MDA浓度.
1.4.7 Western Blot检测 采用提取试剂盒提取小鼠大脑皮层总蛋白,测定蛋白浓度,加热使之变性,上样量30 μg;然后,经体积分数为10%的SDS-聚丙烯酰胺凝胶电泳,再将蛋白转至硝酸纤维素膜上;经体积分数为5%的脱脂奶粉封闭1 h后,加入相关一抗(anti-p-NF-κB p65稀释体积比为1∶500,anti-β-actin稀释体积比为1∶500),4 ℃过夜,经TBST缓冲液洗3次后,加入相关二抗封闭液(稀释体积比为1∶5 000)封闭1 h;采用电化学(ECL)发光法,扫描记录,并采用Image J软件测定条带灰度值,结果以β-actin为内参.
1.4.8 腹腔巨噬细胞吞噬实验[13]最后一次给药后1~2 h,给每组剩余的3只小鼠,腹腔注射1 mL体积分数为1%的鸡红细胞悬液,轻揉腹部使鸡细胞分散.20 min后,处死小鼠,消毒后剪开皮肤,经腹腔注入2.5 mL生理盐水.轻揉小鼠腹部1 min,用移液枪吸取腹腔液,涂片,于37 ℃孵育30 min.取出玻片,漂洗,除去未贴片的细胞,晾干.以体积比为1∶1的丙酮甲醇液固定5 min,再用瑞氏姬姆萨染液染色,漂洗,晾干,在油镜下记录200个巨噬细胞中吞噬鸡红细胞的巨噬细胞数,及每个巨噬细胞中被吞噬的鸡红细胞数.吞噬指数(IP)和细胞吞噬百分率(η)的计算式分别为
1.5 统计学分析
2 结果与分析
2.1 小鼠的外观及体质量变化

图1 小鼠体质量变化(n=10)Fig.1 Weight change in mice (n=10)
观察可知:实验期间,各组小鼠生长良好,饮食及活动自由,未发生死亡;随着给予小鼠D-半乳糖注射时间的延长,模型组小鼠出现毛发粗糙发黄、反应迟钝、食量减少等现象;空白对照组及药物治疗组小鼠的毛较光滑、颜色较正常、活泼好动.
在实验周期中,小鼠的体质量变化,如图1所示.图1中:m为小鼠的体质量;t为实验时间;n为每组小鼠的数量.由图1可知:相比于其他给药组小鼠,模型组小鼠的体质量增长更缓慢.
2.2 小鼠的行为学能力
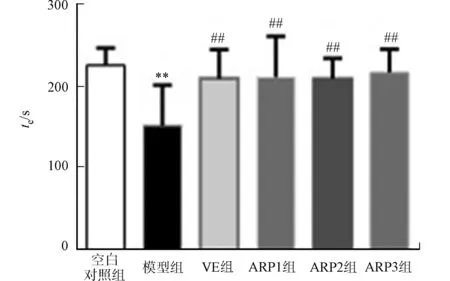
(a) 运动时间
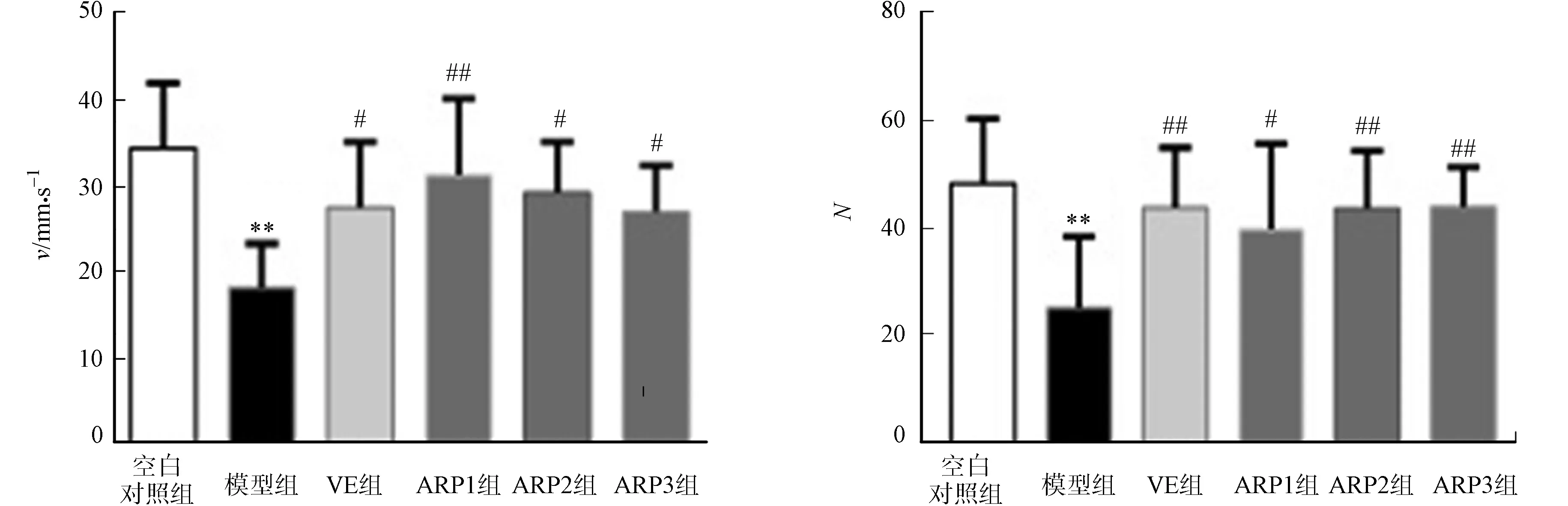
(b) 运动速度 (c) 后肢直立的次数图2 不同实验组小鼠在5 min内的活动结果(n=10)Fig.2 Movement results of each group mice in 5 minutes (n=10)
通过观察和检测小鼠在新环境中的运动探究行为和自主活动行为,测试小鼠的运动能力、空间探索能力、学习能力和记忆能力[14].不同实验组小鼠在5 min内的活动结果,包括运动时间(te)、运动速度(v)和后肢直立的次数(N),如图2所示.图2中:与空白对照组相比,“**”表示P<0.01;与模型组相比,“#”表示P<0.05,“##”表示P<0.01.
由图2可知:与空白对照组相比较,衰老模型组小鼠的运动时间、运动速度和站立次数均显著下降(P<0.01);与衰老模型组小鼠相比,经不同剂量金线莲多糖和VE治疗后,小鼠的运动时间、运动速度和站立次数均明显增加(P<0.01,P<0.05),说明金线莲多糖和VE能使衰老小鼠的运动、空间探索、学习和记忆能力有明显改善.
2.3 小鼠的抗疲劳能力
每组小鼠在5 min内的游泳时间,如图3所示.图3中:ts为游泳时间.
由图3可知:与空白对照组相比,衰老模型组小鼠在5 min内的游泳时间显著减少(P<0.01),衰老模型组小鼠的体力差;与衰老模型组相比,金线莲多糖治疗各组及VE组小鼠的游泳时间均明显延长(P<0.05,P<0.01),说明金线莲多糖能改善衰老小鼠的耐力,提高其抗疲劳能力.
2.4 小鼠的被动学习记忆能力
跳台实验常用来测试小鼠被动学习记忆能力.各组小鼠2次上台潜伏期,如图4所示.图4中:ti为小鼠的上台潜伏期.
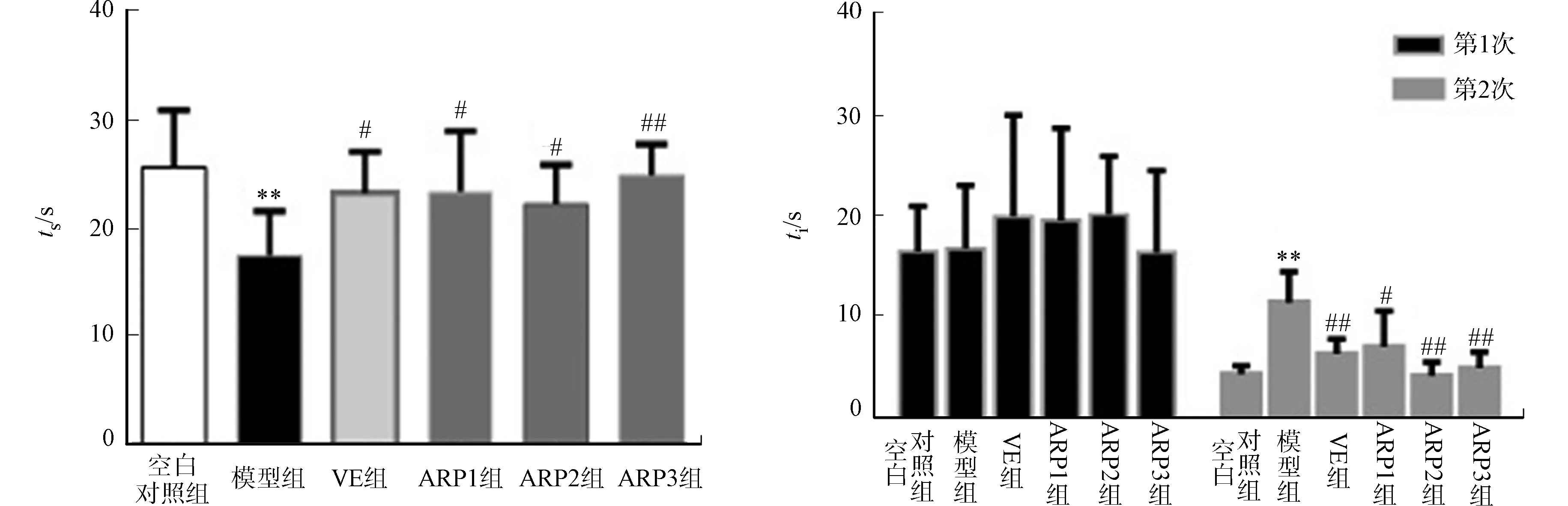
图3 各组小鼠在5 min内的游泳时间(n=10) 图4 各组小鼠2次上台潜伏期(n=10) Fig.3 Swimming time of each group mice Fig.4 Two incubation periods of in 5 minutes (n=10) each group mice (n=10)
由图4可知:在第1次测试中,各组小鼠的上台潜伏期差异不具有统计学意义(P>0.05);但在第2次记忆重现测试中,衰老模型组小鼠的上台潜伏期明显长于空白对照组小鼠,表明衰老小鼠的学习能力没有空白对照组小鼠好;经金线莲治疗后,各治疗组小鼠的上台潜伏期均明显缩短,与衰老模型组小鼠相比,差异具有统计学意义(P<0.05,P<0.01),这说明给予一定剂量的金线莲多糖对衰老小鼠的被动学习记忆能力有促进效应.
2.5 小鼠的抗氧化能力
抗氧化酶对机体的氧化和抗氧化平衡起着重要作用,它能清除自由基,保护细胞免受损伤.各组小鼠大脑皮层及血清的抗氧化酶活性和血清中的MDA浓度,如表1所示.表1中:c(MDA)为血清中的MDA的浓度;IT为胸腺指数;z(SOD),z(CAT),z(T-AOC)分别为SOD,CAT,T-AOC的活性.
由表1可知:与空白对照组相比,衰老模型组小鼠大脑皮层和血清抗氧化酶(SOD,CAT,T-AOC)活力均显著降低(P<0.01);而衰老模型组小鼠血清的脂质过氧化产物MDA浓度显著升高,说明衰老小鼠的抗氧化能力明显减弱;给予金线莲多糖治疗后,衰老小鼠的抗氧酶活力均升高,中、高剂量金线莲多糖治疗组小鼠的抗氧化酶活力表现出明显改善(P<0.05,P<0.01);相应地,经金线莲多糖治疗后,衰老小鼠血清MDA的浓度也下降,中、高剂量金线莲多糖治疗组小鼠的血清MDA浓度表现出明显降低(P<0.05,P<0.01),结果表明,给予金线莲多糖能提高衰老小鼠抗氧化能力;与空白对照组小鼠相比,衰老模型组小鼠的胸腺指数明显减小(P<0.01),而经金线莲多糖治疗后,衰老小鼠的胸腺指数明显增加(P<0.05,P<0.01),说明金线莲多糖能改善衰老小鼠的胸腺萎缩.
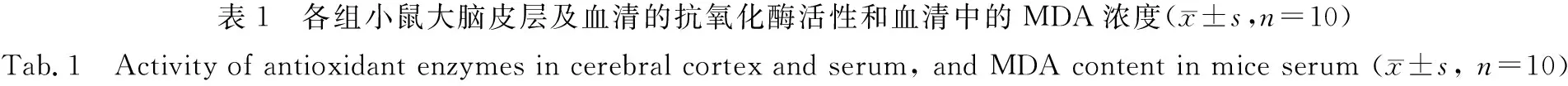
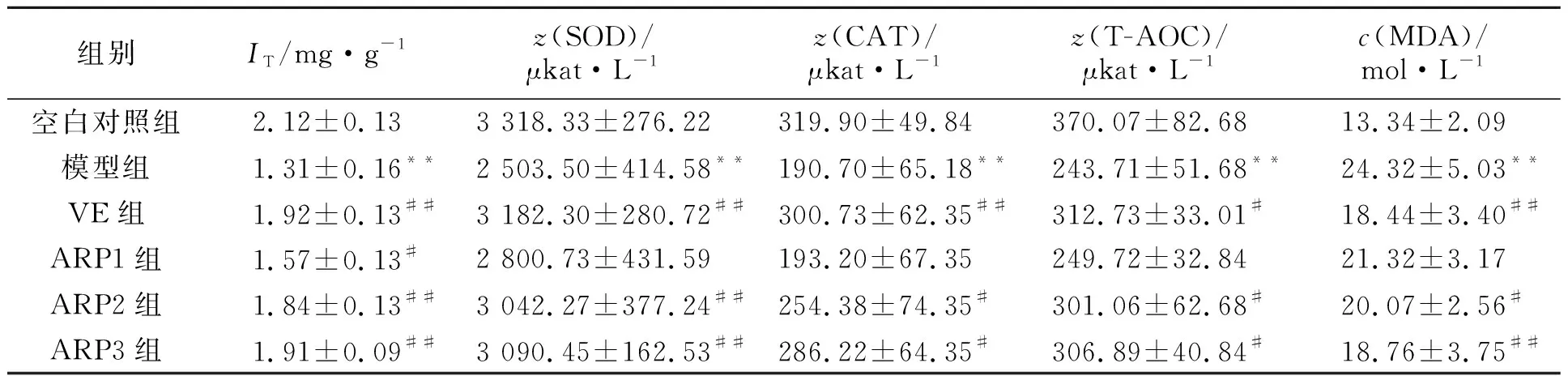
组别IT/mg·g-1z(SOD)/μkat·L-1z(CAT)/μkat·L-1z(T-AOC)/μkat·L-1c(MDA)/mol·L-1空白对照组2.12±0.133 318.33±276.22319.90±49.84370.07±82.6813.34±2.09 模型组1.31±0.16**2 503.50±414.58**190.70±65.18**243.71±51.68**24.32±5.03**VE组1.92±0.13##3 182.30±280.72##300.73±62.35##312.73±33.01#18.44±3.40##ARP1组1.57±0.13#2 800.73±431.59193.20±67.35249.72±32.8421.32±3.17ARP2组1.84±0.13##3 042.27±377.24##254.38±74.35#301.06±62.68#20.07±2.56#ARP3组1.91±0.09##3 090.45±162.53##286.22±64.35#306.89±40.84#18.76±3.75##
2.6 p-NF-κB p65的蛋白表达
p-NF-κB p65的相对蛋白表达量分析及 p-NF-κB p65表达量,如图5所示.图5中:D为相对蛋白表达量.
由图5可知:与空白对照组相比,衰老模型组小鼠大脑皮层p-NF-κB p65的蛋白表达水平明显上调;经金线莲多糖治疗后,衰老小鼠大脑皮层p-NF-κB p65蛋白表达水平随金线莲多糖治疗量的增加而逐步降低,说明金线莲多糖能抑制衰老小鼠大脑皮层NF-κB 的信号通路.
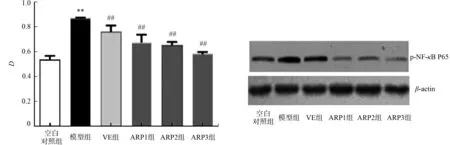
(a) 相对蛋白表达量 (b) 表达量图5 p-NF-κB p65的相对蛋白表达量分析及 p-NF-κB p65表达量(n=3)Fig.5 Analysis of relative protein expression and expression of p-NF-κB p65 (n=3)
2.7 小鼠巨噬细胞吞噬指数和吞噬百分率
小鼠腹腔巨噬细胞吞噬实验结果,如图6所示.由图6可知:与空白对照组比较,衰老模型组小鼠的巨噬细胞吞噬指数与吞噬百分率明显降低;经金线莲多糖治疗后,衰老小鼠腹腔巨噬细胞的吞噬百分率与吞噬指数能力随着金线莲多糖使用量的增加而逐步提高,说明金线莲多糖能提高衰老小鼠的免疫力.
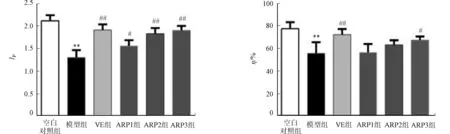
(a) 吞噬指数 (b) 吞噬百分率图6 小鼠腹腔巨噬细胞吞噬实验结果(n=3)Fig.6 Peritoneal macrophage phagocytosis test results (n=3)
3 讨论
由于衰老机体自由基产生和消除的不平衡,过量的自由基可影响细胞的正常功能,最终导致细胞死亡.D-半乳糖能使体内产生大量的超氧阴离子,从而导致组织器官过氧化损害,这与自然衰老的表现相似.因此,D-半乳糖被广泛用于制造衰老模型.研究结果显示,经D-半乳糖皮下注射8周后,小鼠大脑皮层和血清抗氧化酶活性明显下降,而脂质过氧化中间产物MDA的浓度却显著上升,表明此时小鼠体内氧自由基的清除失衡.
NF-κB信号通路是氧化应激敏感的信号通路.实验中,衰老小鼠大脑皮层抗氧化酶活性降低,氧自由基的清除失衡,氧自由基产生增多,激活了小鼠大脑皮层NF-κB信号通路,使p-NF-κB p65蛋白表达水平显著上调.NF-κB信号通路在炎症反应中起中心调控作用,其激活可引起下游多种炎症反应[15],中枢神经炎症反应会促进脑衰老相关认知功能障碍性疾病的发展.实验结果显示,衰老小鼠出现行为学变化,小鼠的运动能力、空间探索、学习和记忆能力均明显迟缓.
衰老与免疫系统结构和功能改变密切相关.随着年龄的增加,机体自由基积累逐渐增多,引起免疫功能改变,导致免疫系统衰老,免疫器官逐渐萎缩,器官功能下降,使免疫器官对外界抗原的反应缓慢,清除抗原的能力降低[16].实验结果显示,与空白对照组小鼠相比,衰老小鼠的胸腺指数下降,其腹腔巨噬细胞吞噬能力显著下降.
金线莲多糖是金线莲的主要有效成分之一.近年来的研究结果显示,金线莲多糖有良好的体外抗氧化、免疫保护、降血糖作用.实验中,与衰老小鼠相比,经不同剂量的金线莲多糖治疗后的小鼠大脑皮层和血清的抗氧化酶SOD,CAT,T-AOC均有显著升高,而血清的MDA的浓度呈明显的下降.这进一步表明金线莲多糖有明显的体内抗氧化作用,能有效改善衰老小鼠机体的氧化还原状态.
学习和认知能力减退是衰老的主要特点,经金线莲多糖治疗后,衰老小鼠大脑皮层的NF-κB信号通路被抑制,小鼠的运动能力、空间探索、学习和记忆能力都得到显著改善,衰老小鼠的活力增加.
经金线莲多糖治疗后,随着机体抗氧化系统平衡的恢复,免疫系统的功能得到改善.实验结果显示,金线莲多糖能显著提高衰老小鼠的胸腺指数和巨噬细胞的吞噬能力,说明金线莲多糖能延缓衰老小鼠免疫器官萎缩,增强衰老小鼠清除抗原的能力.
综上所述,金线莲多糖的抗氧化作用能显著抑制衰老小鼠大脑皮层的NF-κB信号通路,有效提高衰老小鼠的学习、认知能力,增强衰老小鼠的活力,提高衰老小鼠的免疫功能,从而起到明显的抗衰老作用.金线莲多糖改善衰老小鼠脑功能作用可能与其抗氧化、抑制衰老小鼠大脑皮层的NF-κB信号通路、增强衰老小鼠免疫功能有关.

