不同品系及生长期金线莲的金线莲苷含量变化研究△
陈莹,王文义,谌赛男,黄锦芳,张雪,3,吴水生*,孙志蓉,陈菁瑛
1.北京中医药大学 中药学院,北京 102488;2.福建中医药大学 药学院,福建 福州 350122;3.陆军军医大学 西南医院,重庆 400038;4.福建省农业科学院 农业生物资源研究所,福建 福州 350003;5.福建省农业科学院 药用植物研究中心,福建 福州 350003
金线莲又名金线兰,为兰科植物花叶开唇兰Anoectochilus roxburghii(Wall.)Lindl.的新鲜或干燥全草,是闽台地区的珍稀草药[1],主产于福建,浙江、广西、广东等地亦有分布[2],是福建省道地药材,也是“福九味”之一[3],被列为福建省野生药材保护品种[4]。其性平,味甘,归肺、肝、肾、膀胱经,具有清热凉血、祛风利湿等功效[1],临床常用于治疗乙型肝炎、肾炎、糖尿病、高血压、手足口病等[5-7]。随着药用价值的开发和市场需求量的增加,其产业规模不断扩大。目前,金线莲人工栽培技术成熟,市售药材以组织培养种苗移栽林下土壤或大棚基质种植4~6 个月或更长时间的栽培金线莲为主[8-9]。金线莲经长期引种驯化和种质选育,逐渐形成不同栽培品系,常见的有尖叶、本地野生、本地圆叶、大圆叶、红霞等[3,10]。《福建省中药材标准》2006 年版规定,金线莲在夏、秋季茎叶茂盛时采收[1],但各企业金线莲种苗移栽时长和采收期不同,行业内无统一的栽培技术规范[11],加之金线莲具有野生、不同栽培品系、组织培养等来源,其品质参差不齐,有商家将组织培养种苗甚至同属植物作为产品的加工原料,严重影响金线莲产品的质量[12-13]。
目前,尚未建立合适的标准对组织培养、不同栽培品系金线莲的品质进行质量控制[14]。已有研究表明,金线莲主要有效成分为黄酮及黄酮苷、金线莲苷、多糖等[15-18]。金线莲苷是从金线兰中分离得到的糖苷类化合物,结构为五元内酯环的手性碳上连接葡萄糖,具有保护血管、降血糖、调血脂、抗肝病毒和保护肝细胞等作用[6,19],是金线莲的有效物质及特征性成分,可作为金线莲质量评价的重要指标。已有研究表明,各品系金线莲之间存在遗传多样性[3],其总黄酮和核苷类成分含量也存在差异[20-21]。已有研究采用高效液相色谱法(HPLC)[22]、高效液相色谱-蒸发光散射检测法(HPLC-ELSD)[23]、超高效液相色谱-高分辨飞行时间质谱法(UPLCTOF-MS)[24]测定金线莲中金线莲苷的含量,但尚未见不同品系及生长期金线莲中金线莲苷含量变化比较的报道。本研究以不同产地不同品系及生长期的金线莲为研究对象,建立HPLC-ELSD 测定金线莲苷含量的方法,探究不同品系金线莲在不同生长期金线莲苷含量的变化规律,为金线莲质量评价、优良种质筛选及适宜采收期的确定提供参考。
1 材料
1260 型高效液相色谱仪(美国安捷伦公司);Alltech 3300 型蒸发光散射检测器(美国格雷斯奥泰公司);GT-2120QTS 型超声机(广东固特超声股份有限公司);DV215CD 型十万分之一分析天平(奥豪斯公司);DFY-500A 型粉碎机(上海四瑞仪器有限公司);Milli-Q 型超纯水仪(美国Millipore公司)。
金线莲苷对照品(批号:P08S8F43417,纯度≥95%,上海源叶生物科技有限公司);乙腈为色谱纯(德国Merck 公司);水为超纯水,其余试剂均为分析纯。
不同品系及生长期金线莲来源于福建漳州南靖、三明永安、莆田仙游等地。其中,组织培养金线莲为组织培养生根阶段4 个月的试管苗,由来源地金线莲种植企业提供;栽培金线莲为试管苗经炼苗10~15 d后再移栽林下(永安、仙游)或大棚(南靖)种植样品,并分别于种植1、2、3、4、5、6、7、9、10、13 个月取样;野生金线莲为林下野生药材(表1)。所有样品均为在产地随机采集鲜品(50 株或以上),经福建中医药大学药学院范世明高级实验师鉴定为兰科开唇兰属金线莲Anoectochilus roxburghii(Wall.) Lindl.的新鲜全草。
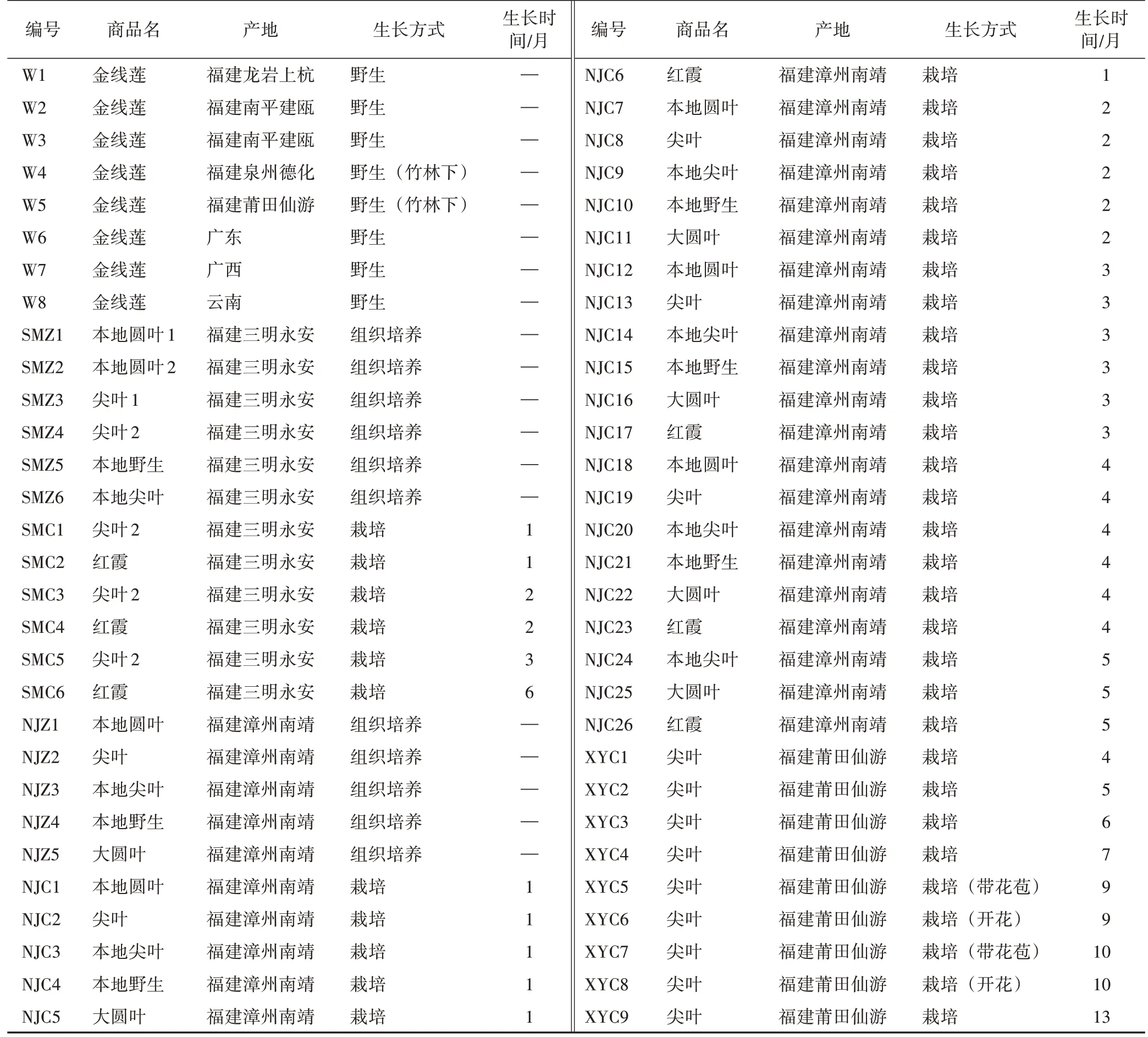
表1 金线莲样品信息
2 方法与结果
2.1 色谱条件
色谱柱为Ultimate HilicAmide(100 mm×4.6 mm,3 μm);流动相为乙腈-水等度洗脱(92∶8,V/V);流速为0.8 mL·min-1;柱温为30 ℃;蒸发光散射检测器雾化室温度为50 ℃,载气为高纯氮气,载气流速为1.5 L·min-1;进样量为10 μL。对照品与样品的色谱图见图1。
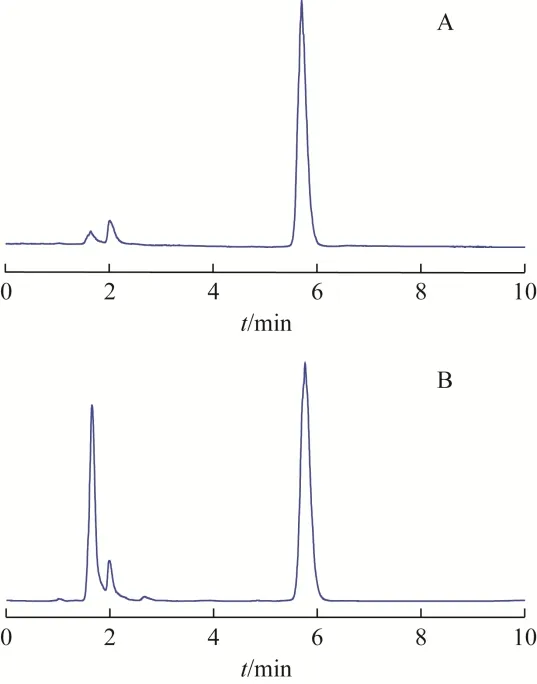
图1 金线莲苷对照品与金线莲HPLC图
2.2 对照品溶液制备
精密称取金线莲苷对照品7.94 mg 到5 mL 量瓶中,加入甲醇制备成1.588 mg·mL-1的金线莲苷对照品储备液,备用。
2.3 供试品溶液制备
将60 ℃干燥至恒重的金线莲粉碎,过60目筛得金线莲粉末。取金线莲粉末0.2 g,精密称定,置具塞三角瓶中,精密加入甲醇40 mL,密塞,称定质量,超声提取30 min(功率250 W,频率50 kHz),放冷,称定质量,用甲醇补足减少的质量,摇匀,0.22 μm滤膜滤过,取续滤液,备用。
2.4 线性关系考察
取2.2项下方法制备的对照品储备液,分别用甲醇稀释至1 588.00、1 270.40、1 016.32、508.16、254.08、127.04、63.52、31.76 μg·mL-1,精密吸取10 μL,按2.1 项下色谱条件测定峰面积,以质量浓度的对数值为横坐标(X),以峰面积的对数值为纵坐标(Y),绘制标准曲线,得回归方程Y=1.717 1X-1.599 8(r=0.999 8),线性范围为31.76~1 588.00 μg·mL-1。按3 倍信噪比计算检测限(LOD),按10倍信噪比计算定量限(LOQ),分别为15.88、31.76 μg·mL-1。
2.5 精密度试验
精密吸取2.4 项方法制备的508.16 μg·mL-1对照品溶液10 μL,按2.1 项下色谱条件连续进样6 次,记录金线莲苷的峰面积,金线莲苷峰面积RSD 为1.35%;精密吸取上述对照品溶液连续测定3 d,每天测定6次,金线莲苷峰面积RSD为1.07%,表明仪器的精密度良好。
2.6 稳定性试验
精密称取金线莲样品XYC3 粉末0.2 g,按2.3项下方法制备供试品溶液,按2.1 项色谱条件下于0、2、6、10、12、24 h 进样10 μL,被测物峰面积RSD为4.69%,结果表明供试液在24 h内稳定。
2.7 重复性试验
分别精密称取同一批样品XYC3 粉末0.2 g,共6 份,按2.3项下方法制备供试品溶液,分别进样测定,测得金线莲苷含量RSD 为2.15%,结果表明该法重复性良好。
2.8 加样回收率试验
取2.7 项下已知含量的样品(XYC3)粉末,每份0.1 g,共6 份,精密称定,每份精密加入相同量(已知含量的100%)的金线莲苷对照品,按2.3 项下方法制备供试品溶液,在2.1 项下色谱条件下测定含量,计算加样回收率,结果该方法的加样回收率为92.03%,RSD 为2.26%,说明该方法回收率良好(表2)。
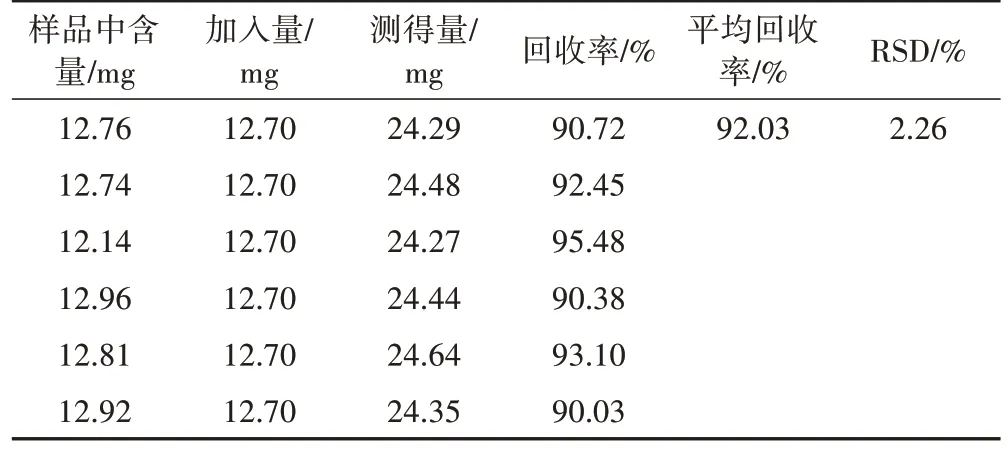
表2 金线莲中金线莲苷加样回收率试验结果
2.9 含量测定
分别取样品粉末0.2 g,精密称定,按2.3 项下方法制备供试品溶液,再按2.1 项下色谱条件进行测定,用外标法计算样品中金线莲苷的含量,结果见表3。
由表3 可知,不同产地野生金线莲的金线莲苷质量分数为1.00%~11.04%,因产地不同而异。三明永安不同品系组织培养金线莲的金线莲苷质量分数为1.27%~5.54%,其含量大小由高到低为尖叶2>本地圆叶1>本地尖叶>尖叶1>本地圆叶2>本地野生。三明永安林下移栽生长1~3 个月尖叶2栽培金线莲的金线莲苷含量变化为“升-降-升”,种植3 个月尖叶2 的金线莲苷质量分数达20.08%,红霞栽培金线莲的金线莲苷含量表现出相似的规律,其种植6个月的金线莲苷质量分数为9.54%。
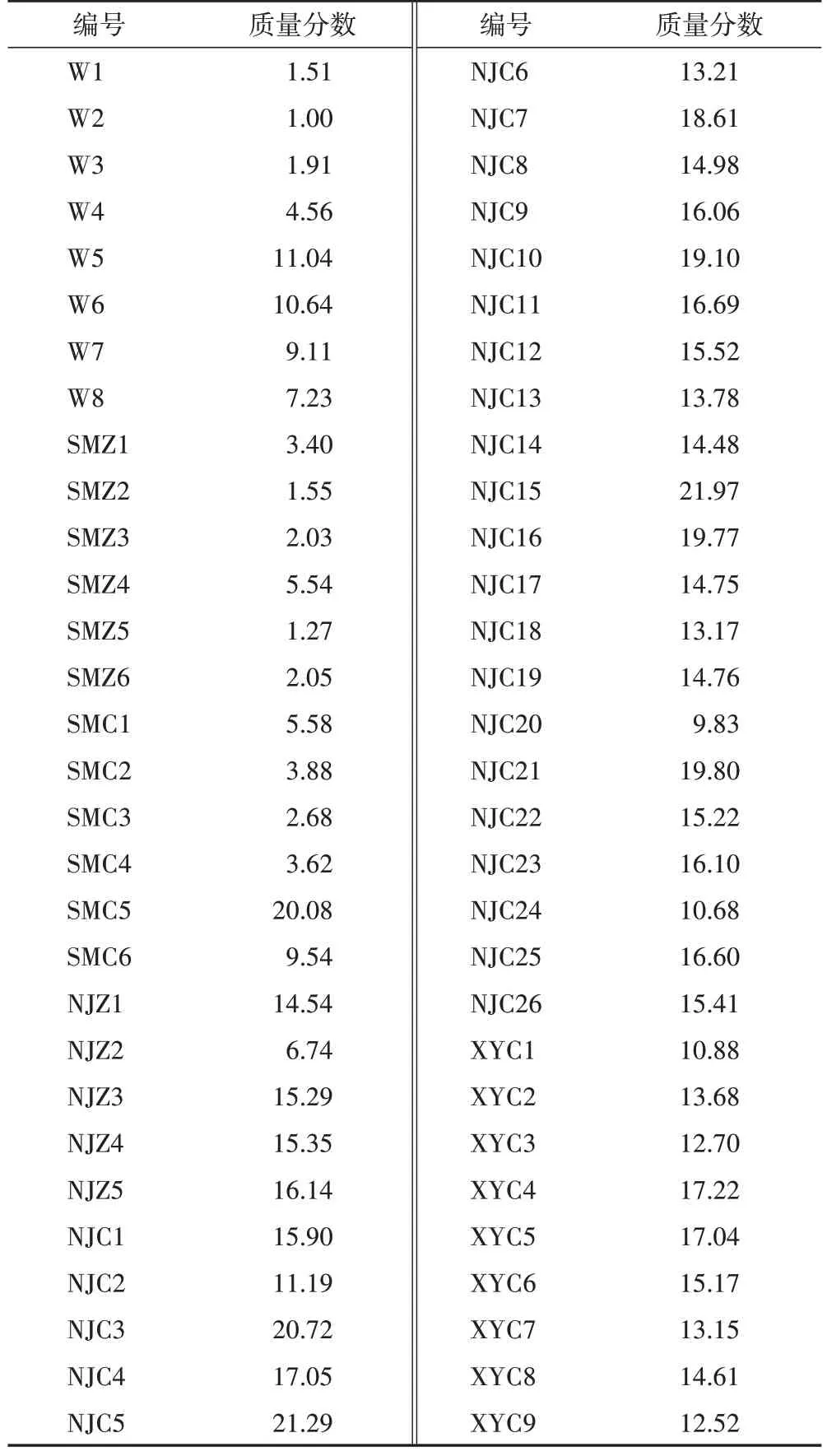
表3 金线莲中金线莲苷质量分数 %
南靖不同品系组织培养金线莲的金线莲苷质量分数为6.74%~16.14%,由大到小依次为大圆叶>本地野生>本地尖叶>本地圆叶>尖叶。南靖不同品系栽培金线莲不同生长期的金线莲苷含量见图2。由图2A 可知,本地野生金线莲在1~4 个月生长期内金线莲苷含量均比尖叶和本地圆叶金线莲高,表现为先升后降的趋势,在生长3 个月时达到最高值21.97%;本地圆叶金线莲的金线莲苷含量在1~2个月时上升,在2~4 个月时下降,在生长2 个月时达到最高值18.61%;尖叶金线莲在1~4 个月生长期内金线莲苷含量除了在3 个月时略微下降外均呈上升趋势,在生长2、4 个月时质量分数均达14.5%以上。由图2B 可知,生长1~5 个月的大圆叶金线莲的金线莲苷含量呈现锯齿状“降-升-降-升”的趋势,其质量分数均在15%以上,分别在生长1、3 个月达到峰值21.29%、19.77%;本地尖叶金线莲的金线莲苷质量分数由1 个月时的20.72%缓慢下降到4 个月时的9.83%,到生长5 个月时上升到10.68%。此外,生长3~5 个月的红霞金线莲的金线莲苷质量分数均在14.7%以上,在生长4个月时达16.1%。
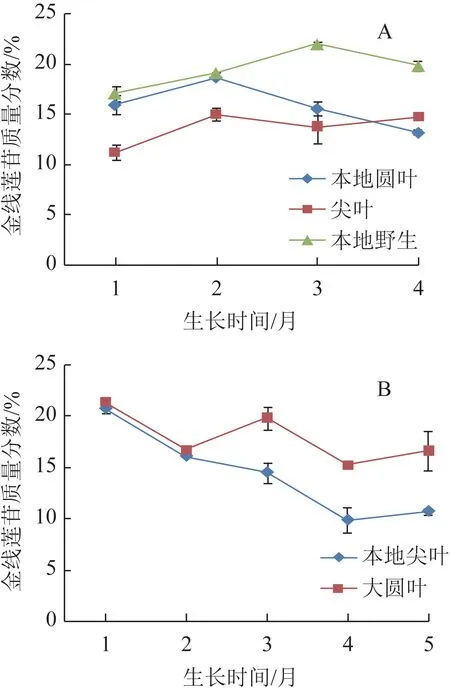
图2 南靖不同品系金线莲在不同生长期的金线莲苷质量分数(,n=3)
仙游林下栽培4~13 个月的尖叶金线莲的金线莲苷质量分数见图3。由图3可知,尖叶金线莲的金线莲苷含量在生长4~7 个月时呈“升-降-升”的趋势,并在生长7 个月时达到最高值17.22%。而在生长9 个月之后,其金线莲苷含量呈下降趋势,生长9~13 个月时其质量分数为12.52%~17.04%。生长9 个月时含花苞金线莲的金线莲苷质量分数高于生长9 个月的开花金线莲,分别为17.04%、15.17%,而生长10个月的开花金线莲的金线莲苷质量分数高于生长10 个月含花苞金线莲,分别为14.61%、13.15%,但总体上进入花期及之后生长期的尖叶金线莲的金线莲苷含量较生长9 个月前降低。
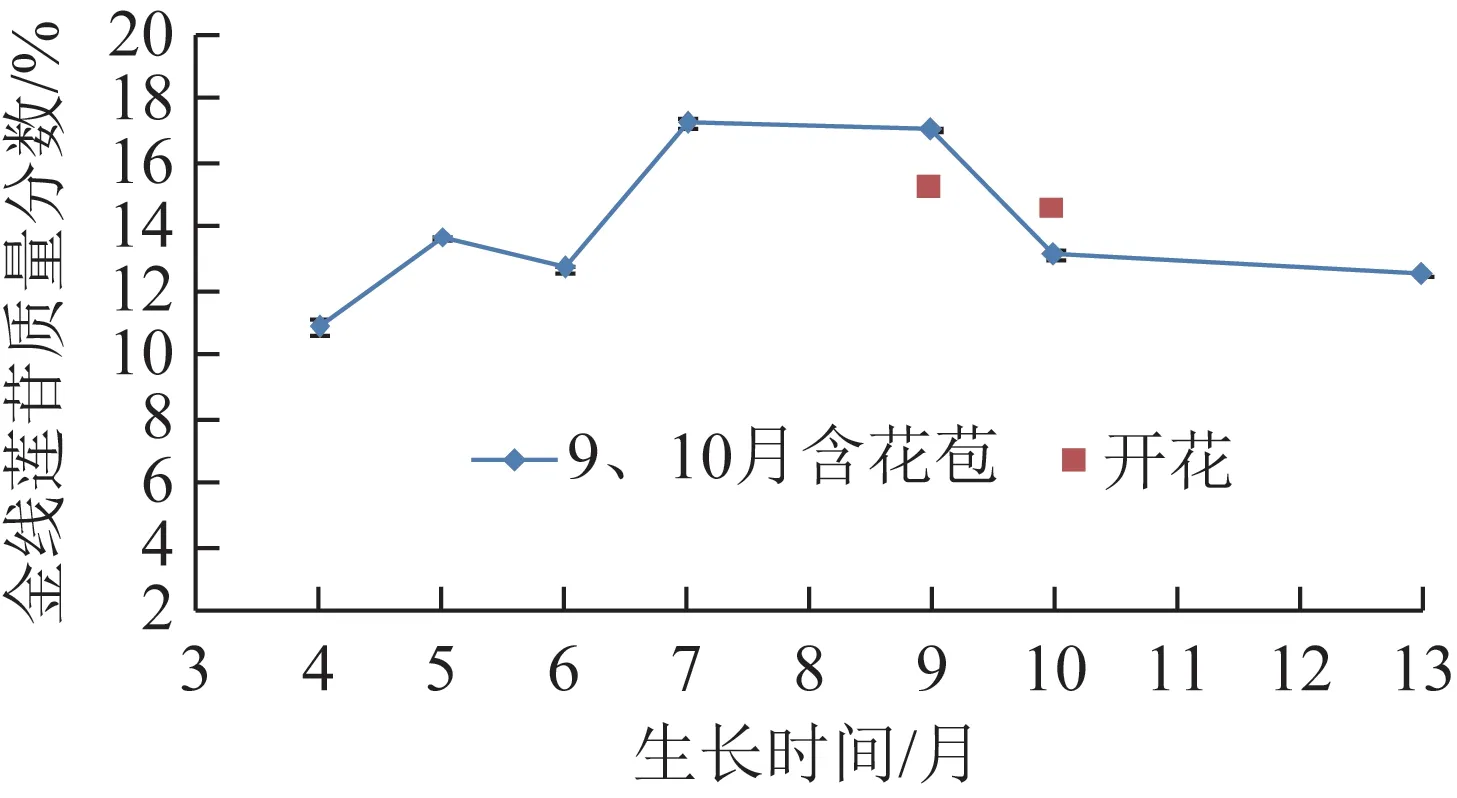
图3 仙游尖叶金线莲在不同生长期的金线莲苷质量分数(n=3)
3 讨论
3.1 金线莲苷提取和测定方法的选择
金线莲苷是由1 个五元环内酯与葡萄糖连接形成的苷,在酸碱性溶剂环境下易开环分解[23],故本研究选择操作简便、提取效率高的超声提取法[25],减少中间操作步骤,保证金线莲苷检测的准确性。研究过程中比较了不同色谱柱(C18柱和氨基柱)、不同检测器(二极管阵列检测器和蒸发光散射检测器)对金线莲苷保留、检测的效果,金线莲苷是强极性成分并为紫外末端吸收,应用C18柱出峰时间早且低波长下紫外吸收检测干扰大,而应用氨基柱可以在适当的时间出峰、分离度好,结合蒸发光散射检测器测定干扰小。与Wei 等[26]研究结果一致,均表明HPLC-ELSD 适用于金线莲苷成分快速、有效的测定。同时,选择粒径更小和柱长更短的氨基柱,可缩短单次样品检测时间,在10 min 内即可完成目标成分测定。
3.2 含量比较
本研究首次对不同品系及生长期金线莲的金线莲苷含量进行测定,结果表明不同生长方式金线莲的金线莲苷含量差异较大,组织培养、栽培和野生金线莲的金线莲苷含量分别为1.55%~16.14%、2.68%~21.97%和1.51%~11.40%。野生金线莲的金线莲苷含量极差较大,可能与产地样品种质资源和自然生长时间不同有关;不同品系组织培养金线莲的金线莲苷含量与产地有关。南靖大圆叶组织培养金线莲的金线莲苷质量分数最高,永安本地圆叶2 金线莲质量分数最低,可能是由于驯化引种的产区野生金线莲种质资源存在差异[4]。
同一产地不同品系栽培金线莲的金线莲苷含量在不同生长期变化趋势不同。永安尖叶和红霞金线莲在移栽3 个月生长后期的金线莲苷含量相对于前期均增加;南靖除尖叶金线莲的金线莲苷含量在1~4 个月生长期内呈持续上升趋势,其他4 种品系金线莲的金线莲苷含量随生长期延长波动变化。其中,本地野生金线莲的金线莲苷含量在2~4 个月生长期内均高于其他品系金线莲,生长4 个月尖叶、本地野生和大圆叶金线莲苷的含量均高于组织培养期,说明金线莲的金线莲苷含量与其品系和移栽生长时间有关。王海阁等[3]研究表明,大圆叶、小圆叶和尖叶金线莲经引种驯化已经产生遗传分化;杨彬彬[27]研究发现,同一产地不同生长阶段金线莲的金线苷含量随种植时间增长而增加;结合本研究结果提示,金线莲苷含量受种质资源的影响较大,同时可能与不同生长期金线莲苷生物合成量变化有关。此外,莆田仙游尖叶金线莲的金线莲苷含量进入花期之后呈下降趋势,但其含量仍显著高于生长4 个月的植株,说明在花期前延长种植时间有利于尖叶金线莲的金线莲苷含量的积累。
4 结论
综上所述,本研究建立了HPLC-ELSD 测定金线莲苷含量的方法,该方法准确、稳定、重复性好,为金线莲的质量评价提供方法参考。不同品系及生长期金线莲的金线莲苷含量差异较大,影响较大的2 个因素是种质资源和移栽生长时间。南靖不同品系金线莲组织培养苗的金线莲苷含量均较高,可考虑作为金线莲苷分离提取的原材料;不同品系金线莲的金线莲苷含量随移栽生长时间的变化趋势不同,总体上栽培有利于金线莲中金线莲苷含量的积累;金线莲苷含量较高的金线莲品系有本地野生、大圆叶和尖叶。
致谢:福建省三明永安市金线莲协会、福建省林业科技试验中心陈翔提供不同品系及生长期的金线莲样品,马来西亚理科大学(USM)任文辉指导本文撰写。

