猪伪狂犬病毒流行株的分离鉴定及其毒力试验
骆辉,王雪涛,廖果,谢伟,罗旭,阴文奇,周远成*
(1.畜科生物工程有限公司,畜禽生物制品四川省重点实验室,四川省动物生物制品工程技术研究中心,四川 成都 610200;2.四川省乐山市动物疫病预防控制中心,四川 乐山 614000)
猪伪狂犬病(PR)是由伪狂犬病毒(PRV)所引起的猪、牛、羊等多种家畜和野生动物以发热、奇痒(猪除外)及脑脊髓炎为主要症状的一种高度接触性传染病。猪是该病的天然宿主、主要储存宿主和传染源,无论是新生仔猪、育肥猪,还是成年种猪均可感染PRV,从而造成巨大的经济损失[1-2]。2 周龄内仔猪感染PRV 后死亡率较高,有的可达100%,常伴有腹泻、呕吐及共济失调、角弓反张等神经症状;断奶仔猪也能引起死亡,但主要表现为呼吸系统症状,也有部分猪出现神经症状、腹泻、呕吐等,耐过的仔猪往往发育不良,成为僵猪;育肥猪感染后可出现体温升高、呼吸困难,主要以呼吸道症状为主,死亡率较低;成年猪感染后不发病或仅表现为体温升高等轻微症状,呈隐性感染,长期带毒或排毒,成为最危险的传染源;妊娠母猪感染后会导致流产、产死胎和木乃伊胎等;种猪感染可致不育、睾丸肿胀,母猪返情、屡配不孕等[3-4]。
2011 年以来,我国多个省份出现免疫PRV疫苗的猪场发生猪伪狂犬病的案例,发病率和死亡率明显上升,且出现了新的发病特征,给中国养猪业造成了极大的损失,引起了业内高度重视[5]。本试验分别从国内多个地区采集了11份疑似猪伪狂犬病的病料,开展PRV流行毒株的分离与鉴定,并对不同地区分离的流行毒株进行基因同源性分析和毒力试验,为猪伪狂犬病的防控提供新的试验数据。
1 材料
1.1 病料来源 2015~2018 年,从四川南充、遂宁等地共采集猪伪狂犬病毒疑似阳性病料6 份,从湖北不同养殖场共采集猪伪狂犬病毒疑似阳性病料2 份,从江西不同养殖场共采集猪伪狂犬病毒疑似阳性病料3份,共计11份。所有疑似阳性病料都保存于畜禽生物制品四川省重点实验室。
1.2 细胞与试剂 PK-15细胞,由畜禽生物制品四川省重点实验室提供;新生牛血清、DMEM 细胞培养基均购自GIBCO 公司;TAKARA MiniBest Viral RNA∕DNA Extraction Kit试剂盒购自TAKARA公司;猪伪狂犬病毒gB、gE ELISA抗体检测试剂盒购自IDEXX公司;PCR检测相关试剂均购自宝生物工程(大连)有限公司。
1.3 试验动物 8~9 周龄猪伪狂犬病毒gB、gE ELISA 抗体呈阴性的健康试验猪,购自成都某猪场。
2 方法
2.1 病料处理 将采集的病料组织加液氮研磨后,用无血清的DMEM培养液按1∶5混合制成组织悬液,放置-70℃以下冰箱中冻融1次,以12000r∕min离心10 min,取上清液使用0.45 μm 滤膜过滤后,再次以12 000 r∕min 离心30 min,取上清液进行病毒分离。取0.5 mL 处理好的组织液接种致密单层的PK-15传代细胞,置37℃、5%CO2培养箱中吸附1h,倒掉病毒液,加入无血清DMEM培养液;再次置37 ℃、5%CO2培养箱中培养,每日观察细胞是否出现CPE,同时设正常细胞对照。连续观察5日,若未出现CPE,则取细胞培养液再次接种长满单层的PK-15 细胞进行盲传,直至出现CPE。当CPE 达75%以上时,取培养液上清继续接种长满单层的PK-15 细胞进行病毒传代。当接种病毒的细胞出现CPE 后,连续传代5 次,所有收获的病毒液于-80 ℃保存。
2.2 外源病毒检验 取出现CPE 以后代次的病毒液,按TAKARA MiniBest Viral RNA∕DNA Extraction Kit 试剂盒的方法提取核酸,分别以本实验室建立的猪伪狂犬病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪圆环病毒2 型、猪细小病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、支原体的PCR检测方法进行病毒核酸检测。
2.3 病毒含量测定 将分离的PRV 流行毒株,用无血清DMEM 培养液进行10 倍系列稀释,取10-4、10-5、10-6、10-74 个稀释度,分别接种于已长成良好单层、弃去细胞培养液的96孔PK-15细胞培养板,每个稀释度接种6 孔,每孔0.1 mL,同时设正常细胞对照。置37 ℃、含5% CO2培养箱中吸附1 h 后,每孔补加含4%新生牛血清的DMEM培养液0.1 mL。再次置37 ℃、含5%CO2培养箱中培养观察5日,根据Reed-Muench法计算TCID50。
2.4 病毒中和试验鉴定 将分离的猪伪狂犬病毒流行毒株,用无血清DMEM培养液分别稀释成103TCID50∕mL的病毒悬液,与56 ℃灭活30 min的猪伪狂病毒特异性血清等量混合,置37 ℃作用1 h;接种于已长满单层PK-15细胞并弃去细胞培养液的12 孔培养板,每孔0.2 mL,同时设病毒对照和正常细胞对照(每组2 孔)。置37 ℃、含5%CO2培养箱中吸附1 h 后,每孔补加含2%新生牛血清的DMEM 培养液3 mL,再次置37 ℃、含5%CO2培养箱中培养观察5日,记录各孔CPE情况。
2.5 不同流行毒株主要基因序列分析 根据PRV 基因组特征设计引物扩增gB、gC、gD、gE 基因序列全部或部分片段,阳性扩增产物送成都擎科梓熙生物技术有限公司进行序列测定(表1),使用DNAstar 和MEGA 7.0 分析软件进行核苷酸和氨基酸序列的差异比较,并构建遗传进化树。
2.6 毒力试验 将鉴定合格的猪伪狂犬病毒流行毒株,每个毒株选用1 个代次进行毒力试验。将待检病毒稀释成106.0TCID50∕mL,每个分离株接种8~9 周龄PRV gB、gE 抗体呈阴性的健康仔猪5 头,每头滴鼻接种3 mL。接种前观察2~3 日,每日定时测体温1 次,取其平均值作为基础体温。接种后连续观察21日,每日定时测量体温1次,观察试验猪精神、食欲是否正常,是否出现呼吸困难、神经症状等伪狂犬病相关临床症状,同时记录试验猪死亡情况。

表1 PRV主要结构蛋白扩增引物序列信息
3 结果
3.1 病毒分离结果 从11份猪伪狂犬病疑似阳性病料中共分离到6 株病毒,其中从四川采集的6 份病料中分离到3 株病毒,分别命名为SCHS株、SCM1 株、SCY1 株;从湖北采集的2 份病料中分离到1株病毒,命名为HBA1株;从江西采集的3 份病料中分离到2 株病毒,命名为JXHS 株与JXN1株。
3.2 外源病毒检测结果 从四川分离的3 株病毒中,SCHS 株与SCM1 株仅PRV 检测结果为阳性,其余检测结果均为阴性,SCY1株的PRV与支原体检测结果均为阳性。从湖北分离的HBA1株的PRV、PCV2 与支原体检测结果均为阳性。从江西分离的JXHS 株仅PRV 检测结果为阳性,JXN1 株的PRV 和PCV2 检测结果均为阳性。病毒纯净性检验结果见表2。
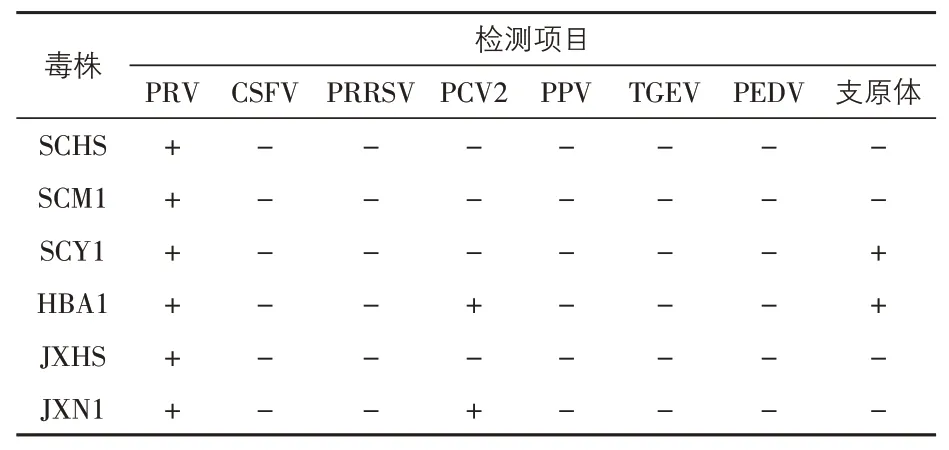
表2 猪伪狂犬病毒分离株的PCR检测结果
3.3 病毒含量测定结果(表3) SCHS株与JXHS株在PK-15 细胞上适应良好,F5~F10 代的最高病毒含量分别为107.4TCID50∕mL、107.75TCID50∕mL;SCM1 株、SCY1 株、HBA1 株、JXN1 株F5~F10 代的最高病毒含量在106.4TCID50∕mL左右。
3.4 中和试验鉴定结果 用纯净性检验仅PRV呈阳性的SCHS株、SCM1株、JXHS 株进行中和试验鉴定,结果显示3 株分离病毒均能被猪伪狂犬病毒特异性血清中和。
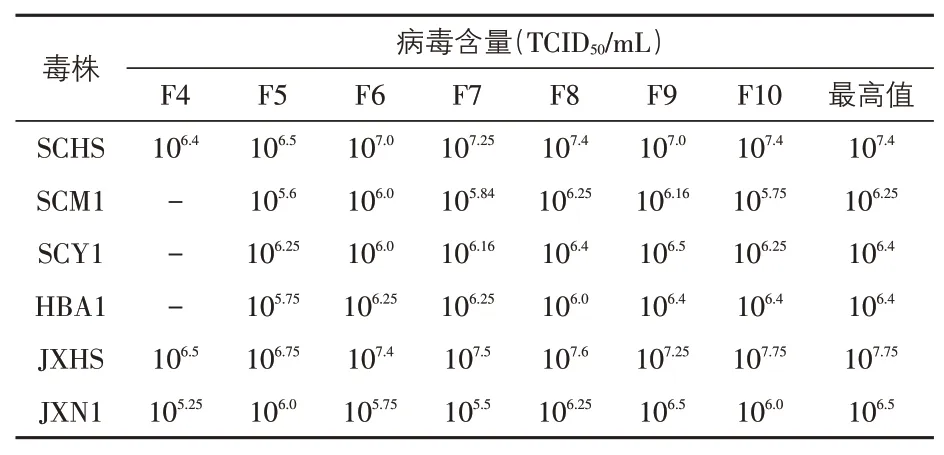
表3 猪伪狂犬病毒分离株的病毒含量测定结果
3.5 不同毒株主要基因序列分析 使用所设计的引物成功扩增出6个分离毒株的部分gB、gC基因和全长gD、gE 基因,对扩增阳性产物进行序列测定,获得了6 个毒株的主要结构蛋白基因序列。通过DNAstar 软件分析,发现所分离毒株HBA1、JXN1、SCY1 的gB 扩增片段核苷酸序列与JS-2012株的同源性为100%,其余毒株的gB扩增片段核苷酸序列与JS-2012株的同源性为99.7%~99.9%,与Bartha 株的同源性在95.4%~95.6%之间。JXHS、SCHS、JXN1 的gC 基因与JS-2012 株的同源性为100%,其余毒株的gC基因与JS-2012株的同源性为99.5%~99.8%;所有分离毒株的gC 基因与Bartha 株的同源性均在90.7%~91.2%之间。SCY1 株、SCM1 株、JXHS 株的gD 基因与JS-2012 株的同源性为100%,其余毒株的gD 基因与JS-2012株的同源性为99.8%或99.9%;所有分离毒株的gD基因与Bartha株的同源性在98.7%~98.9%之间。所有分离毒株的gE 基因与JS-2012株的核苷酸同源性在99.1%~99.8%之间。
选择近年来我国流行的PRV 流行毒株和PRV 经典毒株的相应序列,构建gB、gC、gD 和gE基因序列的遗传进化树,结果显示4 个主要结构蛋白基因序列的分析结果一致,PRV 呈现2 个不同基因型分支,即:以Bartha株为代表的基因1型和我国分离株形成的基因2型。本试验分离的毒株均为基因2 型毒株,与当前我国主要流行毒株的遗传关系接近。
3.6 不同毒株的毒力试验结果 用纯净性检验仅PRV呈阳性的SCHS株、SCM1株、JXHS株进行毒力试验,结果显示3 个流行毒株均能导致8~9周龄试验猪100%(5∕5)发病。用SCHS 株攻毒后全部试验猪(5∕5)都出现呼吸道症状,观察期内有3∕5 死亡;用SCM1 株攻毒后有4∕5 的试验猪出现呼吸道症状,观察期内有1∕5 死亡;用JXHS 株攻毒后有2∕5 的试验猪出现呼吸道症状,观察期内全部存活。不同毒株的毒力试验结果见表4。
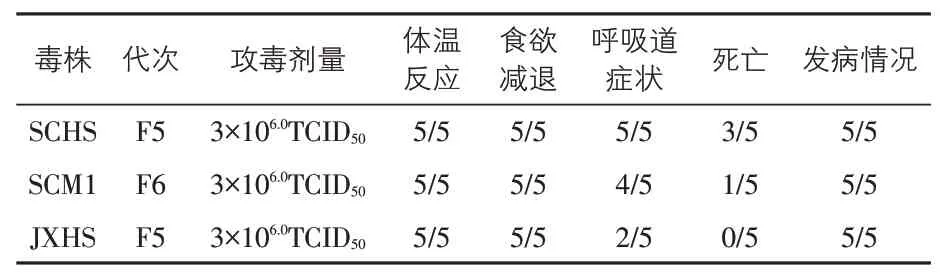
表4 猪伪狂犬病毒不同分离株的毒力试验
4 结论与讨论
2011 年前后在全国范围内出现了新的猪伪狂犬病疫情,主要表现为突发性大面积种猪流产,育肥猪致死性感染,猪群gE 抗体阳性率突然升高,部分猪场的gE 抗体阳性率高达100%。疫情发生的地区不同、免疫状况不同而呈现出不同的临床表现。免疫状况较好的猪场,大多无明显临床症状,但猪群gE 阳性率突然升高;免疫状况较差的猪场,主要表现为种猪大面积流产、仔猪腹泻、育肥猪出现呼吸道症状与急性死亡[6]。
新疫情发生以后,全国多个实验室分离到新的猪伪狂犬病毒流行毒株,经过致病力试验、免疫保护试验和分子流行病学研究,一致认为新流行的猪伪狂犬病毒株在主要毒力基因gE、gI以及与免疫保护相关的基因gB、gC、gD上存在多个位点的变异[7-9]。从我国不同地区分离的新流行毒株,与目前广泛使用的猪伪狂犬病活疫苗Bartha K61 毒株位于不同的基因亚型,动物试验与中和抗体检测均证实Bartha K61 毒株对我国猪伪狂犬病免疫保护的效果较差,其保护力低于50%,而使用流行毒株构建的基因缺失疫苗能够为仔猪提供100%的免疫保护[10-12]。本试验分离的6株猪伪狂犬病毒主要基因位点与国内猪伪狂犬病毒流行毒株JS-2012 株的同源性均在99%以上;与Bartha K61 株gB 基因的同源性约为95%,与gC 基因的同源性在90.7%~91.2%,与gD 基因的同源性在98.7%~98.9%。基于主要基因位点的遗传进化分析结果显示,猪伪狂犬病毒已呈现2个不同的基因型分支,即:以Bartha株为代表的基因1型和我国流行的基因2型。本试验分离的毒株均为基因2 型毒株,与当前我国主要流行毒株的遗传关系接近。
猪伪狂犬病毒只有一个血清型,但不同毒株在毒力和生物学特征等方面存在差异。本试验分离的猪伪狂犬病毒SCHS 株、SCM1 株与JXHS株无外源病毒污染,滴鼻感染8~9 周龄试验仔猪,均能导致试验猪全部(5∕5)出现体温反应,但不同毒株的毒力存在较大差异。SCHS株攻毒后全部(5∕5)出现呼吸道症状,观察期内有3∕5死亡;SCM1株攻毒后有4∕5出现呼吸道症状,观察期内有1∕5 死亡;JXHS 株攻毒后有2∕5 出现呼吸道症状,观察期内全部存活。
SCHS、SCM1、JXHS 这3 个纯净的猪伪狂犬病毒流行毒株均能导致易感动物发病,成功地构建了猪伪狂犬病流行毒株的攻毒模型。本试验有助于进一步评价不同毒株活疫苗对我国当前PRV流行毒株的攻毒保护效果,为猪伪狂犬病疫苗的评价,灭活疫苗及新型弱毒疫苗的研发提供新的依据。

