贵州省两栖类新记录种
——中华湍蛙及其蝌蚪描述
李仕泽, 刘京, 徐宁, 魏刚, 王斌
(1.茅台学院食品科学与工程系,贵州仁怀564500; 2. 贵阳学院, 贵州省生物多样性与应用生态学特色 重点实验室,贵阳550005; 3.中国科学院成都生物研究所,成都610041)
湍蛙属AmolopsCope, 1865物种广泛分布于喜马拉雅山脉东部和南部,东至中国大陆东南部,南至马来半岛,目前该属已报道59种(Frost,2019),我国分布32种,贵州省记录的湍蛙属物种3种,即水城湍蛙A.shuichengicusLyu & Wang, 2019、崇安湍蛙A.chunganensis(Pope,1929)和华南湍蛙A.ricketti(Boulenger,1899)。水城湍蛙仅分布在贵州水城(Frost,2019),崇安湍蛙仅分布在贵州雷山和江口(费梁等,2012;魏刚等,2017),华南湍蛙在贵州大部分地区均有分布(伍律等,1986)。
2015年7月,在贵州梵净山国家级自然保护区(108°35′19″E,27°55′8″N,海拔1 032 m)采集到2号雄性湍蛙属标本;2018年7月,在贵州雷公山国家级自然保护区(108°20′24″E,26°20′59″N,海拔686 m)采集到1号湍蛙属蝌蚪标本,2018年8月,采集到1号雌性湍蛙属标本。经形态比较和分子系统发育分析鉴定为中华湍蛙A.sinensisLyu, Wang, and Wang, 2019,为贵州省湍蛙属新记录。本研究对贵州分布的中华湍蛙进行了详细形态学描述,对该物种的蝌蚪形态特征进行了首次描述,并对贵州省湍蛙属物种的分布进行了厘定,为该物种的系统学和谱系地理学研究提供了新信息。
1 材料与方法
1.1 材料
4号标本取肌肉组织保存于95%的乙醇中(表1)。标本浸泡于福尔马林溶液,保存于中国科学院成都生物研究所(CIB)。
1.2 形态鉴定与测量
对3号成体标本及1号蝌蚪标本用游标卡尺测量形态特征,精确到0.01 mm。蝌蚪分期依据Gosner(1960)的方法,测量依据《中国两栖动物检索及图鉴》(费梁等,2005)。
1.3 分子生物学及分子系统学方法鉴定
采用高盐法提取肌肉样品总DNA。利用PCR扩增并测定了线粒体COⅠ基因部分片段。扩增引物参照Che等(2012)的Chmf4(5’-TYTCWACWAAYCAYAAAGAYATCGG-3’)和Chmr4(5’-AC-YTCRGGRTGRCCRAARAATCA-3’)。30 μL PCR反应体系:15 μL mix,上、下游引物各1 μL,基因组DNA 1 μL,灭菌水12 μL。PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,48 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 7 min。PCR产物分别用上、下游引物测序,所得序列上传到GenBank(表1)。
1.4 分子系统发育关系重建
下载GenBank中湍蛙属部分物种和蛙科Ranidae部分相近物种的COⅠ基因序列,结合本文序列,进行分子系统发育分析(表1)。所有序列在Clustal X 1.8(Thompsonetal.,1997)中进行比对,采用默认配置,比对后的序列进行人工校对。系统发育树的构建采用最大似然法(maximum likelihood,ML)。构建ML树前,利用jModeltest 2(David,2008)基于AIC标准选择最适核苷酸替代模型。ML树的构建在PhyML 3.0(Guindonetal.,2012)中完成,并进行1 000次bootstrap重抽样分析,检验各节点置信度。
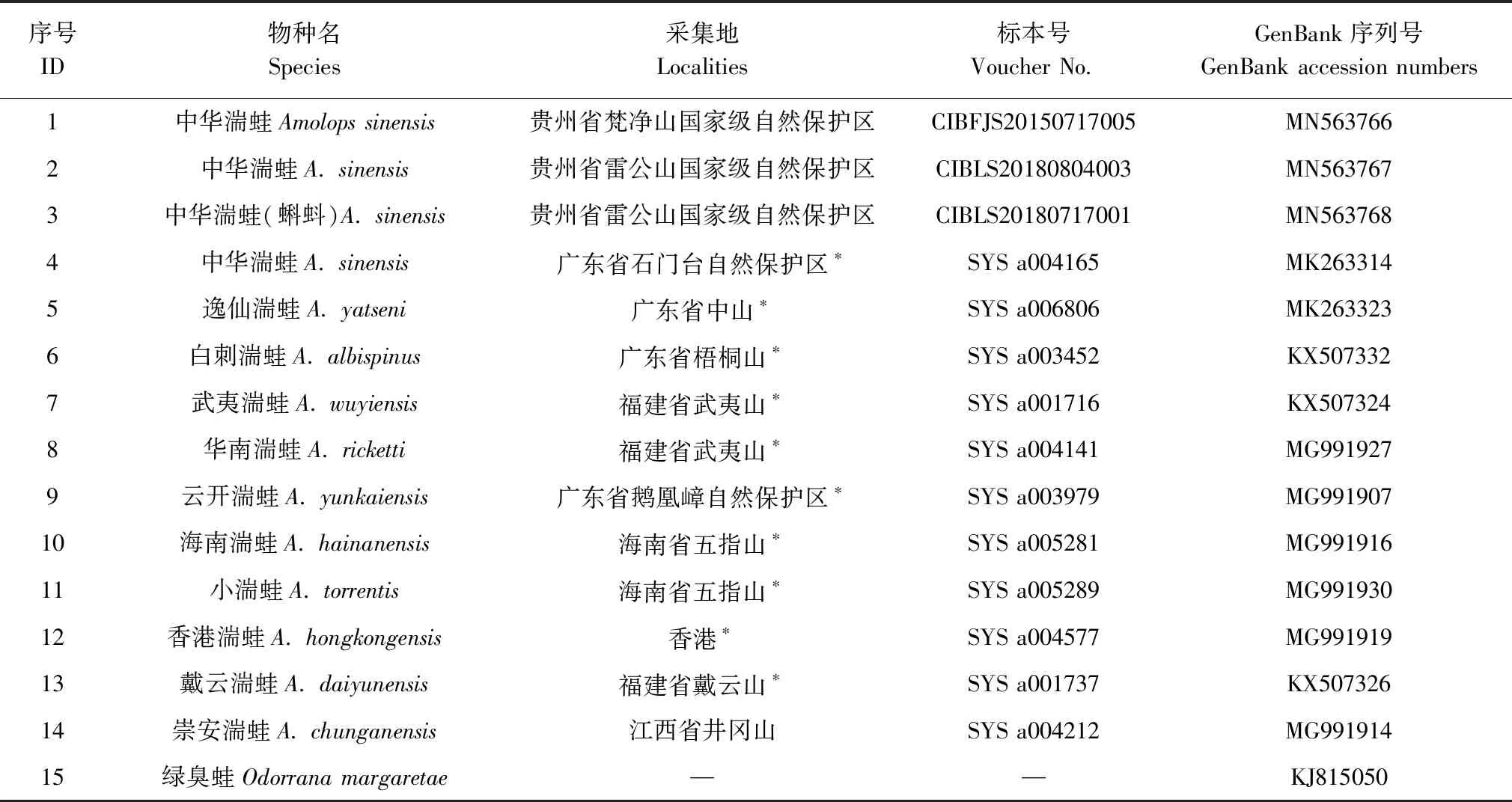
表1 样品信息表Table 1 Samples and the GenBank accession numbers of COⅠ gene sequences
注Note:*模式产地type locality
1.5 遗传距离
用MEGA 6.0(Tamuraetal.,2013)的Kimura双参数模型计算表1所列湍蛙属物种间的遗传距离。
2 结果
2.1 形态学分析结果
比较了贵州采集的湍蛙标本和文献所列湍蛙属物种的形态鉴定特征,发现本研究采集的标本形态特征与中华湍蛙模式产地标本相符:雄蛙体长56.1~58.0 mm,雌蛙体长51.8 mm,其他部位量度见表2。头体扁平,头宽大于头长,吻端钝圆,吻棱明显,鼻孔位于吻眼之间,略近吻端。鼻间距大于眼间距,鼓膜小于第3指吸盘,位于眼后。颞褶显著,自眼后角经鼓膜背缘到肩胛部。犁骨齿发达,位于内鼻孔之间。舌后端缺刻深。

表2 贵州中华湍蛙标本形态量度Table 2 Morphological measurements of Amolops sinensis specimens collected from Guizhou province
前肢长,指长顺序为1<2<4<3,指端具吸盘,前缘有横沟,关节下瘤显现,第2、3、4指指基下瘤明显,掌突2,位于第2指基部和掌心,大而扁平。指间无蹼。后肢长,后肢贴体前伸时,胫跗关节达眼,左右跟部重叠,趾端均具吸盘和横沟,关节下瘤明显,趾间全蹼,第1、5趾游离侧具缘膜,内蹠突长圆形,无外蹠突。
皮肤粗糙,背部散有痣粒,体侧疣粒大而多。口角后端有1~2个颌腺。雄蛙上颌缘有小白刺,腹部光滑有细粒,胸腔上部及咽部有黑色斑。
生活时背面有黄绿色和褐色相间的斑纹。四肢背面有深色横纹,股部4~5条,胫部5~6条。两眼前角间有一白点。颌腺略带黄色。腹面乳白色。
雄蛙第1指基内缘有乳白色婚垫,婚垫上具婚刺,无声囊及雄性线。
1号蝌蚪标本(标本号:CIBLS20180717001)处于发育阶段第32期,全长36.1 mm、头体长12.9 mm、头宽10.4 mm、吻长6.0 mm、眼间距3.7 mm、吸盘宽8.2 mm、尾长23.0 mm、尾宽4.2 mm、尾高6.5 mm、吻至出水孔距离12.0 mm。生活时体背面灰色,腹面乳白色,吻端圆,体扁;鼻孔近眼,眼位于头背侧,出水孔位于左侧,游离管较长,肛孔开口于尾基腹面中央。口宽大,位于头腹面,口后有一大吸盘,吸盘横径大于口宽;上、下唇进口角处有唇乳突,唇齿式为Ⅲ∶1+1/1+1∶Ⅱ (图1:E、F)。
2.2 分子系统发育关系和遗传距离
PCR扩增共获得中华湍蛙线粒体COⅠ基因序列 3条,长度573 bp。序列中保守位点354个,简约信息位点191个,T、C、A、G含量分别为32.5%、25.8%、25.5%、16.2%,A+T含量高于G+C含量。本文所用最适核苷酸替代模型为GTR+G+I。ML树显示,贵州梵净山和雷公山所采的湍蛙标本与中华湍蛙模式产地(广东省英德市)的标本聚合构成单系(图2),且有较高的支持率(99%)。基于Kimura双参数模型估算的湍蛙属部分物种间的遗传距离(表3)表明,本研究中所采用的湍蛙属物种间的遗传距离为6.5%~25.0%,平均遗传距离为13.5%;贵州所采湍蛙标本与中华湍蛙模式产地标本间的遗传距离为1.2%,远小于湍蛙属物种间的遗传距离。分子系统发育分析和遗传距离结果均支持采集于贵州梵净山和雷公山的湍蛙标本为中华湍蛙。
2.3 生境描述
中华湍蛙在贵州梵净山国家级自然保护区和贵州雷公山国家级自然保护区内主要分布于海拔600~1 100 m的山间水流较为湍急的河流,常栖于河流内石头上或河边树枝上(图1:G)。与其同域分布的两栖类有棘指角蟾Megophrysspinata、棘腹蛙Quasipaaboulengeri、武陵瘰螈Paramesotritonwulingensis、大绿臭蛙Odorranagraminea和黄岗臭蛙Odorranahuanggangensis。

图1 贵州中华湍蛙及生境Fig. 1 Amolops sinensis and its habitat in Guizhou province
A. 背面观(♂), B. 腹面观(♂), C. 背面观(♀), D. 腹面观(♀), E. 蝌蚪背面观, F. 蝌蚪腹面观, G. 梵净山生境
A. dorsal view (♂), B. ventral view (♂), C. dorsal view (♀), D. ventral view (♀), E. dorsal view of tadpole, F. ventral view of tadpole, G. habitat ofA.sinensisin the Fanjingshan National Nature Reserve
3 讨论
Boulenger(1899)将福建省武夷山的2号湍蛙标本定名为华南湍蛙,此后相继在中国南方、印度支那北部和中部报道了此物种的分布(费梁等,2012;Frost,2019)。分子系统学的发展极大地提高了人们对隐存种的识别能力(Funketal.,2012)。被鉴定为华南湍蛙的白刺湍蛙AmolopsalbispinusSung, Hu, Wang, Liu, and Wang, 2016、逸仙湍蛙AmolopsyatseniLyu, Wang, and Wang, 2019和中华湍蛙均为隐存种。华南湍蛙分布广泛,是否还存在隐存种需进一步研究。
华南湍蛙在贵州省广泛分布于印江、松桃、雷山、贵定、都匀、绥阳、赤水和石阡等地区(伍律等,1986)。本文基于形态比较和分子系统发育分析发现,分布于贵州省梵净山和雷公山原鉴定为华南湍蛙的物种应为中华湍蛙,为贵州省湍蛙属物种新记录。印江、松桃、赤水和石阡同属武陵山脉,雷山、都匀和贵定属苗岭山脉,因此推测分布于这些地区的此前被鉴定为华南湍蛙的湍蛙物种可能为中华湍蛙,而绥阳属于大娄山脉,因此分布于该地区的华南湍蛙是否应为中华湍蛙或为湍蛙属隐存种还需进一步研究。
中华湍蛙梵净山及雷公山种群与模式产地广东英德种群相比,在形态上,梵净山及雷公山种群雄蛙个体较大(雄蛙头体长58.1~58.0 mm),而模式产地种群的雄蛙头体长40.2~46.5 mm;后肢贴体前伸时,胫跗关节仅达眼,而模式产地种群后肢贴体前伸时,胫跗关节达吻端;在分子上2个种群间成单系,遗传距离为1.2%,说明2个种群间已产生分化。从地理分布上看,中华湍蛙贵州种群分布于武陵山脉和苗岭山脉,中华湍蛙的模式产地广东省处于南岭山脉最南端,中间隔以雪峰山及苗岭。中华湍蛙贵州种群与模式产地种群在形态及分子上存在一定差异的原因是否由长期的地理隔离造成,还需进一步研究。
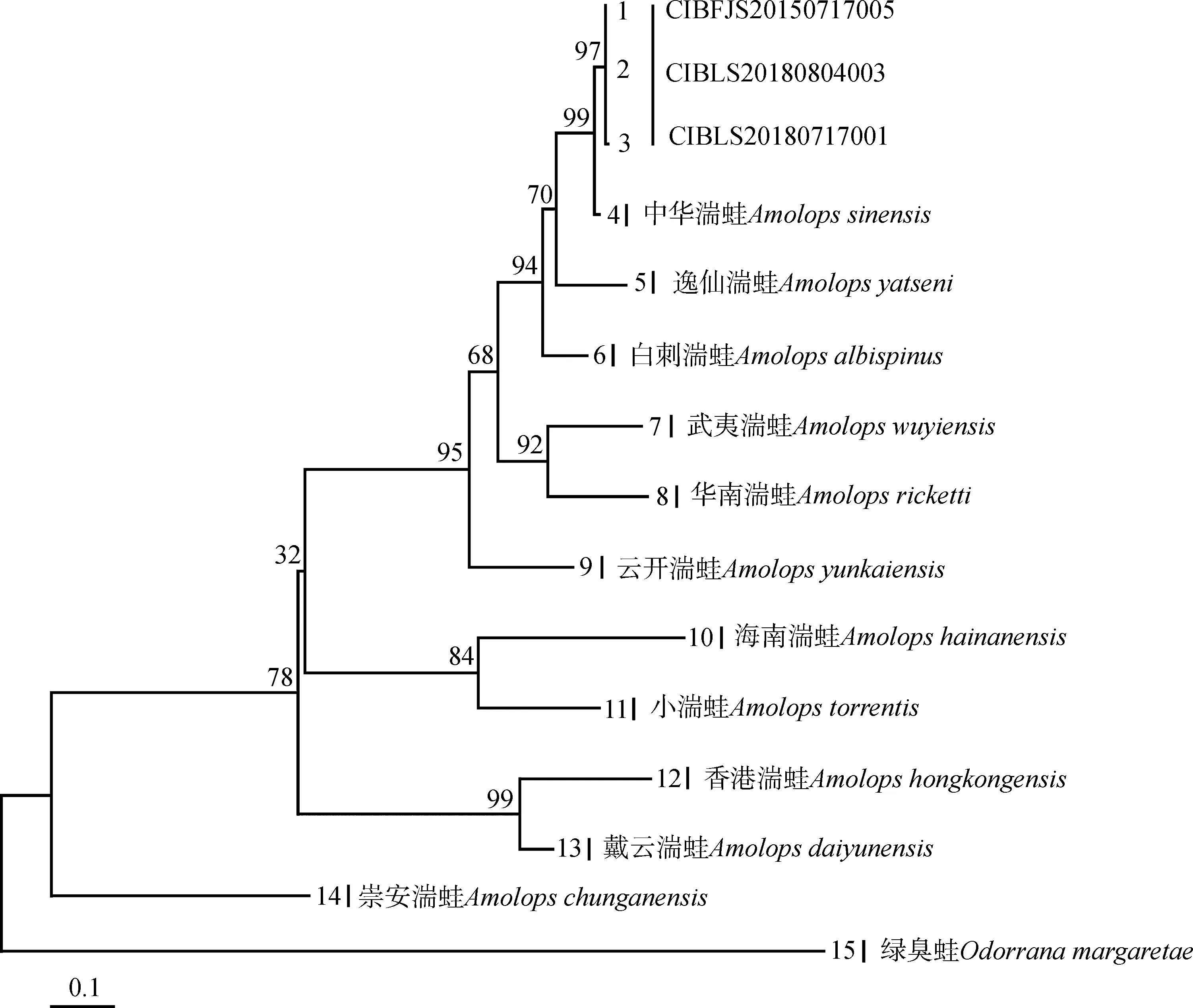
图2 基于线粒体COⅠ基因序列构建的湍蛙属最大似然系统发育树
Fig. 2 Maximum likelihood tree forAmolopsconstructed based onCOⅠgene sequences
支上的数字代表重抽样支持率; CIBFJS20150717005、CIBLS20180804003、CIBLS20180717001为本研究中贵州所采样品编号, 其余物种序列信息见表1
Numbers beside nodes indicate bootstrap values; CIBFJS20150717005, CIBLS20180804003 and CIBLS20180717001 are the samples collected in this study (Guizhou province); the sequence information of other species are shown in table 1

表3 基于线粒体COⅠ基因计算本研究中的湍蛙属物种间Kamura-2-parameter距离Table 3 COⅠ gene sequence-based genetic distance analysis of 11 Amolop species examined in this study
注:*来自贵州湍蛙属物种样品
Note:*Amolopsspecies were from Guizhou province

