浅谈“模型认知”在水溶液离子平衡复习中的应用
熊 伟
(重庆市求精中学校 重庆 400015)
水溶液中的离子平衡是历年高考考查的热点与难点,选择题与主观题常以图像为载体进行考查,学生得分率普遍较低,常见的题海战术虽能提升学生解题的熟练程度,但会造成知识的碎片化、理解的肤浅化、思维的呆板化。“模型认知”通过认识研究对象的本质特征、构成要素及其相互关系,建立模型;运用模型解释化学现象、揭示现象的本质和规律,可训练学生高阶思维,形成迁移能力。
一、体验经典,建立图像分析模型
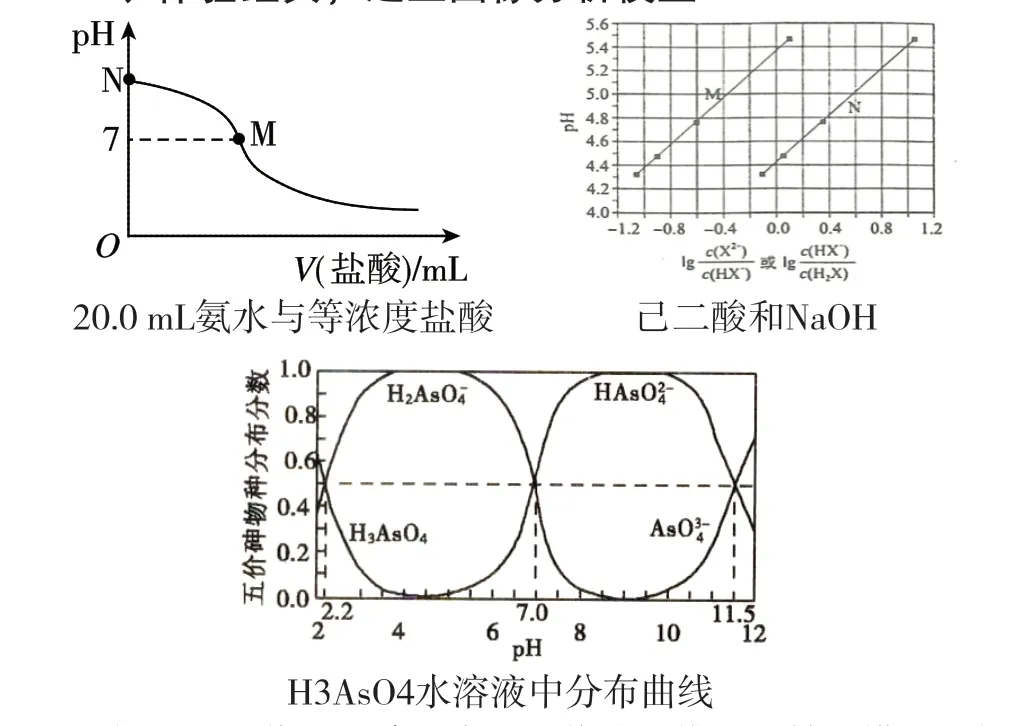
根据以上图像,可建立常见图像分析模型:轴(横纵坐标含义)→点(特殊点)→线(曲线走向和突变)
二、突破难点,构建难点思维模型
常见问题始终围绕以下展开①Ka或Kh的计算②溶液中粒子浓度排序③水的电离程度变化④三大守恒
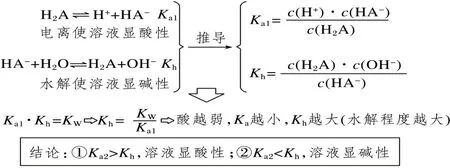
(一)Ka和Kh计算模型
(二)溶液中粒子浓度排序模型
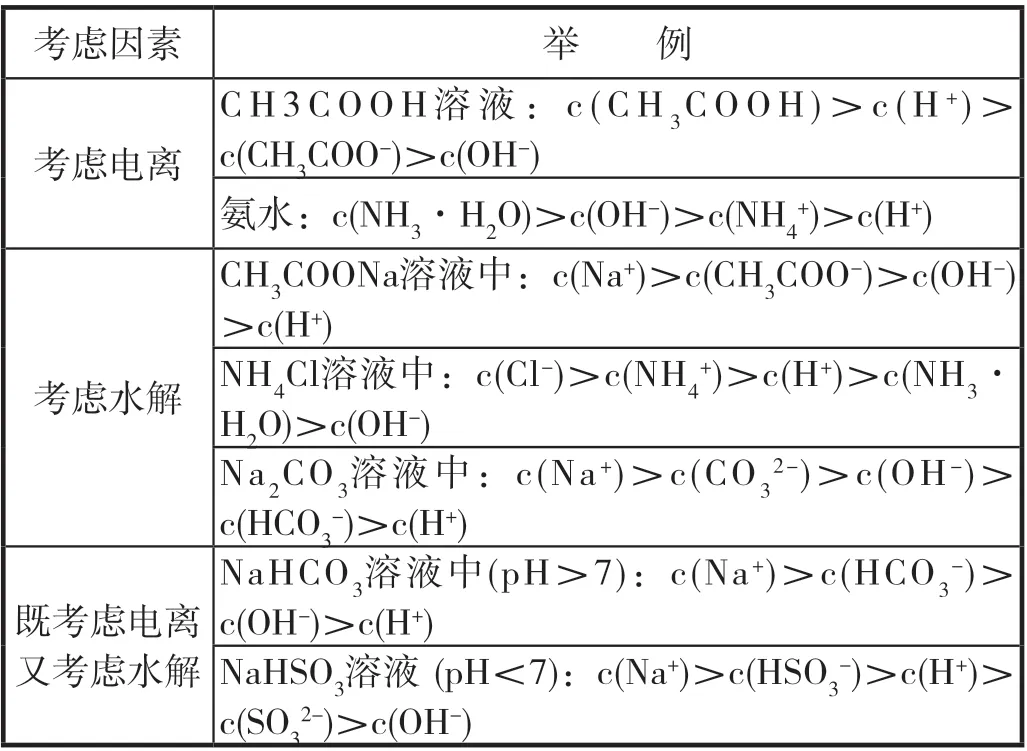
考虑因素 举 例考虑电离C H 3 C O O H 溶液:c(C H 3C O O H)>c(H +)>c(CH3COO-)>c(OH-)氨水:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)考虑水解CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)>c(OH-)Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)NaHCO3溶液中(pH>7):c(Na+)>c(HCO3既考虑电离又考虑水解-)>c(OH-)>c(H+)NaHSO3溶液 (pH<7):c(Na+)>c(HSO3-)>c(H+)>c(SO3 2-)>c(OH-)
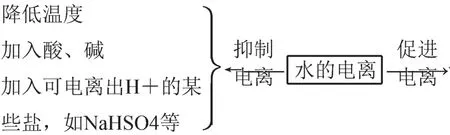
(三)水电离程度大小的思维模型
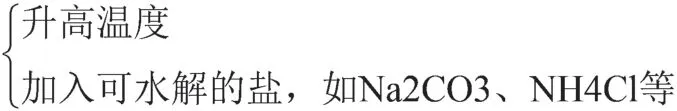
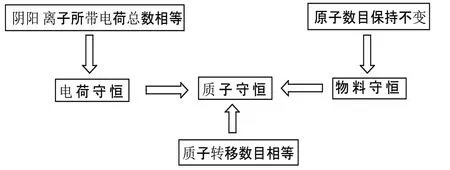
(四)三大守恒书写模型
三、应用模型,解决高考压轴难题
2020年全国I卷13题:以酚酞为指示剂,用0.1000 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VN OHa的变化关系如下图所示,正确的是
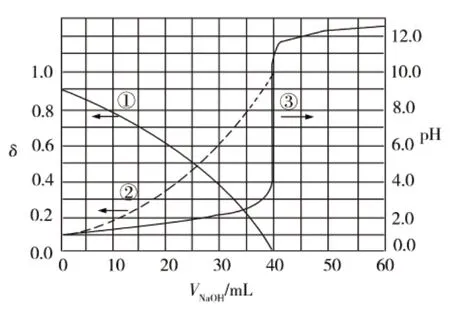
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.2000 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)<c(HA-)
图像分析:轴(找准①②对应左纵坐标,③对应右纵坐标);线(①②为分布曲线,③为滴定曲线);点(③起点,H2A溶液pH≈1,其浓度约为0.1 mol/L。则H2A完全电离溶液中没有H2A分子,但第二级电离是可逆电离,故曲线①是HA—的分布系数)
难点突破:当VNaOH=40mL时,溶质为Na2A,故曲线②是A2-的分布系数,A、B均错误。曲线①和曲线②的交点计算Ka,溶液pH=2,可知K(HA-)=1.0×10-2,故C正确。滴定终点溶质为Na2A,电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),因为此时溶液pH大于7,故D错误。正确答案为C。

