三维适形放疗与静态调强放疗治疗局部晚期非小细胞肺癌的临床疗效和剂量学参数及对免疫功能的影响
周珊,温莹浩,朱泽文,占志强,彭济勇
萍乡市人民医院肿瘤科,江西 萍乡3360000
晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌常见类型之一,患者多表现为咳嗽、胸闷、体重减轻等,甚至出现咳血或呼吸困难,此类患者多错过了手术切除的最佳时机,需行放射治疗[1-2]。三维适形放疗(3-dimensional conformal radiatherapy,3D-CRT)与调强放疗(intensity modulated radiatherapy,IMRT)是目前治疗晚期NSCLC 的常用手段,前者经计算机断层扫描(CT)图像重建肿瘤三维结构,在不同方向上对照射野实施高精度照射,后者可按照一定要求对照射野内的剂量强度进行调节,降低对周围组织的照射剂量,提高对局部病灶的照射剂量[3]。本研究旨在分析3D-CRT与IMRT治疗局部晚期NSCLC患者的临床疗效、剂量学参数及对免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2016 年1 月至2019 年5 月萍乡市人民医院收治的局部晚期NSCLC 患者。纳入标准:①TNM 分期为Ⅲ期;②经病理检查确诊为局部晚期NSCLC;③卡氏功能状态(Karnofsky performance status,KPS)评分≥60 分;④心电图、血常规检查正常。排除标准:①合并肺、胸膜或全身广泛转移;②合并高度肺气肿;③合并癌性空洞、巨大癌肿;④合并严重感染;⑤生存期<3 个月。依据纳入和排除标准,本研究共纳入80 例患者。根据放疗方案的不同将患者分为A 组和B 组,每组40 例,A 组患者接受IMRT,B 组患者接受3D-CRT。A 组中,女17 例,男23 例;年龄为47~69 岁,平均年龄为(58.65±4.28)岁;TNM 分期:ⅢA 期13 例,ⅢB 期27例;病理类型:鳞状细胞癌21 例,腺癌17 例,腺鳞癌2 例。B 组中,女15 例,男25 例;年龄为46~71岁,平均年龄为(58.70±4.26)岁;TNM 分期:ⅢA 期14 例,ⅢB 期26 例;病理类型:鳞状细胞癌20 例,腺癌16 例,腺鳞癌4 例。两组患者的性别、年龄、TNM 分期及病理类型比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
患者取仰卧位,固定体位后,CT 定位扫描,层厚为3 mm,勾画病灶大体肿瘤靶区(gross tumor volume,GTV),对于鳞状细胞癌、腺癌,分别在GTV 的基础上外扩6、8 mm 勾画临床靶区(clinical target volume,CTV),对患者的呼吸运动进行检测并制订计划靶体积(planning tumor volume,PTV),勾画肺组织邻近器官和正常食管、脊髓、心脏等结构。A 组患者接受IMRT:以逆向动态优化方案和5 野静态调强技术实施治疗,需考虑患者心脏受照容积、正常肺组织受照容积、靶区和脊髓受照剂量等因素,计划靶区要求以95%等剂量线覆盖。处方剂量PTV:单次剂量为2.0 Gy,总剂量为60~66 Gy,处方剂量覆盖PTV 达到95%,心脏V40≤50%,脊髓最大剂量≤45 Gy,每周治疗5 次,共治疗30 次。B组患者接受3D-CRT:取适形放射治疗照射野,以病变处作为高剂量靶区,最大限度地保护正常组织,计划靶区要求以95%等剂量线覆盖,以GTV 几何中心作为治疗中心,实施共面等中心照射。根据患者病情对照射权重、入射方向、楔形板角度进行调整,使高剂量区与靶区适形,治疗总剂量为60~66 Gy,单次放疗剂量为2.0 Gy,每周治疗5 次,共治疗30 次。两组患者均采用多西紫杉醇联合顺铂方案进行化疗:静脉滴注顺铂75 mg/m2,第1~3天给药;静脉滴注多西紫杉醇75 mg/m2,第1 天。21 天为1 个疗程,持续治疗2 个疗程。
1.3 观察指标及评价标准
采用世界卫生组织(WHO)实体瘤疗效评价标准[4]评价两组患者的临床疗效:完全缓解(complete response,CR),目标病灶消失,且至少持续4 周;部分缓解(partial response,PR),病灶体积缩小50%及以上,且至少持续4 周;疾病稳定(stable disease,SD),病灶体积缩小不足50%或增大不超过25%;疾病进展(progressive disease,PD),病灶体积增大25%以上或出现新病灶。总有效率=(CR+PR)例数/总例数×100%。比较两组患者的剂量学参数,包括平均剂量、异质性指数(heterogeneity index,HI)、适形指数(conformity index,CI)。分别抽取治疗前和治疗6 个月后两组患者的空腹静脉血5 ml,离心取上清液,采用流式细胞仪检测免疫因子水平,包括CD3+CD8+T 细胞与CD3+CD4+T 细胞水平。依据美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准[5]评价治疗期间两组患者的不良反应,主要观察3 级以上血小板减少、放射性食管炎、放射性肺炎、消化道反应、白细胞减少。
1.4 统计学方法
采用SPSS 21.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效的比较
A 组患者的总有效率为75.00%(30/40),其中CR 8 例,PR 22 例,SD 8 例,PD 2 例;B 组患者的总有效率为70.00%(28/40),其中CR 7 例,PR 21 例,SD 9 例,PD 3 例。两组患者的总有效率比较,差异无统计学意义(χ2=0.251,P=0.617)。
2.2 剂量学参数的比较
A 组和B 组患者的平均剂量比较,差异无统计学意义(P>0.05);A 组患者的HI 和CI 均明显高于B 组,差异均有统计学意义(P<0.01)。(表1)
表1 两组患者剂量学参数的比较(±s)
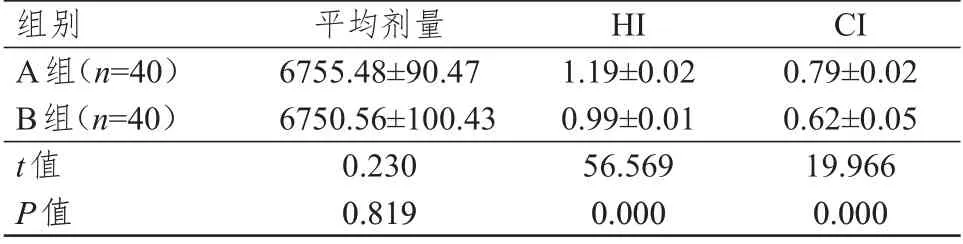
表1 两组患者剂量学参数的比较(±s)
组别A组(n=40)B组(n=40)t值P值平均剂量6755.48±90.47 6750.56±100.43 0.230 0.819 HI 1.19±0.02 0.99±0.01 56.569 0.000 CI 0.79±0.02 0.62±0.05 19.966 0.000
2.3 免疫因子水平的比较
治疗前和治疗后两组患者的CD3+CD8+T 细胞、CD3+CD4+T 细胞水平比较,差异均无统计学意义(P>0.05)。(表2)
表2 治疗前后两组患者的免疫因子水平(%,±s)
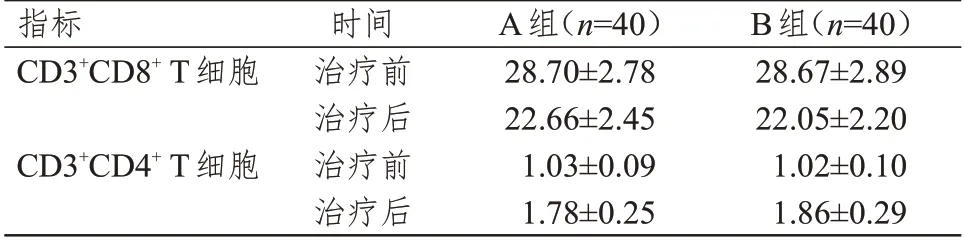
表2 治疗前后两组患者的免疫因子水平(%,±s)
指标CD3+CD8+T细胞CD3+CD4+T细胞时间治疗前治疗后治疗前治疗后A组(n=40)28.70±2.78 22.66±2.45 1.03±0.09 1.78±0.25 B组(n=40)28.67±2.89 22.05±2.20 1.02±0.10 1.86±0.29
2.4 不良反应发生率的比较
治疗期间,A 组患者3 级以上血小板减少、放射性食管炎、放射性肺炎、消化道反应、白细胞减少的发生率均低于B 组,差异均有统计学意义(P<0.05)。(表3)

表3 两组患者3 级以上不良反应发生情况的比较[n(%)]
3 讨论
肺癌是中国恶性肿瘤致死的首要原因,其发生与环境污染、吸烟、遗传、电离辐射等密切相关,其中NSCLC 占80%以上,多数患者就诊时已发展至晚期,5 年生存率较低[6]。对于局部晚期NSCLC 患者,临床中多采用放化疗治疗,以控制肿瘤细胞的转移和扩散,延缓病情发展,使患者的生存期延长。然而,由于局部晚期NSCLC 患者多为中老年群体,生理机能较差,对放化疗的耐受性欠佳,尤其是放疗后易出现放射性肺炎、放射性食管炎、骨髓抑制等不良反应,影响疾病转归[7]。因此,在有效治疗的前提下,保护重要器官,减少不良反应,提高患者的生活质量,将成为首选的临床策略。
机体免疫功能较低与恶性肿瘤的发生、发展密切相关,细胞免疫是T 淋巴细胞介导的重要免疫方式,CD3+CD8+T 细胞与CD3+CD4+T 细胞是机体内不可缺少的T 淋巴细胞,前者属于杀伤性T 细胞,可分化为肿瘤细胞、细胞毒性T 细胞或感染细胞,其水平降低会抑制免疫功能,引起肿瘤细胞免疫逃逸,后者能够生成多种细胞因子,还可以启动免疫应答,发挥抗肿瘤作用。因肿瘤细胞具有较强的抑制机体免疫功能的作用,肿瘤细胞清除后可有效解除免疫抑制。本研究结果显示,两组患者的总有效率比较,差异无统计学意义(P>0.05);治疗后两组患者的CD3+CD8+T 细胞、CD3+CD4+T 细胞水平比较,差异均无统计学意义(P>0.05)。提示3D-CRT、IMRT 均是治疗局部晚期NSCLC 的有效方式,可有效杀灭肿瘤细胞,改善免疫功能,利于病情恢复。本研究中,两组患者的平均剂量比较,差异无统计学意义(P>0.05);而A 组患者的HI、CI 均明显高于B 组(P<0.01),提示IMRT 能够使肿瘤靶区的适形度提高,实现靶区剂量优化。3D-CRT 以多野中心照射,确保高剂量照射区与肿瘤靶区的形状一致而精准杀灭肿瘤细胞,缩小病灶,最终达到治疗目的[8]。PTV 需基于CT 三维重建,形状多不规则,3D-CRT 无法与PTV 高度匹配。IMRT 是利用计算机辅助优化程序,针对靶器官、靶区形状和靶区具体解剖关系对束强度进行调节,对单个辐射野内的剂量分布进行计算,使得高剂量区剂量分布的形状在三维方向上与病变(靶区)形状一致,进而增加HI、CI。本研究中,治疗期间,A 组患者3 级以上血小板减少、放射性食管炎、放射性肺炎、消化道反应、白细胞减少的发生率均低于B 组,差异均有统计学意义(P <0.05)。提示IMRT 的安全性优于3D-CRT。IMRT通过高分辨成像设备结合放疗设备实施治疗,治疗机坐标系与患者坐标系连接,能够精准地确定敏感组织和靶区的运动、位置,使放射靶区的剂量精度进一步提高,精准打击靶区,减少放射性损伤[9]。
综上所述,3D-CRT、IMRT 均是治疗局部晚期NSCLC 的有效方式,但IMRT 能够提高肿瘤靶区的适形度,实现靶区剂量优化,减少不良反应,提高患者的耐受性。

