微小RNA-137 调控乳腺癌细胞生物学行为的作用及机制研究
杨悦,南丁阿比雅思,王萱,李晓梅
哈尔滨医科大学附属肿瘤医院病理科,哈尔滨1500000
乳腺癌是世界范围内女性常见的恶性肿瘤,发病率逐年上升,且趋于年轻化。研究表明,肿瘤相关因子表达异常和功能改变直接影响乳腺癌的发生、发展,这也是目前研究的热点[1-2]。磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)是许多肿瘤最易缺失或突变的基因之一,有研究发现,PTEN 水平下降与乳腺癌侵袭表型及预后不良密切相关[3-4]。微小RNA(microRNA,miRNA)是一类于真核生物中广泛存在的非编码RNA,对靶基因的表达起着重要的调控作用,如对细胞的增殖、凋亡等多种生命活动进行调控。多种miRNA 异常表达于乳腺癌中,对miRNA 在乳腺癌中的功能及作用机制的深入研究有利于更好地认知乳腺癌的发生、发展过程[5]。近年来,miRNA-137与PTEN 关系的研究已相继开展,Mohammad 等[6]在研究中探讨了miRNA-137 通过抑制蛋白激酶B(protein kinase B,PKB,又称AKT)相关信号通路调节PTEN 的过程,发现该调节过程影响了前列腺癌发生、发展过程中H3K4 的去甲基化过程,并对前列腺癌细胞的生物学行为产生了一定的影响。本实验从组织和细胞水平探讨了miRNA-137 通过抑制PTEN 调节磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/AKT 信号通路对乳腺癌生物学行为的调控作用,旨在为寻找乳腺癌诊断及治疗的新靶点提供一定的实验依据,现报道如下。
1 材料与方法
1.1 标本采集
收集2014 年3 月至2018 年1 月哈尔滨医科大学附属肿瘤医院收治的乳腺癌患者的临床资料。纳入标准:术前未接受放疗、化疗、免疫治疗等其他抗肿瘤治疗;经手术病理确诊;临床资料完整。排除标准:合并其他恶性肿瘤;行乳腺假体植入。根据纳入和排除标准,本研究共纳入92 例乳腺癌患者,年龄26~55 岁,平均(49.5±5.7)岁;按照2003年世界卫生组织(WHO)制定的乳腺组织学分级及分类标准[7]对乳腺癌病例HE 染色切片进行病理学分型和分级,其中,普通型浸润性导管癌66 例,混合型癌20 例,浸润性小叶癌6 例;组织学分级:Ⅰ级18 例,Ⅱ级44 例,Ⅲ级30 例。收集92 例乳腺癌患者的乳腺癌组织标本及其癌旁正常组织标本,所有样本均以10%福尔马林固定,常规石蜡包埋,其中,包括远端转移肿瘤组织标本36 例。
1.2 细胞、试剂与仪器
DMEM 培养液、Trizol 试剂盒、实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒、被动裂解液(passive lysis buffer,PLB)、蛋白质印迹法(Western blot)检测试剂盒、Transwell 小室均购自美国Sigma 公司;荧光素酶检测试剂盒购自GeneCopoeia 公司;质粒提取试剂盒购自OMEGA 公司。乳腺上皮细胞MCF-10A 及乳腺癌细胞MCF-7、MDA-MB-231 均购自中国科学院上海生命科学研究院细胞资源中心,由哈尔滨医科大学附属肿瘤医院病理科保存。RM2255 型组织切片机购自北京世贸远东科学仪器有限公司;MK3 型酶标仪购自美国Thermo Lab systems 公司;DHP-9082 型电热恒温培养箱购自上海精宏实验设备有限公司;UV1700 型紫外分光光度计购自日本岛津公司;MiniAmp Plus PCR 仪购自赛默飞世尔科技(中国)有限公司;DYY-6C 型电泳仪购自北京六一仪器厂;JY92-Ⅱ超声波细胞粉碎机购自宁波新芝生物科技公司;JY-SPFT 型核酸电泳成套设备购自大连竞迈生物科技有限公司;JY-SCZ2 型蛋白电泳成套设备购自大连竞迈生物科技有限公司;ELx800 型全自动酶标仪购自美国Bio-Tek 公司;FACS Vantage SE 型流式细胞仪购自美国BD 公司。ImageQuant LAS 500 生物分子成像仪购于美国Cytiva 公司。
1.3 细胞培养与转染
将乳腺上皮细胞MCF-10A 及乳腺癌细胞MCF-7、MDA-MB-231(1×106/ml)分别置于12 孔培养板中,条件设置为37 ℃和5% CO2,置入DMEM培养液中常规培养24 h,经处理后孵育15 min,再于孔板中置入6 h,换液后继续培养24 h,后以同样条件再次转染,继续培养24 h。将3 种样本细胞分别分为空白组(无转染质粒)、miRNA-NC 组(转染无义序列)、miRNA-137 mimics 转染组(转染miRNA-137 mimics)、miRNA-137 mimics+PTEN 转染组(转染miRNA-137 mimics+PTEN)。通过化学合成miRNA-137 特异性模拟物mimics 对乳腺癌细胞进行转染。
1.4 质粒构建与转染
质粒均由病理科保存。利用microRNA 靶基因数据库及生物信息软件对miRNA-137 与靶基因的相互作用进行预测,判断PTEN mRNA 3'UTR 的碱基是否存在miRNA-137 可能互补结合的位点,预测miRNA-137 与PTEN 可能的作用位点位于PTEN 3'UTR 41-47 碱基(5'-ACUUGAA-3')。构建PTEN 野生型3'-UTR 荧光素酶质粒pMIR-WT(WTPTEN)和PTEN 突 变 型 质 粒pMIR- Mut(Mut-PTEN)。
荧光素酶报告基因法检测荧光素酶活性。将pMIR-WT、pMIR-Mut、PTEN 模拟物与miRNA-137 mimics 和对照mimics 共转染MCF-7 细胞,24 h 后去除培养基,以磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞3 次后将其弃净,各孔添加PLB 100 μl,于室温下放置培养板于平板摇床上,微微晃动15 min。细胞裂解后,转移各组中20 μl样本至发光用96 孔板中,同时放置超级酶标仪检测板中,设置自动进样器1、2 分别分装LARⅡ和Stop&Glo 试剂各100 μl。通过1~2 s 延迟、5~10 s读数进行测量。循环操作,直至检测完所有样本,之后将其结果通过酶标仪配套软件进行分析。荧光素酶相对活性=萤火虫荧光素酶活性/海肾荧光素酶活性。质粒构建及转染后基因测序均由上海生工生物工程公司完成。
1.5 qRT-PCR 检测miRNA-137 表达水平
采用qRT-PCR 检测细胞、组织中miRNA-137的表达水平。按照Trizol 试剂盒说明书中步骤提取总RNA,按照反转录试剂盒说明书步骤逆转录总RNA,继而合成cDNA,根据qRT-PCR 试剂盒说明书进行PCR 反应。以Ct 值形式得到qRT-PCR 结果,同时扩增所有样本中靶基因miRNA 和内参U6,反应体系为20 μl。每个样本重复3 次。
1.6 验证蛋白水平
Western blot 检测PTEN、p-AKT 308、p-AKT 473、AKT 蛋白的表达情况:将乳腺癌细胞MCF-7、MDA-MB-231 通过RIPA 细胞裂解液加以裂解,采用BAC 法测量其浓度,通过上样缓冲液调齐细胞浓度,每孔上样40 μg。先以120 V 电压进行电泳,待Marker 到达浓缩胶与分离胶交界处时,将电压转换至150 V,持续至Marker 完全分开。按照Marker 指示,将对应目的蛋白位置的凝胶及GAPDH 相对应的凝胶切下。置蛋白于湿转仪器中,于恒流300 mA 下转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。然后置PVDF 膜于5%封闭液(5%脱脂牛奶)中在37℃下封闭2 h。PTEN 一抗稀释比例为1∶500,p-AKT 308、p-AKT 473、AKT 一抗稀释比例均为1∶1000,将PVDF 膜封闭好,于4 ℃下与一抗孵育过夜。为使蛋白与一抗充分混匀,1 天后,于37 ℃下将其置入摇床中振动2 h,TBST 洗膜4 次,每次8 分钟,将膜与二抗(稀释比例为1∶5000)浸泡,置入摇床于37 ℃下振动1.5 h。根据电化学发光(electrochemiluminescence,ECL)试剂说明书,于Image Quant LAS 500 仪器中检测结果。实验重复3 次。
1.7 验证细胞水平
1.7.1 Transwell 实验检测细胞迁移和侵袭能力
检测乳腺癌细胞MCF-7 和MDA-MB-231 的侵袭能力。将其制成单细胞混悬液,然后接种至Transwell小室上室中。将Transwell 小室底部膜的上室面于50 mg/L Matrigel 采用稀释液(比例为1∶8,无血清培养基)加以包被,4 ℃下风干,将培养板中残余液体吸出,于37 ℃下各孔加入300 μl 无血清培养基,培养30 min。将细胞无血清“饥饿”处理12~24 h 后制备细胞悬液,以去除血清的影响。待消化终止后离心弃去培养液,将其以PBS 清洗1~2 次,同时置于含1%牛血清蛋白(bovine serum albumin,BSA)的无血清培养基中重悬。将细胞密度调整为(1~5)×105/ml,将200 μl 的细胞悬液去除置入Transwell 小室,将500 μl 含胎牛血清(fetal bovine serum,FBS)的培养基加至24 孔板下室中,培养12~49 h,接种细胞后1 h 检查确认无大气泡产生后,用棉签擦去基质胶和上室内的细胞,采用0.1%苏木素-伊红染色。通过倒置显微镜对不同细胞系移至下室的细胞数目进行计数。实验重复3 次。
1.7.2 CCK8 实验检测细胞增殖能力 将无义序列、miRNA-137 mimics、miRNA-137 mimics+PTEN分别转染至低侵袭能力的乳腺癌细胞株MCF-7,将2×103个细胞铺于96 孔板中,分别于0、24、48、72 h 加入CCK8 10 μl,置入37 ℃、5%CO2的培养箱中,4 h 后,通过酶标仪检测450 nm 处的光密度(optical density,OD)值,并绘制生长曲线。实验重复3 次。
1.7.3 划痕实验检测细胞迁移能力 将4×105个细胞(MCF-7、MDA-MB-231)铺置于12 孔板中,后置入37 ℃、5%CO2的培养箱,等细胞过夜贴壁且长满后,用10 μl枪头划痕,除去培养基,PBS清洗数次后加入无血清培养基,分别于0、24 h于相同位置拍照,采用ipwin 32软件分析实验结果。实验重复3次。
1.7.4 流式细胞术检测细胞活力 将10 cm 培养皿的细胞收集,70%乙醇固定,40 ℃下过夜。染色前,重新收集细胞,PBS 重新静置,PI 溶液染色细胞,37 ℃下孵育15 min。采用流式细胞仪获取数据,采用BD FACSuite TM 软件分析数据,检测细胞周期,计算细胞(MCF-7、MDA-MB-231)活力的相对表达水平。实验重复3 次。
1.8 统计学方法
采用SPSS 22.0 软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,组间两两比较采用LSD 法;计数资料以例数或率(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同组织和细胞中miRNA-137表达水平的比较
qRT-PCR 检测结果显示,乳腺癌组织中miRNA-137 的表达水平为(2.91±0.36),明显高于癌旁正常组织的(1.00±0.15),差异有统计学意义(t=41.224,P<0.01)。发生远端转移乳腺癌组织中miRNA-137 的表达水平为(2.19±0.37),明显高于未发生远端转移乳腺癌组织的(1.00±0.12),差异有统计学意义(t=22.365,P<0.01)。乳腺上皮细胞MCF-10A 及乳腺癌细胞MCF-7、MDA-MB-231 中miRNA-137 的表达水平分别为(1.00±0.14)、(1.66±0.20)、(2.85±0.30),3 组比较,差异有统计学意义(F=12.331,P<0.01)。MCF-7、MDA-MB-231 细胞中miRNA-137 的表达水平均明显高于MCF-10A 细胞,差 异 均 有 统 计 学 意 义(t=4.683、9.679,P <0.01)。对于MCF-7 细胞,miRNA-137 mimics 转染组miRNA-137 的表达水平为(6.56±0.10),明显高于miRNA-NC 组的(1.01±0.01),差异有统计学意义(t=95.652,P<0.01)。
2.2 乳腺癌细胞侵袭能力的比较
Transwell 细胞侵袭实验检测结果显示,乳腺癌细胞MDA-MB-231 的侵袭数目为(438.77±14.77)个,明显多于MCF-7 的(176.95±10.79)个,差异有统计学意义(t=24.792,P<0.01)。(图1)
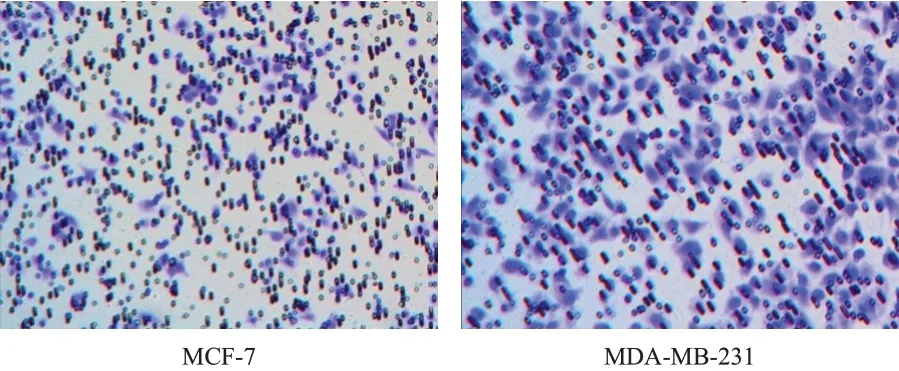
图1 Transwell细胞侵袭实验检测不同乳腺癌细胞的侵袭能力(苏木素-伊红染色,×200)
2.3 miRNA-137 靶向调控PTEN mRNA 的表达
生物信息学软件预测发现,PTEN mRNA 3'UTR 的碱基存在与miRNA-137 可能互补结合的位点,提示PTEN 是miRNA-137 可能作用的靶基因。
2.4 miRNA-137 结合PTEN mRNA 3'UTR 碱基抑制PTEN 的表达
荧光素酶报告基因法检测结果显示,对于WTPTEN 野生型报告基因质粒,miRNA-137 mimics 转染组的荧光素酶活性为(3.95±0.22),明显低于miRNA-NC 组的(6.16±0.07),差异有统计学意义(t=16.580,P<0.01)。对于Mut-PTEN 突变型报告基因质粒,miRNA-137 mimics 转染组的荧光素酶活性为(7.13±0.10),与miRNA-NC 组的(7.01±0.17)比较,差异无统计学意义(P>0.05)。
Western blot检测结果显示,miRNA-137 mimics转染组PTEN 蛋白的相对表达量为(0.60±0.05),明显低于miRNA-NC 对照组的(2.01±0.01),差异有统计学意义(t=47.895,P<0.01)。(图2)
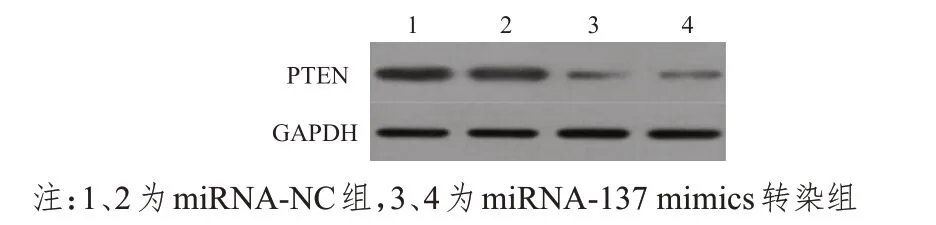
图2 Western blot检测不同组别PTEN蛋白的相对表达量
qRT-PCR 检测结果显示,miRNA-137 mimics转染组PTEN mRNA 的表达水平为(0.39±0.04),明显低于miRNA-NC 组的(1.01±0.01),差异有统计学意义(t=26.045,P<0.01)。
2.5 不同组织和细胞中PTEN mRNA 及蛋白的表达情况
乳腺上皮细胞MCF-10A及乳腺癌细胞MCF-7、MDA-MB-231 中PTEN mRNA 的表达水平分别为(1.00±0.11)、(0.79±0.12)、(0.79±0.12),3 组比较,差异无统计学意义(P>0.05)。乳腺癌组织中PTEN mRNA 的表达水平为(0.47±0.05),明显低于癌旁正常组织的(1.02±0.15),差异有统计学意义(t=23.816,P<0.01)。Western blot 检测结果显示,乳腺癌组织中PTEN 蛋白的相对表达量为(0.47±0.05),明显低于癌旁正常组织的(2.04±0.03),差异有统计学意义(t=102.781,P<0.01)(图3)。
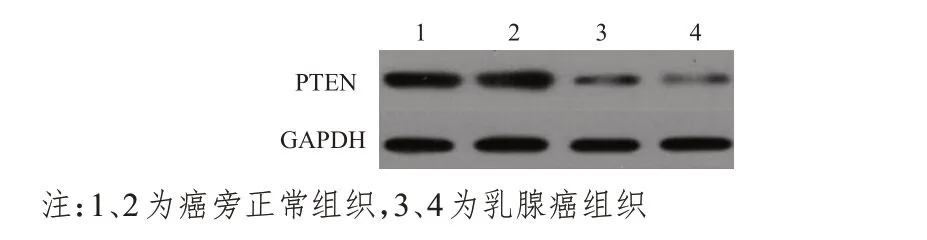
图3 Western blot检测不同组织中PTEN蛋白的相对表达量
2.6 miRNA-137 与PTEN 调控不同侵袭能力乳腺癌细胞的生物学行为
不同组别MCF-7 细胞的OD 值、S 期细胞比值、侵袭细胞数目、迁移细胞数目、细胞迁移距离比较,差 异 均 有 统 计 学 意 义(F=49.345、46.678、221.615、502.389、21.367,P <0.01)。不 同 组 别MDA-MB-231 细胞的OD 值、S 期细胞比值、细胞侵袭数、转移细胞数、细胞迁移距离比较,差异均有统计学意义(F=17.750、126.943、241.52、11.408、39.185,P<0.01)。miRNA-137 mimics 转染组的上述各指标均高于miRNA-NC 组,而miRNA-137 mimics+PTEN 转染组的上述各指标均低于miRNA-137 mimics 转染组,差异均有统计学意义(P<0.05)。(表1、表2)
2.7 miRNA-137 与PTEN 通 过 调 节PI3K/AKT 信号通路调控乳腺癌的生物学行为
Western blot 检测结果显示,不同组别MCF-7细胞中PTEN、p-AKT 308、p-AKT 473 蛋白的表达水平比较,差异均有统计学意义(F=54.188、29.223、54.026,P<0.01);不同组别MCF-7 细胞中AKT 蛋白的表达水平比较,差异无统计学意义(P>0.05)。miRNA-137 mimics 转染组中PTEN、p-AKT 308、p-AKT 473 蛋白的表达水平均高于miRNA-NC 组,差异均有统计学意义(P<0.05);miRNA-137 mimics+PTEN转染组PTEN、p-AKT 308、p-AKT 473 蛋白的表达水平均低于miRNA-137 mimics 转染组,差异均有统计学意义(P<0.05)。(表3、图4)
3 讨论
乳腺癌是女性常见的恶性肿瘤,也是女性恶性肿瘤死因的前三位恶性肿瘤之一[8]。转移是乳腺癌病死率高的主要危险因素。据统计,转移后的病死率居乳腺癌死亡总人数的90%以上[9]。恶性程度、增长速度亦是乳腺癌预后差的危险因素。因此,探索与恶性肿瘤转移及增殖相关的分子标志物对于提高乳腺癌的确诊率以及为患者提供确切、有效的治疗方案至关重要[10]。
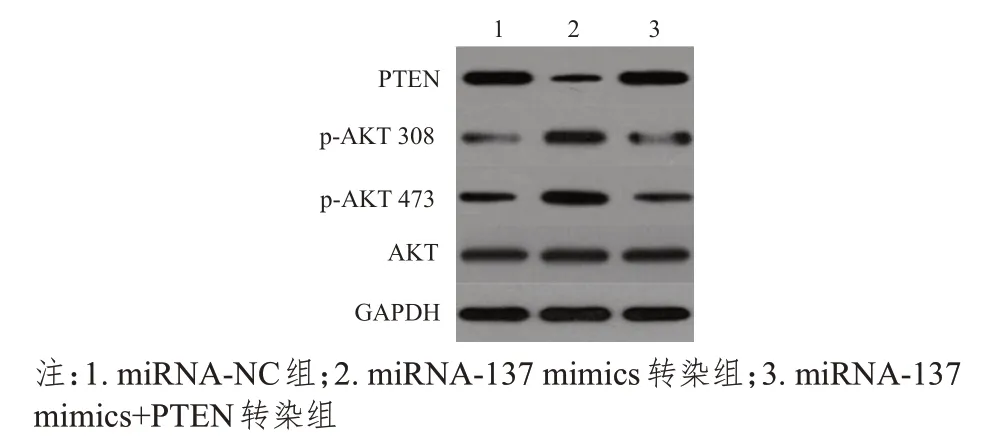
图4 不同组别PTEN、p-AKT308、p-AKT473、AKT蛋白的表达水平
miRNA 属于非编码小RNA 家族,其通过部分序列互补的方式与目标基因mRNA 的3'UTR 区域结合,调节基因的表达。由于其目标蛋白在某些信号通路中的重要功能,miRNA 已成为基因调节的重要目标。多项研究发现,miRNA 可作为抑癌或促癌因素参与肿瘤的发生、发展。研究表明,部分miRNA 的表达异常与乳腺癌的发生、发展有直接的关系[11-15]。Zhang 等[16]研究发现,miRNA-205 可以靶向调节ErbB3、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA),发挥对乳腺癌细胞增长和迁移的抑制作用。Hu等[17]研究发现,miRNA-93 在三阴性乳腺癌中呈高表达。黄秀芳[18]应用miRNA微阵列技术研究了乳腺癌miRNA的差异表达谱,结果发现,miRNA-137、miRNA-497、miRNA-21、miRNA-155 等miRNA 的表达异常可能与乳腺癌的发生、发展密切相关。近年来,miRNA-497、miRNA-21、miRNA-155 等miRNA 与乳腺癌的相关性研究已逐渐成熟,关于miRNA-137 与乳腺癌的研究还未见报道。本研究分别从组织水平和细胞水平探讨了miRNA-137 与乳腺癌细胞之间的关系。
本研究结果显示,乳腺癌组织中的miRNA-137的表达水平明显高于癌旁正常组织,发生远端转移的乳腺癌组织中miRNA-137 的表达水平明显高于未发生转移的乳腺癌组织。可见乳腺癌与miRNA-137 表达异常之间的关系密切。
表1 不同组别MCF-7 细胞OD 值、S 期细胞比值、侵袭细胞数目、迁移细胞数目、细胞迁移距离的比较(±s)
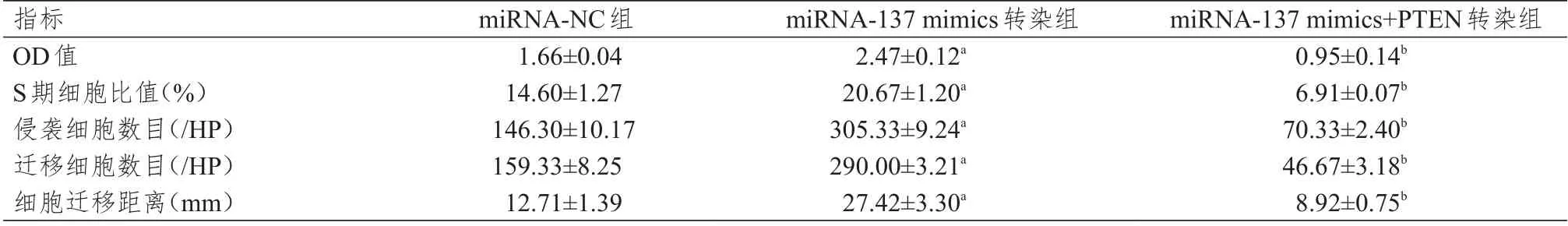
表1 不同组别MCF-7 细胞OD 值、S 期细胞比值、侵袭细胞数目、迁移细胞数目、细胞迁移距离的比较(±s)
注:a与miRNA-NC组比较,P<0.05;b与miRNA-137 mimics转染组比较,P<0.05
指标OD值S期细胞比值(%)侵袭细胞数目(/HP)迁移细胞数目(/HP)细胞迁移距离(mm)miRNA-NC组1.66±0.04 14.60±1.27 146.30±10.17 159.33±8.25 12.71±1.39 miRNA-137 mimics转染组2.47±0.12a 20.67±1.20a 305.33±9.24a 290.00±3.21a 27.42±3.30a miRNA-137 mimics+PTEN转染组0.95±0.14b 6.91±0.07b 70.33±2.40b 46.67±3.18b 8.92±0.75b
表2 不同组别MDA-MB-231 细胞OD 值、S 期细胞比值、侵袭细胞数目、迁移细胞数目、细胞迁移距离的比较(±s)
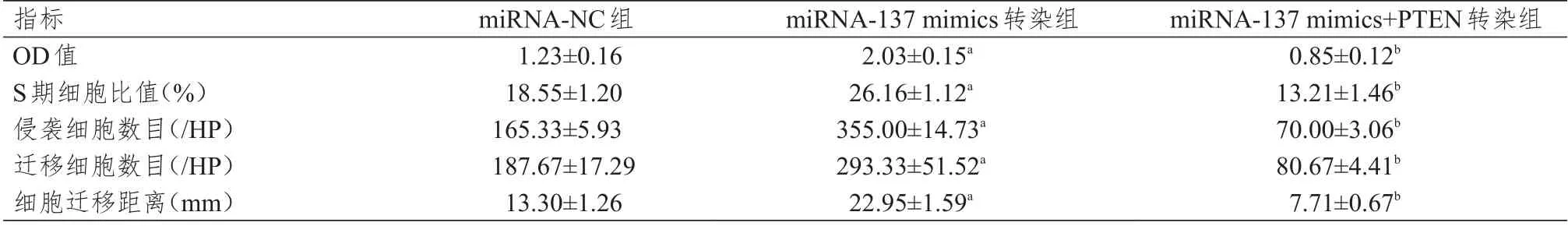
表2 不同组别MDA-MB-231 细胞OD 值、S 期细胞比值、侵袭细胞数目、迁移细胞数目、细胞迁移距离的比较(±s)
注:a与miRNA-NC组比较,P<0.05;b与miRNA-137 mimics转染组比较,P<0.05
指标OD值S期细胞比值(%)侵袭细胞数目(/HP)迁移细胞数目(/HP)细胞迁移距离(mm)miRNA-NC组1.23±0.16 18.55±1.20 165.33±5.93 187.67±17.29 13.30±1.26 miRNA-137 mimics转染组2.03±0.15a 26.16±1.12a 355.00±14.73a 293.33±51.52a 22.95±1.59a miRNA-137 mimics+PTEN转染组0.85±0.12b 13.21±1.46b 70.00±3.06b 80.67±4.41b 7.71±0.67b
表3 不同组别MCF-7 细胞中相关蛋白表达水平的比较(±s)
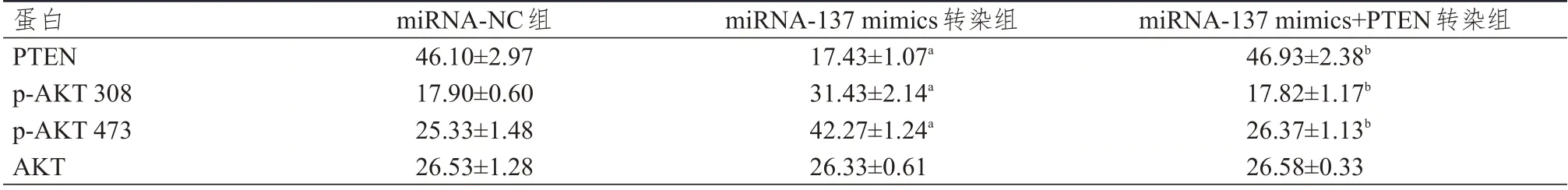
表3 不同组别MCF-7 细胞中相关蛋白表达水平的比较(±s)
注:a与miRNA-NC组比较,P<0.05;b与miRNA-137 mimics转染组比较,P<0.05
蛋白PTEN p-AKT 308 p-AKT 473 AKT miRNA-NC组46.10±2.97 17.90±0.60 25.33±1.48 26.53±1.28 miRNA-137 mimics转染组17.43±1.07a 31.43±2.14a 42.27±1.24a 26.33±0.61 miRNA-137 mimics+PTEN转染组46.93±2.38b 17.82±1.17b 26.37±1.13b 26.58±0.33
PTEN 是一种肿瘤抑制基因,具有抑制细胞周期、诱导细胞凋亡以及抑制肿瘤细胞转移和侵袭等功能,在乳腺癌发病中具有重要作用。研究发现,PTEN 也可作为评价乳腺癌预后的指标,在乳腺癌组织从癌前病变向乳腺癌演变的过程中有重要作用,其表达与乳腺癌患者的淋巴转移情况有关,同时,PTEN 蛋白的低表达可直接影响乳腺癌的发生,其原因可能是PTEN 的功能缺失,降低了其对肿瘤细胞生长及黏附的抑制和调控作用,提高了乳腺癌的发病率[19-21]。本研究也发现,乳腺癌细胞中PTEN mRNA 的表达水平均明显低于乳腺上皮细胞,乳腺癌组织中PTEN mRNA 及蛋白的表达水平明显低于癌旁正常组织,证实了PTEN 对乳腺癌发生、发展的抑制作用。
本研究通过生物信息软件预测发现PTEN mRNA 3'UTR 的碱基存在与miRNA-137 可能互补结合的位点,提示PTEN 是miRNA-137 可能作用的靶基因,miRNA-137 可能通过对PTEN 的抑制作用发挥对乳腺癌细胞的相应生物学作用。本研究通过相应实验也验证了miRNA-137 能够抑制PTEN蛋白的表达。PTEN 的过表达能够抑制miRNA-137 对乳腺癌细胞增殖、侵袭、迁移的促进作用。为了探索miRNA-137 通过抑制PTEN 表达从而调控乳腺癌细胞生物学行为的具体作用机制,本研究将PI3K/AKT 信号通路作为主要研究内容,这是由于PI3K/AKT 信号通路可调控多种恶性肿瘤的发生、进展,如促进肿瘤细胞的生长、增殖及转移等[22-23]。然而,多种miRNA 通过PI3K/AKT 信号通路影响乳腺癌发生、发展的研究已相对成熟[24]。
本研究发现,若上调乳腺癌细胞中miRNA-137 的表达,p-AKT 308、p-AKT 473 蛋白的表达量随之明显升高,而AKT 蛋白的表达量却无明显变化。若将MCF-7 细胞转染miRNA-137 mimics 和PTEN,p-AKT 308、p-AKT 473 蛋白的表达量恢复至原水平,而PTEN 也逆转了miRNA-137 对PI3K/AKT 信号通路的影响。提示miRNA-137 可能通过抑制PTEN 调节PI3K/AKT 信号通路的活性。进一步关于乳腺癌细胞侵袭、迁移、增殖的研究也证实了PI3K/AKT 通路对乳腺癌的调控作用。
综上所述,本研究充分阐述了miRNA-137 对乳腺癌的调控机制,PTEN 对乳腺癌的发生、发展具有抑制作用,而miRNA-137 通过抑制PTEN 的表达促进乳腺癌细胞的增殖、侵袭、迁移,同时通过调节PI3K/AKT 信号通路促进乳腺癌的生物学行为,因此,miRNA-137 有可能成为乳腺癌诊断及治疗的新靶点。

