2型糖尿病脑白质微结构网络拓扑结构改变的相关研究
秦新, 鲁毅, 孙学进
随着人们生活水平的提高及社会老龄化的加剧,糖尿病(diabetes mellitus,DM)已成为危害人类健康的一类重要慢性疾病,且呈现年轻化的趋势。DM主要以2型糖尿病(type 2 diabetes mellitus,T2DM)多见,约占90%以上。同时,糖尿病还会引起包括心脏、视网膜、肾脏、血管和神经系统不同程度的损害。其中,大脑是最易受到损害的部位,往往导致认知障碍和中枢神经系统的病理生理改变,形成糖尿病脑病(diabetic encephalopathy,DE)[1]。DE起病隐匿,进展缓慢,临床上常把糖尿病患者视网膜病变视为糖尿病脑病发生的标志,但此时脑组织及功能往往已经发生较明显改变[2],形成了不可逆的脑结构和功能损伤,预后往往不好。因此,早期发现与诊断,及时恰当的临床干预是改善患者生活质量和保障良好预后的关键[3]。然而,DE主要依靠临床医生根据临床表现作出主观判断,缺乏客观的诊断依据,因此在疾病早期难以作出准确诊断。以扩散张量成像(diffusion tensor imaging,DTI)为代表的MRI新技术为探讨T2DM患者早期脑结构功能改变提供了可能。本文试图通过DTI技术探究T2DM患者脑白质结构网络拓扑结构的改变,探讨糖尿病脑病的发生发展机制,为预测糖尿病脑病的发生和发展提供一些客观依据。
材料与方法
1.研究对象
选取2017年9月-2018年9月就诊于本院内分泌科的门诊及住院患者,具有完整临床资料、病程为5~20年的T2DM患者50例,选取年龄、性别、教育年限等条件相匹配的健康对照组(Healthy Controls,HCs)志愿者35例,搜集必要的临床资料。T2DM诊断标准参照美国糖尿病协会2013年制定的糖尿病诊断和分类标准[4]。
病例排除标准:①头部常规T2WI发现病变(如外伤、脑梗、肿瘤等)明显小血管病变(如腔隙性梗死灶)者;②患有及曾经患有癫痫等神经精神性疾病者;③有磁共振检查禁忌(如体内磁性金属植入物、幽闭恐惧症等)者;④头颅MRI图像伪影严重,影响后续脑白质网络后处理分析者。
最终筛选出图像质量较好,病程为5~20年的30例2型糖尿病患者,其中男21例,女9例,年龄(52.4±5.5)岁,教育年限(10.30±3.5)年),病程5~10年(不含)11例,10~15年(不含)11例,15~20年(含)8例。同时选取相匹配的25例正常志愿者作为健康对照(HCs)组,其中男14例,女11例,年龄(50.0±6.0)岁,教育年限(10.96±4.0)年(表1)。所有受试者均为右利手,没有严重或急性疾病治疗的医疗记录。本研究已获得昆明医科大学伦理委员会批准,所有参与者均对参与的研究知情并签署知情同意书。
2.检查方法
所有被试者均在3.0T磁共振下进行头颅扫描,采用16通道头部线圈,扫描时嘱被试者闭眼,尽量保持静息不思考状态。轴位扫描线平行于前后联合连线。扫描序列及参数如下:①高分辨率Ax FSPGR BRAVO(3D T1)序列,TR 8.7 ms,TE 3.2 ms,矩阵256×256,视野256 mm×256 mm,激励次数1.0,层厚1.0 mm,层间距0 mm,翻转角12°, 156层,扫描时间4 min 23 s;②DTI序列,TR 9359 ms,TE 78 ms,矩阵115×115,视野240 mm×240 mm,激励次数1.0,层厚2.5 mm,层间距0 mm,b值=0、1000 s/mm2,扩散方向64,60层,扫描时间13 min 55 s;③轴面T2WI(用来排除脑实质内有病变的参与者),TR 4255 ms,TE 120 ms,矩阵225×225,视野240 mm×240 mm,激励次数1.5,层厚6 mm,层间距2 mm,翻转角15°,16层,扫描时间55 s。
3.脑结构网络的分析方法
在本研究中,脑结构网络的构建使用PANDA软件(version 1.3.1)进行处理[5](http://www.nitrc.org/projects/panda/)。该软件主要由Diffusion Toolkit[6]、FMRIB软件库[7]、MRIcron[8]、MATLAB的流程系统(PSOM)[9]几部分构成。
DTI图像预处理。①数据转换:使用MRIcron软件的dcm2nii工具包将DICOM文件转化为NIFTI文件;②去除头皮:使用PANDA软件将头皮等非脑组织去除;③纠正伪影:使用PANDA软件仿射变换来纠正涡流引起的扭曲和简单头部运动产生的伪影。
网络节点(Node)的定义:本研究采用加拿大蒙特利尔神经研究所(Montreal Neurological Institute,MNI)的解剖学自动标记(anatomical automatic labeling,AAL)模板[10]将预处理后的大脑皮层和皮质下灰质结构自动分割为90个区域,并把每个脑区定义为一个节点(Node)。
网络的边(Edge)的定义:在构建大脑结构网络时,网络的边(Edge)的选取也至关重要。网络的边即大脑区域的成对网络连接,其依赖不同模态的成像技术。本研究主要是通过确定性追踪算法得到各脑区间的白质纤维束,根据局部扩散张量方向等相关信息追踪下一体素的确定方向,直到满足终止条件(FA<0.2)。利用任意两个脑区间的白质纤维束的纤维束数量(fiber number,FN)作为各节点间的结构连接,从而得到脑结构网络的边(Edge)。
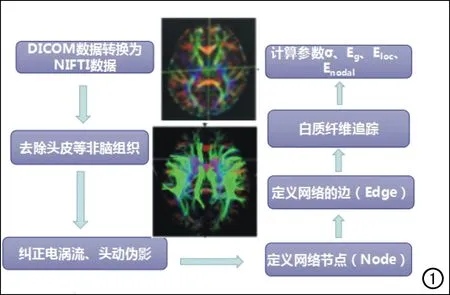
图1 本研究被试者DTI数据处理方法及步骤示意图。
脑结构网络属性参数分析:脑结构网络的构建需要依靠扩散张量成像的白质纤维追踪技术,本研究主要采用基于张量域纤维追踪算法(如Streamlines Tractography)来进行纤维束的追踪[11-13]。采用Diffusion Toolkit软件库(http://trackvis.org/dtk/)中的dti_recon和dti_tracker命令[14],以大脑白质内每个定义的脑区/网络节点区域中所有体素作为种子点,同时采用纤维束连续跟踪算法(fiber assignmentby continuous tracking,FACT)来对全脑白质纤维束的走行进行追踪[15]。根据既往研究及经验,将起始点的FA值范围设定为0.2~1.0,并将纤维束追踪的夹角限制在45°[16]。
利用上述追踪方法获得脑白质纤维束后,再采用PANDA软件计算出以90个脑区为节点(Node),节点间纤维束数量(FN)为边(Edge)所构成的(90×90)矩阵。
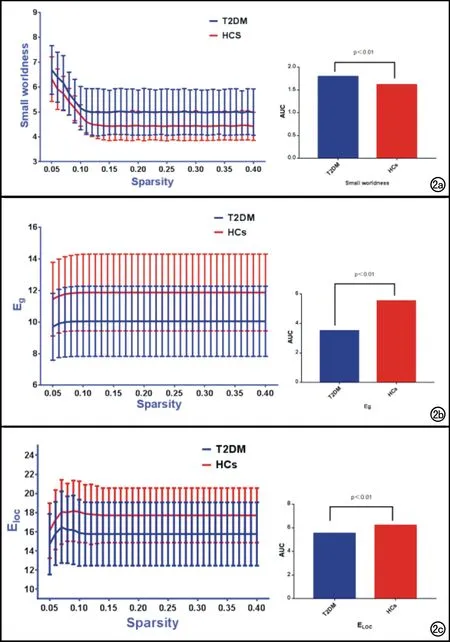
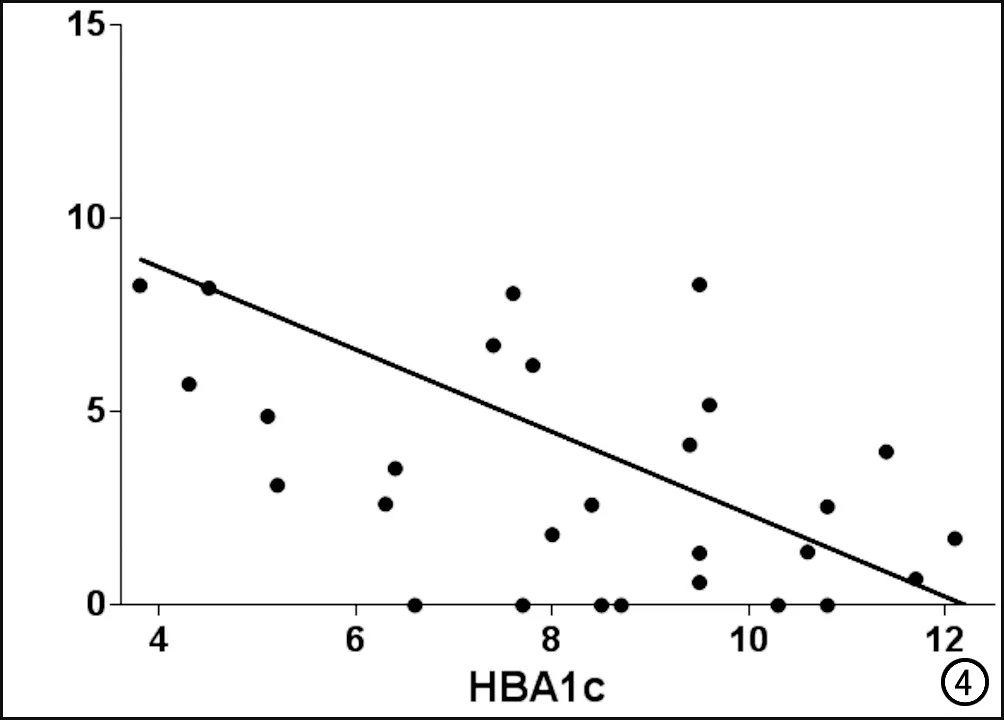
脑结构网络属性参数:构建完脑结构网络以后,再使用Matlab 2013b平台下的Gretna软件包(http://www.nitrc.org/projects/gretna/)对脑结构网络进行图论分析。同时,结合既往研究,将网络稀疏度(sparsity)的阈值(Sthr)设定为0.05 通过图论分析,计算脑结构网络的“小世界”网络属性(σ)、全局网络属性[全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)]及局部网络属性[节点效率(nodal efficiency,Enodal)],数据处理方法及步骤见图1。 全局网络特性参数:“小世界”网络属性(σ):在大脑中,小世界网络代表大脑“整合”与“分离”功能的能力,即信息的加工和处理能力。如果其参数值σ>1 ,说明网络具有小世界网络属性,并且σ值越大,其小世界网络属性越强[18]。其计算公式如下: (1) 其中,C表示聚类系数,L表示特殊路径长度,无下标的代表真实网络,带“r”下标的代表随机网络。 全局效率(Eg):表示所有节点的全局效率的平均值,用来衡量网络全局的信息传输能力,反映了网络中某一节点的信息到达另一节点最短路径长度的平均值。网络全局效率越高,则整个网络范围内节点间的信息传递的速率就越快。其计算公式如下[19]: (2) 其中dij代表网络中某一节点i到另一节点j的最短路径长度,N代表网络中节点数目,N(N-1)/2为节点在网络中的最大连接边数。 局部效率(Eloc):表示所有节点的局部效率的平均值,用来衡量网络局部的信息传输能力,同理,网络局部效率越高,则局部网络范围内信息传递的速率就越快。其计算公式如下[20]: (3) 其中NGi是子图G中的节点数,Lj,k代表网络中某一节点j到另一节点k的最短路径长度。 局部网络特性指标:节点的局部效率(Enodal):用来衡量网络的集团化程度,是某一节点与其他节点之间距离倒数之和的平均值,节点的效率越高则该节点的信息传输能力就越强,其在网络中的地位也越重要[19],则该节点的局部效率越高[21]。计算公式如下[20]: (4) 其中Lij代表网络中某一节点i到另一节点j的最短路径长度;N代表网络中节点数目。 脑结构网络属性参数的统计分析:首先观察T2DM患者组及对照组是否存在“小世界”网络属性(σ>1),然后采用Gretna软件分别比较T2DM患者组与对照组之间全局及局部的网络属性值之间差异是否存在统计学意义(取P<0.05,FDR校正),这些属性值包括Eg、Eloc及Enodal,并以相关临床资料[包括病程、体重指数(body mass index,BMI)、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(HBA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)]作为协变量,计算各网络属性参数与上述临床指标之间是否存在相关性。 网络连接(Egde)的统计:采用基于网络的统计分析软件(The network-based statistic,NBS)(http://www.nitrc.org/projects/nbs)来分析T2DM患者组与健康对照组之间大脑脑区之间的网络连接差异是否存在统计学意义。采用独立双样本t检验对被试者每个网络连接(Edge)进行分别计算。计算时,为了评估被试者每个子网络是否存在统计学差异,采用非参数置换检验(5000次置换),选取P<0.05,并采用FWE矫正。网络连接的复合属性的统计结果均采用BrainNet Viewer软件(http://www.nitrc.org /projects/bnv)来显示。 两组被试者临床数据信息均使用SPSS 22.0软件进行分析,性别差异的组间比较进行皮尔森卡方检验;年龄、教育年限的组间比较则采用双样本独立t检验。两组被试者的年龄(P=0.141)、性别(P=0.283)及教育年限(P=0.528)差异均无统计学意义(表1)。 表1 T2DM患者组与健康对照组的临床资料比较 注:对连续性变量采用非成组t检验进行统计,对性别差异则采用皮尔森卡方检验;*为χ2值。 T2DM患者组及健康对照(HCs)组均表现出“小世界”网络属性(σ),其中T2DM组σ=1.80±0.32, HCs组σ=1.61±0.19。统计学分析结果显示,两组被试者在“小世界”网络属性(σ,FDR校正,t=2.507,P<0.05)、全局网络效率(Eg,t=-2.846,P<0.05)及局部网络效率(Eloc,t=-2.246,P<0.05)上均表现不同,差异具有统计学意义,且在稀疏度为0.05~0.10的范围内时,小世界属性σ值随稀疏度的增加而减小(图2)。 NBS软件分析结果显示,与健康对照(HCs)组相比,T2DM患者组存在着网络复合属性显著降低的子网络,主要由九条边(Edge)和十一个节点(Node)组成(t=-3.41~-2.23,P<0.05,NBS校正)。这个子网络主要包括双侧额上回前部(ORBsup.L、ORBsup.R)、双侧背外侧额上回(SFGdor.L、SFGdor.R)、左内侧额上回(SFGMed.L)、右侧中扣带和扣带旁回(DCG.R)、左侧额中回(MFG.L)、左侧嗅皮质(OLF.L)、左侧尾状核(CAU.L)、左侧脑岛(INS.L)、左侧中央前回(PreCG.L)(图3)。 本研究将T2DM患者组的异常脑结构网络连接的全局和局部网络相关特征性指标与临床相关指标(包括病程、BMI、FPG、HBA1c、TC、TG)进行了相关性分析;结果显示,在进行FDR校正并去除年龄、性别等因素后,左侧额中回(MFG.L)的局部效率Eloc值与糖化血红蛋白(HBA1c)值呈负相关(r=-0.433,P=0.017,图4)。 本研究探讨了T2DM患者脑功能连接网络的拓扑结构,结果显示T2DM患者组与健康对照组(HCs)之间脑结构网络均具有小世界属性,但T2DM组的小世界属性值σ较HCs组升高,差异有统计学意义;且在稀疏度为0.05~010(0.01步长)的范围内时,σ值随稀疏度值的增加而减小。 人脑结构网络中,小世界属性反映的是大脑功能的分离与整合的能力,且其参数σ值越大,代表其上述两种能力越强,越能说明大脑功能分离与整合功能之间的平衡。按照这个理论,本研究中T2DM患者组σ值的增大,表明T2DM患者大脑两种属性(分离与整合)的平衡性增强,这种提法有待商榷,因为T2DM造成的是脑结构网络的破坏,应该是打破了两种属性的平衡,造成σ值降低。既往有学者解释出现这一现象的原因可能是纳入研究的患者大脑功能连接处于代偿阶段,造成了大脑分离与整合的平衡性暂时性增强[22];但本研究中的其他指标(Eg和Eloc)反映了T2DM患者大脑的连接功能较HCs是降低的,这无法用代偿来解释。因此,至于T2DM患者小世界属性σ值到底是增加还是减小以及其变化代表的意义,需要更大样本量及更多研究来探究。 对于其他全局网络特征性指标,如Eg和Eloc ,T2DM组较HCs组也有不同程度的减低,说明了T2DM组脑结构网络的全局及局部传递效率受到影响,显示出较HCs组的明显下降,这可能与T2DM患者糖尿病脑病形成的神经病理机制有关。 图2 T2DM患者组与健康对照(HCs)组之间全局网络特性指标的改变。T2DM组与HCs组在“小世界”网络属性、全局网络效率(Eg)、局部网络效率(Eloc)值及曲线下面积(AUC)均表现出不同,差异均具有统计学意义。a)“小世界”网络属性;b)全局网络效率(Eg);c)局部网络效率(Eloc)。 本研究发现,T2DM组在左侧嗅皮质(OLF.L)区域的脑网络结构连接较HCs组减低,差异具有统计学意义。嗅皮质位于海马区,该区域对于记忆特别是短时记忆的形成至关重要,海马是大脑功能网络连接主要的中转站,与多个脑区存在结构连接和功能连接[23-25]。相关病理学研究证实,内嗅皮质是阿尔兹海默病(Alzheimer disease,AD)最先累及的脑区。同时,Van Bussel等[23]研究指出,海马与其他脑区(如额叶、颞叶)脑网络连接的减低,导致了T2DM患者认知和记忆功能的降低,而非海马自身微结构损害造成的。海马与颞叶脑结构网络的降低,导致T2DM患者记忆力的下降和损害。本研究发现海马区脑结构网络连接的降低,验证和提示了上述结论。由此可见,T2DM引起的记忆方面的损害,可能是海马区本身大脑微结构网络的损害与其他记忆相关脑区(如颞叶)网络连接降低共同造成的,后者可能为主要因素。 本研究还发现T2DM患者在包括双侧额上回眶部(ORBsup.L,ORBsup.R)、双侧背外侧额上回(SFGdor.L,SFGdor.R)、左侧内侧额上回(SFGMed.L)、左侧额中回(MFG.L)、左侧中央前回(PreCG.L)等额叶脑结构网络连接均存在连接度的明显减低和异常。上文已提及,海马与多个脑区存在结构连接和功能连接,其中与额叶的功能连接,与人体认知功能相关[26]。额叶的主要功能是控制随意运动、语言、情感和智能,并与内脏活动和共济运动有关,并参与注意力对感觉信息处理相关神经活动的调控[27],上述发生改变的区域主要集中在额叶前部,这一区域主要与人的精神、情感、人格行为及智能障碍有关,文献报道糖尿病患者的认知功能损害是糖尿病在中枢神经系统的常见并发症[28],先前研究发现早期额叶轻度脑白质病变与多项认知功能损伤相关,包括整体认知功能、执行功能和情景记忆功能等[29]。本研究结果显示T2DM患者海马区及额叶脑结构网络连接度均较Hcs组发生了改变,提示T2DM对大脑结构网络连接造成了损害,且这种损害可能与患者认知功能障碍相关,其机制可能与海马同额叶这一影响认知功能的主要脑区之间的功能连接降低有关。先前的动物及人脑MRI研究发现额叶皮层与包括下丘脑、杏仁核、脑干等在内的多个脑区之间存在功能连接[30-32],而额叶脑结构网络的损害,会影响其与上述脑区的功能连接,从而间接影响下丘脑等脑区在能量平衡控制中的作用,减弱下丘脑对摄食行为的调节,造成T2DM患者饮食控制不佳,从而引起血糖紊乱。由此,笔者推测T2DM不仅会造成额叶脑结构网络的直接损害,导致与其相关的认知功能及精神症状的损害和出现,还影响额叶与其他脑区的功能连接,从而引起一系列其他问题,如血糖紊乱、记忆力损害等。 图3 与HCs组相比,T2DM患者组表现出网络复合属性降低(P<0.05)的子网络。其中红色圆球代表网络节点,为各个脑区,绿色连线代表网络连接(边)。ORBsup.L=左侧额上回眶部;ORBsup.R=右侧额上回眶部;SFGdor.L=左侧背外侧额上回;SFGdor.R=右侧背外侧额上回;SFGMed.L=左侧内侧额上回;DCG.R=右侧中扣带和扣带旁回;MFG.L=左侧额中回;OLF.L=左侧嗅皮质;CAU.L=左侧尾状核;INS.L=左侧脑岛;PreCG.L=左侧中央前回。 值得指出的是,上述脑结构网络改变的区域,大多属于皮层奖赏结构,包括额叶眶回、嗅皮质、脑岛及海马旁回[33],相关研究发现T2DM患者双侧皮层奖赏系统的体积较正常对照组下降,尤以左侧岛叶存在统计学差异,并提出T2DM皮层结构奖赏系统结构的变化影响了患者的饮食行为,从而引起体内血糖代谢及调节的紊乱[34]。由此可见,上述脑结构网络发生改变的脑区,除了自身结构网络改变对大脑造成损伤外,还可能由于彼此间脑结构网络功能和结构连接的减低,共同导致了T2DM患者记忆力减退、情感精神障碍、血糖代谢及调节异常等病理过程,造成T2DM患者多系统的损害。 本研究将T2DM患者异常脑结构网络连接(边)的相关指标与临床相关指标的相关性进行了分析,结果显示左侧额中回(MFG.L)的全局属性Eloc值与血清糖化血红蛋白(HBA1c)值呈负相关。 左侧额中回负责信息的整合及认知资源的配置,可被看作控制脑区[26],苏艳华[35]借助fMRI及事件相关电位(event-related potential,ERP)技术进行研究,结果提示限制性饮食者在面对美食诱惑时,左侧额中回抑制和控制能力减弱是导致过度进食现象的原因。本研究结果显示T2DM患者左侧额中回脑结构网络损害的Eloc值降低,且与HBA1c值呈负相关,提示左侧额中回脑结构网络的损害可能造成了T2DM患者摄食行为控制能力的减弱,引起血糖控制不佳,影响体内糖代谢的平衡。此外有学者认为额叶皮层与下丘脑区的功能连接参与体内能量的平衡及摄食行为的调节,额叶脑结构的损害,破坏了上述功能连接,从而影响了血糖的平衡[36]。由此可见,T2DM患者血糖代谢的紊乱,可能与额叶本身(如左侧额中回)损害及额叶与其他脑区间的功能连接减弱(如下丘脑)两方面因素有关,这也进一步证实了前述结论。 图4 T2DM患者左侧额中回(MFG.L)Eloc值与糖化血红蛋白(HBA1c)值之间呈负相关(r=-0.433,P=0.017)。 本研究是初步研究,存在以下局限性:①本研究未进行认知功能、记忆功能方面的评估,因此对于T2DM对脑结构网络的破坏与认知功能、记忆功能损害之间的相关性无法评估,导致研究结果较局限;②本研究T2DM组患者病程跨度较大,对脑结构网络的损害范围和程度不同,可能对结果产生一定影响;③本研究仅涉及大脑,既往研究指出T2DM患者在中脑及小脑也存在脑网络结构的改变,可见中脑及小脑也是一个研究方向。未来的研究中,我们需要加入被试者认知及记忆等相关方面的评估,缩小被试者病程跨度,或按病程进行分组,进行组间对比分析,同时,可以研究中脑及小脑结构网络的改变,进一步阐释和丰富T2DM患者脑结构网络改变的特征性。 综上所述,本研究通过基于脑结构网络的统计分析(NBS)和图论分析相结合的方法,发现T2DM患者在小世界属性及多个脑区白质网络结构较正常对照组发生了改变,这些改变影响了大脑网络处理信息的能力及效率。此外,某些脑区(左侧额中回)脑网络结构的损害还可能与T2DM患者血糖代谢紊乱有关。4.脑结构网络特性参数
5.统计学分析
结 果
1.受试者一般情况和临床信息
2.T2DM患者网络属性的改变
3.T2DM患者网络连接(边)的改变
4.T2DM患者异常脑结构网络连接(边)的相关指标改变与临床相关指标的相关性分析
讨 论
1.T2DM患者小世界属性的改变
2.T2DM患者网络连接的改变

3.T2DM患者异常脑结构网络连接(边)的相关指标改变与临床相关指标的相关性分析
4.本研究的局限性

