新型1-取代-2-(1′,3′-二氧五环-4′-基)苯并咪唑的合成
吕 松, 李伟光, 袁 斌
(广东工业大学 环境科学与工程学院,广东 广州 510006)
苯并咪唑是多种化工和医药原料的重要中间体,其衍生物具有多种生物活性,如抗艾滋病、抗癌、消炎、抗菌、抗氧化、抗高血压和抗凝血作用等[1-5]。此外,该类化合物还可用作多种金属的缓蚀剂[6-8]。目前,苯并咪唑类化合物的常用合成方法为:以有机羧酸和邻苯二胺及其衍生物为原料,经酰胺化-环化反应合成。
工业上在地沟油水解制备高级脂肪酸时[9],会产生大量的甘油副产品。为提高地沟油综合利用水平,以地沟油水解副产物甘油为原料制备相应有机羧酸,进而合成出苯并咪唑类化合物具有显著的经济价值。
本文以地沟油水解副产物甘油和多聚甲醛为原料,经醇醛缩合和次氯酸钠催化氧化反应制得1,3-二氧杂环戊-4-酸(2);2与邻苯二胺或其衍生物进行酰胺化-环化反应高效地合成了3种新型的1-取代-2-(1′,3′-二氧五环-4′-基)苯并咪唑类化合物(3~5),其结构经UV-Vis,1H NMR,13C NMR, IR和GC-MS表征。
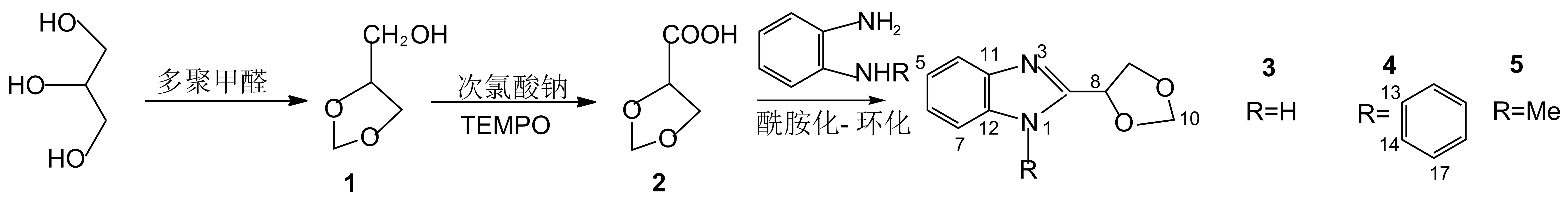
Scheme 1
1 实验部分
1.1 仪器与试剂
XT5B型熔点仪;Cary 100 UV-Vis型紫外可见光分析仪;Bruker AVANCE III 600 MHz型核磁共振仪[(CD3)2SO为溶剂,TMS为内标];Thermo Fisher Nicolet 6700型傅里叶变换红外光谱仪(涂膜或KBr压片);Perkin Elmer 2400Ⅱ型元素分析仪。
甘油,工业级,广州某化工厂;其余所用试剂均为分析纯。
1.2 合成
(1)2的合成[10]
在反应瓶中依次加入甘油缩甲醛混合物5.2 g(0.05 mol), 2,2,6,6-四甲基哌啶氧化物(TEMPO)0.078 g(0.499 mmol)、溴化钠1.0 g(9.72 mmol)和二氯甲烷10~15 mL,在0 ℃下,搅拌下缓慢滴加14.5%次氯酸钠溶液37.0 g,滴毕(控制反应液pH≈10.0),反应4h。加入无水乙醇15 mL,静置分层,水相旋蒸除水,残余物用二氯甲烷50 mL溶解,过滤,滤液用去离子水(2×100 mL)萃取,合并萃取液,用10%盐酸调至pH 2~3,旋蒸除溶,残余物加入无水乙醇40 mL,充分搅拌20 min。静置,过滤,滤饼用无水乙醇20 mL洗涤,旋蒸除溶,残余物加入丙酮20 mL,充分搅拌,过滤,滤液再次旋蒸得无色黏稠液体1,3-二氧杂环戊-4-酸2.26 g,产率39.7%; IRν: 3373.0, 2891.3, 1743.0, 1212.3, 1094.1 cm-1; Anal. calcd for C4H6O4: C 48.04, H6.05, found C48.10, H 6.09。
(2)3~5的合成通法
将21.18 g(0.01 mol)、 98%邻苯二胺(或N-取代邻苯二胺)和二甲苯20 mL加入150 mL三口烧瓶中,氮气保护,搅拌下回流反应4~6 h。升温至环化温度,反应12~16 h。冷却至室温,减压蒸除低沸物,残余物用去离子水溶解,用三氯甲烷(3×30 mL)萃取,合并有机相得化合物3~5。
2-(1′,3′-二氧五环-4′-基)苯并咪唑(3): 褐色固体,收率82%, m.p.95~97 ℃;1H NMRδ: 8.41(s, 1H, 1-H), 7.61~7.78(m, 2H, 4,7-H), 7.16~7.52(m, 2H, 5,6-H), 5.76(s, 2H, 10-H), 4.50(t,J=6.0 Hz, 1H, 8-H), 2.64(d,J=1.2 Hz, 2H, 9-H);13C NMRδ: 151.72(C2), 142.16(C11), 135.28(C12), 122.76(C6), 119.54(C7), 115.66(C5), 114.55(C4), 48.82(C10), 42.39(C8), 13.91(C9); IRν: 3395(NH), 3055(CH2), 1618(C=C), 1496(C=N), 1270(C—O—C), 741(C6H4) cm-1; UV-Vis(EtOH)λ: 210, 245 nm; Anal. calcd for C10H10N2O2: C 63.15, H 5.30, N 14.73, found C 63.20, H 5.27, N 14.64。
1-N-苯基-2-(1′,3′-二氧五环-4′-基)苯并咪唑(4): 黑褐色黏稠液体,收率73%;1H NMRδ: 7.50~7.86(m, 4H, C6H4), 7.39~7.14(m, 5H, C6H5), 4.58(t,J=1.2 Hz, 1H, 8-H), 4.23 (t,J=7.5 Hz, 2H,9-H), 2.43(s, 2H, 10-H);13C NMRδ: 146.49(C2), 136.75(C12), 130.55(C11), 128.25(C4), 127.57(C7), 123.97(C5), 122.90(C6), 120.45(C13), 118.91(C14), 116.93(C15), 115.65(C16), 114.91(C17), 111.15(C18), 67.96(C10), 65.56(C8), 14.61(C9); IRν: 2923(CH2), 1666(C=C), 1595(C=C), 1498(C=N), 745(C6H4) cm-1; UV-Vis(EtOH)λ: 211, 245 nm; Anal. calcd for C16H14N2O2: C 72.16, H 5.30, N 10.52, found C 72.11, H 5.29, N 10.61。
1-N-甲基-2-(1′,3′-二氧五环-4′-基)苯并咪唑(5): 褐色粘稠液体,收率65%;1H NMRδ: 7.62~7.75(m, 2H, 4,7-H), 7.37~7.40(m, 2H, 5,6-H), 3.99(d,J=2.3 Hz, 1H, 8-H), 3.88(t,J=1.2Hz, 2H, 9-H), 2.87(s, 2H, 10-H), 2.72(s, 3H, 13-H);13C NMRδ: 152.51(C2), 134.05(C12), 126.25(C13), 124.45(C4), 123.22(C7), 122.65(C5), 115.74(C6), 32.11(C8), 31.50(C10), 30.95(C11), 12.64(C9); IRν: 2924(CH2), 1619(C=C), 1530(C=C), 1460(C=N), 748(C6H4) cm-1; UV-Vis(EtOH) λ: 210, 245 nm; Anal. calcd for C11H12N2O2: C 64.69, H 5.92, N 13.72, found C 64.65, H 5.89, N 13.69。
2 结果与讨论
2.1 合成工艺优化
表1为合成中间体(2)的正交实验结果。由表1的极差分析结果可知:各因素对2的影响次序为:氧化时间>NaBr用量>TEMPO用量>氧化温度。综合考虑各因素的影响,确定合成2的最佳条件为:催化剂TEMPO用量为甘油缩甲醛用量的1.5%,氧化温度为0 ℃,氧化时间为4 h, NaBr用量为1.0 g。

表1 合成2的正交实验结果
表2为合成化合物4的正交实验结果。从表2可见,各因素对化合物4合成的影响次序为:酸胺原料比>环化温度>环化时间>酰化时间。综合考虑各因素的影响,确定合成4的最佳条件为:酸胺原料摩尔比为1/1,环化温度为200 ℃,环化时间为16 h,酰化时间为6 h。

表2 化合物4的正交实验结果*
*缓蚀实验条件:Q235碳钢,实验温度60 ℃,腐蚀介质为5%盐酸,腐蚀时间为6 h,药剂量为60 mg·L-1。
3~5结构相似,合成条件基本相同。表3为合成3~5的正交实验结果。

表3 三种苯并咪唑最佳合成工艺条件
2.2 表征
(1) IR
由3~5的IR谱图可知,2923~3055 cm-1处特征峰为饱和C—H键伸缩振动吸收峰,1450~1620 cm-1处特征峰为苯环和咪唑啉环骨架的吸收峰,741~748 cm-1处特征峰为邻二取代苯的C—H键面外弯曲振动吸收峰。
(2) UV-Vis
图3为3~5的UV-Vis谱图。从图3可见,化合物在210 nm和245 nm处出现了苯并咪唑环结构的特征吸收峰[12],与邻苯二胺的最大紫外吸收波长254 nm有显著区别,说明邻苯二胺参与了合成反应。
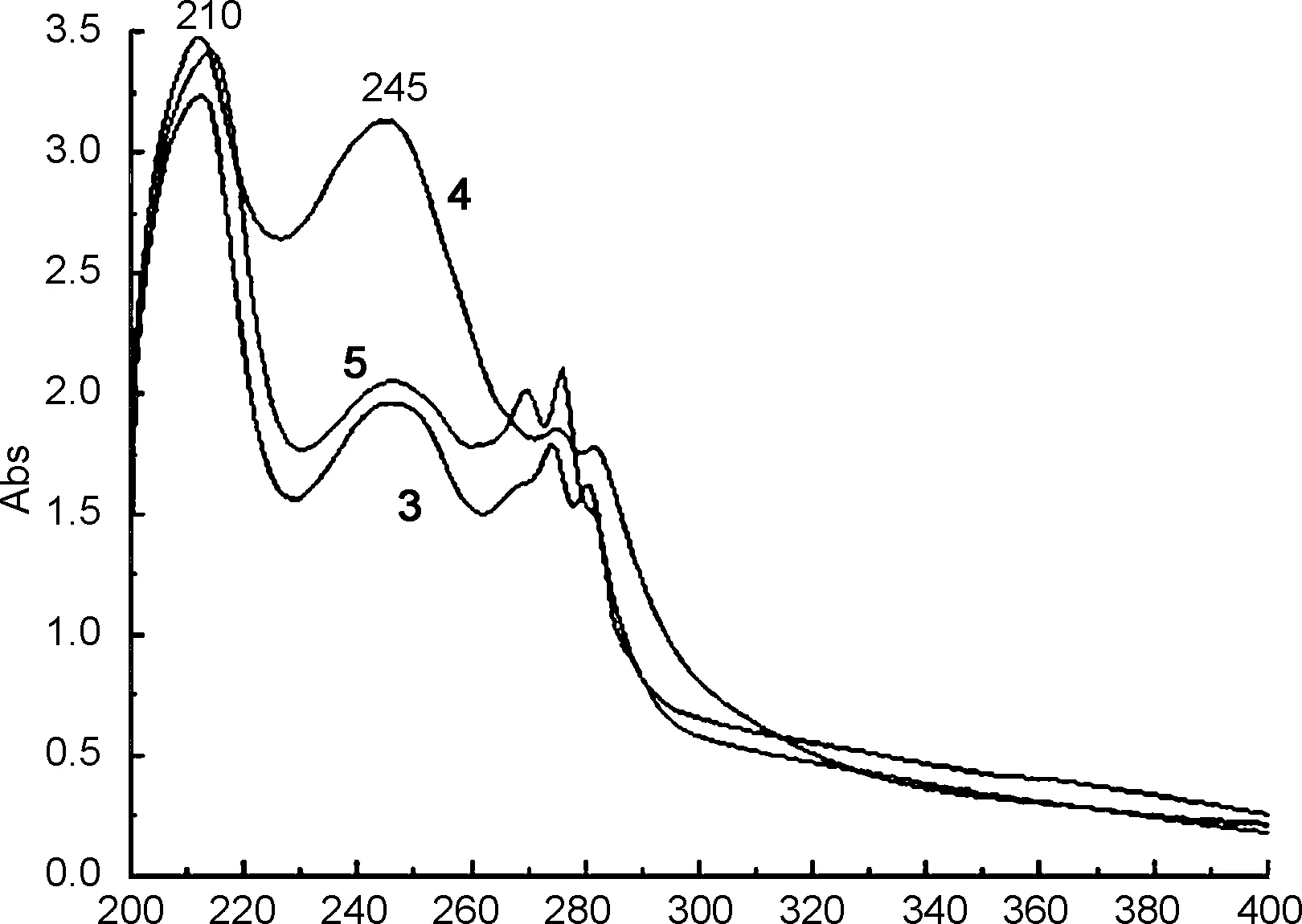
λ/nm
以地沟油水解副产物甘油和多聚甲醛为原料,高效合成了3种新型的1-取代-2-(1′,3′-二氧五环-4′-基)苯并咪唑类化合物(3~5)。3~5表现出较好的缓蚀特性,有望用于腐蚀防护。

