酱香型白酒中非乙醇类物质抗炎活性研究
曹会,刘杰,刘志刚
(深圳大学 过敏反应与免疫学研究所,广东深圳518055)
白酒是以粮食、谷物为主要原料,经发酵、蒸馏等工序制得的蒸馏酒[1],而酱香型白酒是深受消费者喜爱的独特香型之一。研究显示,酱香型白酒中含有多种风味物质,如酯类、醇类、酸类、醛类、酮类以及酚类等[2-3]。部分风味化合物具有多种生物活性,如抗肿瘤、抗氧化、抗炎等[4-5]。NO 是由一氧化氮合酶(nitric oxide synthase,NOS)催化生成的,调节NO 的生成及一氧化氮合酶(iNOS)的表达被认为是治疗炎性疾病的重要手段[6]。IL-6、IL-8 是重要的促炎细胞因子,异常释放会导致机体多器官细胞代谢障碍和功能损害[7],而IL-10 是重要的抗炎细胞因子[8]。研究显示,在脂多糖(lipopolysaccharide,LPS)攻击约 30 min 后即可见促炎细胞因子(IL-6、IL-8)的大量释放,而IL-10 则在 LPS攻击后6 h~8 h 达到高峰,较促炎细胞因子反应延迟[9]。肿瘤坏死因子(TNF-α),又称前炎症细胞因子,是启动炎症反应的关键细胞因子[10]。
紧密连接蛋白Occludin 和ZO-l 是构成肠道上皮连接复合体多蛋白复合物的主要结构蛋白[11]。研究表明,肠道上皮紧密连接的完整性受损及肠道渗透性增加与许多胃肠道疾病的发病机制相关。肠道上皮细胞在受到刺激或发生炎症时,其紧密连接完整性会出现一定的损伤,进而导致肠黏膜屏障功能下降,最终会使肠道细菌或其它异物进入循环系统[12]。
酱香型白酒是经高粱等多种粮食作物经过发酵等多种工序获得的纯天然性酒精饮品,不论是传统中医中药研究还是现代药理学研究,结果均显示其具有广泛的药理作用,而白酒在抗炎及对肠道疾病方面的药效也具有较多的报道。但由于酒精的存在及白酒中其它有效成分的含量甚微,加之提取分离纯化等技术条件的制约,使得人们对白酒中非乙醇成分的研究较少。本研究通过氯仿萃取及冷冻干燥的方式获得酱香型白酒中的非乙醇活性物质,并通过液相色谱-质谱联用技术(high performance liquid chromatography-mass spectrometry,HPLC-MS)分析其化合物组成,建立LPS诱导的IEC-6 细胞炎症模型,探讨酱香型白酒中非乙醇物质(maotai-flavor liquor extract,MTE)对模型细胞及细胞紧密连接蛋白的作用。从而为阐明MTE 对LPS诱导的IEC-6 的细胞增殖、炎性反应及细胞间紧密连接蛋白等的作用及机制提供一定的试验依据。
1 材料与方法
1.1 材料与试剂
大鼠小肠隐窝上皮IEC-6 细胞株:美国ATCC 公司;酱香型白酒:贵州茅台集团;LPS:Sigma 公司;胎牛血清(fetal bovine serum,FBS)、青链霉素:HyClone 公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS):广州瑞舒生物科技有限公司;DMEM 培养基:HyClone 公司;0.25%胰蛋白酶(≥180 U/mg):Gibco 公司;IL-6、IL-8、TNF-α、NO、IL-10 试剂盒:碧云天生物科技有限公司;ExScript TM RT-PCR Kit 试剂盒:TaKaRa 公司。
1.2 主要仪器
api 3000 液质联用仪 HPLC-MS/MS:ABSCIEX 公司;FORMA 3111 二氧化碳细胞培养箱:赛默飞公司;1510 多功能酶标仪:赛默飞公司;CFX96PCR 仪:Bio-Rad 公司;RE-2000B 旋转蒸发仪:瑞德仪器公司。
1.3 方法
1.3.1 MTE 的分离及 HPLC-MS 分析
500 mL 分液漏斗中加入100 mL 酱香型白酒、40 mL水和150 mL 氯仿,震荡摇匀,静置,分离氯仿层,重复3 次,合并氯仿层。用旋转蒸发仪(0 ℃)除去氯仿获得有机层化合物。真空冻干机冻干水层,获得水层化合物,合并有机层及水层化合物为MTE,-20 ℃避光保存。HPLC-MS 分析方法参考文献进行[13]。
1.3.2 细胞培养
细胞培养于含有10 %的FBS、105U/L 青霉素和100 mg/L 链霉素的DMEM 培养基,培养于37 ℃、5%CO2、90%相对湿度的培养箱内,隔天换液。
细胞浓度2×105/mL 加入含有0.10 mg/mL 的化合物的96 孔细胞培养板培养24 h 后,加入1.0 mg/L LPS培养4 h,CCK8 检测细胞增殖能力。
细胞浓度2×105/mL 加入含有0.20 mg/mL 的白酒(53 度)、MTE、α-雪松醇、乙醇 ∶水(体积比 53 ∶47)的96 孔细胞培养板培养24 h 后,加入1.0 mg/L LPS 培养4 h,CCK8 检测化合物对增殖能力及流式检测细胞凋亡的情况。
细胞浓度2×105/mL 加入含有0.20 mg/mL 的白酒(53 度)、MTE、α-雪松醇、乙醇/水(体积比为 53 ∶47)的96 孔细胞培养板培养24 h 后,加入1.0 mg/L LPS 培养4 h,采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒测定 NO、TNF-α 等相关炎症因子浓度。细胞裂解后收集裂解物,提取RNA,采用定量PCR 测定TNF-α、IL-10 等基因的相对表达。
1.3.3 RNA 提取和 cDNA 的合成
培养细胞吸去培养基,加入0.50 mL 细胞裂解液,收集于2.0 mL 离心管,室温25 ℃静置2 min 后加入0.10 mL 氯仿,剧烈振荡 15 s 混匀,静置 2 min~3 min。在4 ℃1.2×104g 离心3 min,取上层水相加入等量异丙醇,漩涡振荡,室温 25 ℃放置 10 min;1.2 × 104g 离心10 min,弃上清,沉淀中加入1.0 mL 75%乙醇洗涤,室温25 ℃干燥后加入30 μL 的DEPC 水溶解即得总RNA,其 OD260/280为 1.8~2.0[14]。cDNA 的合成使用SYBR@PrimeScriptTMRT-PCR Kit,按试剂盒操作说明进行。
1.4 PCR扩增
IL-6、IL-8、TNF-α、IL-10、Occludin、ZO-1 和 βactin cDNA 参照 GenBank 中公布的序列,利用Primer5.0 软件设计引物,并合成。试验实时荧光定量PCR 采用SYBR Green I 染料法,按照ExScriptTMRTPCR Kit 试剂盒操作说明书在定量PCR 仪进行。总反应体积 10.0 μL 体系:SYBR-Premix Ex TaqTMⅡ 5 μL,引物(10 μmol/L)2.0 μL,cDNA 模版 1.0 μL,双蒸水2.0 μL。PCR 反应条件:预变性 95 ℃ 10 s,变性 95 ℃5 s,荧光检测 72 ℃ 10 s,40 个循环。
1.5 数据处理
所有数据采用SPSS 18 软件进行统计。对阴性对照和阳性对照采用独立样本t 检验,对MTE 处理效应进行回归分析。p <0.05 定为具有显著性差异,结果均以 Mean±SEM 表示。
2 结果与分析
2.1 MTE的分离提取及化合物分析
MTE 中相关化合物对IEC-6 细胞增殖能力的影响见表1。
本试验中100 mL 白酒经萃取及冷冻干燥,最终获得 MTE 0.75 mg。HPLC-MS 分析,MTE 多为多元醇、不饱和脂肪酸及其酯类化合物、吡嗪类化合物及含有苯环的芳香族化合物,选出其中26 个化合物及MTE 进行体外抗炎活性研究。
2.2 MTE对IEC-6细胞增殖能力的影响
肠上皮细胞是肠黏膜机械屏障的主要组成部分,可分泌细胞因子和趋化因子,在肠道免疫系统中起重要作用,该细胞受损将会增加肠道黏膜的渗透性,从而增加肠道LPS 的迁移[15]。0.10 mg/mL MTE 化合物预处理细胞24 h 后,加入1.0 mg/L LPS 培养4 h,CCK8检测细胞增殖能力。相比于正常(细胞增殖能力设为100%)组,LPS 组细胞增殖能力显著下降(83.3%,p<0.05)。分析试验结果发现,部分化合物可显著的降低由LPS 诱导引起的细胞增殖能力降低。与LPS 组相比,MTE-2、3、5 及 11 与 IEC-6 细胞共培养 24 h 后,与LPS 组相比,细胞增殖能力分别提高13.2%,11.9%,10.3%及11.5%。不同于MTE-2 等的保护作用,MTE-18、20、21 共培养降低了细胞增殖能力,与LPS 组相比,细胞增殖能力分别降低9.5%,8.5%及8.3%。因此,选择MTE-2 继续进行抗炎活性研究。
2.3 MTE对IEC-6细胞相关炎症因子表达影响
MTE 对 IEC-6 细胞分泌 NO、IL-6、IL-8、TNF-α、IL-10 的影响见表2。
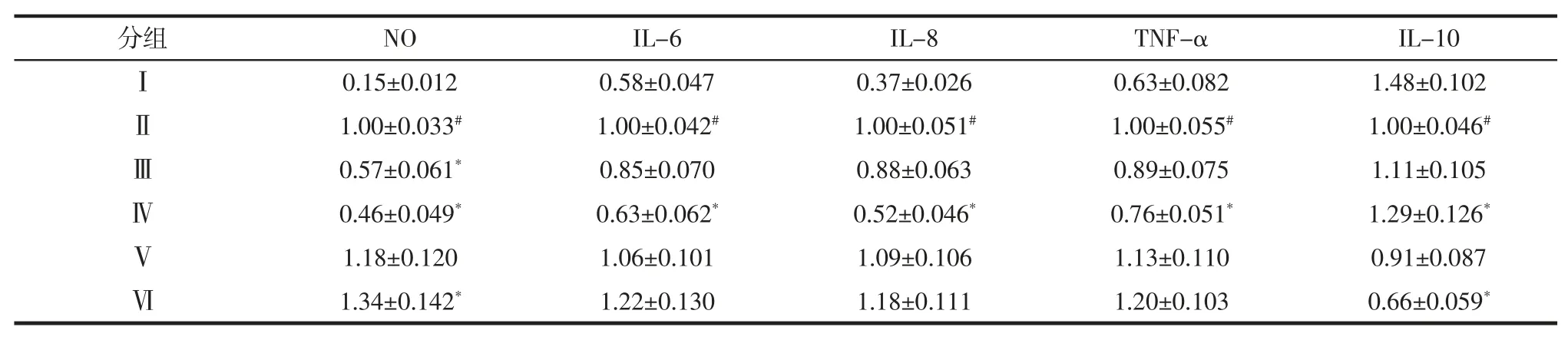
表2 MTE 对 IEC-6 细胞分泌 NO、IL-6、IL-8、TNF-α、IL-10 的影响Table 2 Effects of MTE on NO,IL-6,IL-8,TNF-alpha and IL-10 secretion by IEC-6 cells
分析表2 试验结果可知,LPS 刺激使 NO、IL-6、IL-8、TNF-α 分泌显著升高(p<0.05),降低了 IL-10 的分泌。在 MTE、α-雪松醇处理后,TNF-α、NO 及 IL-6的分泌量显著降低,而IL-10 分泌量则显著增加,对IL-8 分泌量影响不明显。不同于MTE、α-雪松醇,白酒及乙醇组未表现出对IEC-6 的保护作用,相关炎性因子TNF-α、NO 及IL-6 的分泌量不但没有降低,相比于LPS 组,其分泌量反而增加。推测是乙醇具有一定的致炎作用导致的。但同样是53%的酒精浓度,酱香型白酒对细胞的损伤弱于酒精,推测是白酒中的其它物质减弱了乙醇对细胞的损伤作用。
2.4 MTE对IEC-6细胞凋亡、细胞迁移能力的影响
MTE 对LPS 诱导的IEC-6 细胞凋亡及细胞迁移能力的影响见图1。
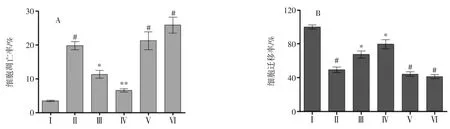
图1 MTE 对LPS 诱导的IEC-6 细胞凋亡及细胞迁移能力的影响Fig.1 Effects of MTE on LPS-induced IEC-6 cell apoptosis and cell migration
图1-A 结果显示,LPS 刺激IEC-6 细胞后,细胞凋亡率明显增加(正常组,p<0.05)。MTE、α-雪松醇组IEC-6 细胞凋亡率明显降低。与LPS 组比较,MTE、α-雪松醇处理后细胞凋亡率下降8.49%、13.2%。不同于MTE、α-雪松醇的保护作用,白酒组、乙醇组细胞凋亡率与正常组组比较,分别上升17.7%、22.4%。说明白酒、乙醇加重了LPS 对细胞的损伤,使细胞凋亡率上升。
同时试验采用细胞划痕试验检测MTE 对LPS 诱导的IEC-6 细胞迁移能力的影响,为便于比较,将正常组细胞迁移能力设为100%,其它组为相对值。结果如图1-B 所示:与正常组比较,LPS 刺激ICE-6 细胞后,细胞迁移率显著降低(与正常组比较,p<0.05)。用MTE、α-雪松醇处理后,细胞迁移率显著提高(与LPS组比较,p<0.05),提示 MTE、α-雪松醇可增强 IEC-6细胞抗LPS 损伤的能力。而白酒、乙醇组,细胞迁移能力与LPS 组相比,均有下降,推测可能是乙醇与LPS协同使IEC-6 细胞凋亡率上升、细胞迁移能力下降。
2.5 MTE对IEC-6细胞炎性细胞因子基因表达的影响
MTE 对IEC-6 细胞炎性细胞因子基因表达的影响见图2。
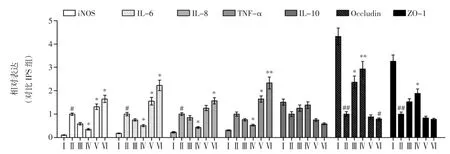
图2 MTE 对 LPS 处理 IEC-6 细胞 iNOS、IL-6、IL-8、IL-10、TNF-α、Occludin 及 ZO-1 mRNA 表达的影响Fig.2 Effects of MTE on the expression of iNOS,IL-6,IL-8,IL-10,TNF-alpha,Occludin and ZO-1 in IEC-6 cells treated with LPS
如图2 所示用LPS 刺激IEC-6 细胞后,与正常组相比,iNOS、IL-6、IL-8、TNF-α mRNA 表达明显上升(p<0.05),而 IL-10 mRNA 表达下降。ZO-1、Occludin mRNA 表达明显下降,与对照组相比(p<0.01)。MTE、α-雪松醇处理后,其mRNA 表达明显提高(与LPS 比较,p<0.05)。该试验结果说明,LPS 可导致 IEC-6 细胞相关炎性因子mRNA 的表达上升,Occludin 和ZO-1 mRNA 的表达下调,而MTE、α-雪松醇可抑制LPS 所致的ZO-1 mRNA 表达下调及炎性因子mRNA 的表达上升,使之恢复至接近正常水平。
3 结论
本研究采用LPS 刺激IEC-6 细胞建立细胞炎症模型探究酱香型白酒中非乙醇类物质抗炎活性。结果显示,MTE-2(α-雪松醇)可显著抑制LPS 诱导的IL-6、TNF-α 等炎性因子分泌,增强细胞迁移能力,说明MTE-2 可有效的抑制LPS 诱导的炎症反应,增强细胞损伤修复能力。
LPS 刺激 IEC-6 细胞后,Occludin 和 ZO-1 的mRNA 表达量显著下降,用MTE-2 干预后,Occludin和ZO-1 mRNA 表达得到明显恢复,表明肠道炎症与紧密连接蛋白存在密切的关系。结合前面所得的试验结果,推测MTE-2 通过增强细胞紧密连接蛋白的完整性和肠上皮屏障功能抑制LPS 所致的肠道损伤,而其中的作用机制可能与上调Occludin 和ZO-1 mRNA 与蛋白的表达密切相关。试验结果显示,酱香型白酒提取物表现出与其组分MTE-2 类似的作用,而白酒及乙醇则与LPS 发挥协同作用,并对肠道细胞紧密连接完整性和肠上皮屏障功能具有一定的损伤作用。

