不同提取方法对万寿菊花中总多酚和总花色苷动力学模型对比研究
薛宏坤,戴宁,谭佳琪,刘成海,*
(1.东北农业大学工程学院,黑龙江哈尔滨150030;2.北京理工大学信息与电子学院,北京100081;3.东北农业大学农学院,黑龙江哈尔滨150030)
万寿菊(Tagetes erecta L.)又名臭芙蓉,一年生草本植物,花中含有多种活性成分,其中包含多酚、叶黄素、花色苷和皂苷等活性成分,通常作为天然食用色素被广泛应用于食品工业中[1]。研究表明万寿菊花由于具有抗氧化、抗炎、抗肿瘤、预防老年性眼球视网膜黄斑退化引起的视力下降、保护心脑血管和缓解视疲劳等功效[2-3]。因此,在保健食品和药品领域中有广阔的应用前景。如何高效地从植物中提取活性成份是当前研究的热点。在提取技术方面,研究者提出了微波辅助提取[4](microwave-assisted extraction,MAE)、热回流提取[5](hot reflux extraction,HRE)、超声波辅助提取[6](ultrasound-assisted extraction,UAE) 和超临界 CO2提取[7](supercritical carbon dioxide extraction,SCDE)等提取方法。目前,对万寿菊花活性成分的提取主要集中在提取工艺优化及抗氧化活性鉴定方面。然而,关于采用动力学模型评价和比较HRE、UAE 和MAE 万寿菊花中总多酚、总花色苷和提取物的抗氧化活性的动力学未见报道。
UAE 和MAE 是具有潜力的绿色提取技术。对比UAE、HRE 发现,UAE 具有效率高、操作简单、溶剂消耗量小和能量利用率高等优点。其原理是利用超声波的空化效应、热效应、机械效应等,加速植物细胞壁破裂,减小活性成分在植物细胞内的传质阻力,使细胞内的活性成分更容易从细胞中扩散到周围溶剂,有效提高了活性成分得率[8]。另外MAE 是基于离子传导和偶极旋转这两种作用机制[9]。其本质是利用磁控管产生高频电磁波直接穿透植物细胞内部,使植物细胞内部的极性分子随微波频率做同步的高速旋转,离子做快速移动、瞬时摩擦生热,使得细胞内的温度迅速增加[10]。溶剂蒸发,产生压力,当产生的压力超过细胞壁所承受的最大压力,细胞壁破裂,从而有效降低活性成分传递过程中的阻力,达到强化萃取植物活性成分的目的[11]。MAE 较UAE 具有更高的效率、更短的时间。
Ahmadian-Kouchaksaraie 等[12]采用常规固液提取法从植物花瓣中提取活性成分,研究发现当提取温度为66 ℃、乙醇浓度为59%、提取时间为104 min 时,活性成分得率最大。王闯等[13]采用有机溶剂提取法提取万寿菊花中反式叶黄素,研究发现获得最大叶黄素提取率的条件为:石油醚用量为42.6 g/mL、萃取温度为58.8 ℃和KOH-乙醇溶液质量浓度为0.099 g/mL。宋昊等[14]采用几种有机溶剂和超声波辅助提取万寿菊干花颗粒中的叶黄素,结果表明当萃取温度在60 ℃,40%石油醚-乙醇混合作为提取溶剂以及适当提高超声波振荡强度可使叶黄素提取率提高3 倍~6 倍。马清香等[7]利用超临界CO2萃取万寿菊花中叶黄素,得到最佳的工艺条件为:萃取温度为60 ℃、压力30 MPa,CO2流速15 L/h,此条件下可获得最大的叶黄素提取率。然而,以上的研究没有涉及到料液比对万寿菊花活性成分提取率的影响。事实上,确定合适的料液比对于萃取溶剂和固体样品充分混合是至关重要的,并且合适的料液比能在萃取过程中提供较大的传质驱动力,保证目标成分尽可能多的被提取出来。因此,有必要采用更有效的提取方法,以可行性的提取成本,达到提高植物活性成分得率和整体质量的目的,分析植物活性成分萃取动力学模型对于工业应用是必不可少的。本文采用二阶速率模型评价不同料液比经HRE、UAE和MAE 万寿菊花中总多酚的提取动力学;并在最佳料液比下探究不同提取方式提取万寿菊花中总花色苷以及提取物总抗氧化活性的动力学。
1 材料与方法
1.1 材料与试剂
新鲜的万寿菊花:亳州万花堂药业有限公司,将其置于真空冷冻干燥机中冻干,然后用粉碎机进行粉碎,过40 目筛,制成菊花粉,避光密封保存在4 ℃冰箱中备用。
Folin-Ciocalteau 试剂、没食子酸标准品、α-生育酚为标准品和DPPH:美国Sigma 公司;AB-8 型大孔树脂:天津市大钧科技有限公司;甲醇、乙醇、氯化钾、醋酸钠、浓盐酸:分析纯,天津市富宇精细化工有限公司;矢车菊-3-葡萄糖苷标准品(纯度≥98 %):美国Chromadex 公司。
1.2 仪器与设备
DK-98-IIA 型恒温水浴锅:天津市泰斯特仪器有限公司;UP200St 超声波处理器:德国超声仪器有限公司;CEM MARS-X 微波溶剂萃取系统:美国CEM 公司;LG10-2.4A 离心机:北京京立离心机有限公司;LAMBDA35 型紫外分光光度计:美国Perkin Elmer 公司;SHZ-D(Ⅲ)型循环水式真空泵:巩义仪器有限责任公司。
1.3 萃取方法
为了保证在固液萃取过程中目标成分具有最大的萃取率,每种萃取方法均将萃取温度固定在66 ℃,乙醇浓度固定在59%,以下的每组试验重复3 次[12]。
1.3.1 常规的热回流萃取
准确称取2.00 g 菊花粉置于200 mL 萃取容器中,按照不同料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶50(g/mL)]加入浓度为59%乙醇溶液将其溶解并充分混合,然后将萃取容器置于66 ℃恒温水浴锅中分别保持1、3、5、15、30 min。萃取结束后将萃取液置于离心管中以4 000 r/min 离心15 min,随后用醋酸纤维素膜(0.65 mm)过滤,所得滤液置于4 ℃冰箱避光保存备用。
1.3.2 超声波辅助萃取
准确称取5.00 g 菊花粉置于500 mL 萃取容器中,按照不同料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶50(g/mL)]加入浓度为59%乙醇溶液将其溶解并充分混合,然后将萃取容器密闭置于66 ℃的超声波萃取仪中,设定超声功率为200 W,超声频率为26 kHz 和超声时间为0.5、1、2、3、4、5 min。采用 1.3.1 的方法进行离心、过滤并将滤液保存备用。
1.3.3 微波辅助萃取
准确称取2.00 g 万寿菊花粉置于100 mL 萃取容器中,按照不同料液比[1 ∶10、1 ∶20、1 ∶30、1 ∶50(g/mL)]加入浓度为59%乙醇溶液将其溶解并充分混合,然后将萃取容器置于微波萃取仪的中央,通过微波萃取仪的控制面板设定萃取温度为66 ℃、微波处理时间为0.5、1、2、3、4、5 min。采用 1.3.1 的方法进行离心、过滤并将滤液保存备用。
1.3.4 分析方法
1.3.4.1 总多酚
采用Folin-Ciocalteau 试剂法测定不同提取方法所得提取液中总多酚的含量[15]。其过程为:分别取上述不同提取方法获得的提取液100 μL,分别加入500 μL Folin-Ciocalteau 试剂、4 mL 蒸馏水和 15%Na2CO3溶液,并将其充分混合,避光室温(25 ℃)条件下反应2 h,在750 nm 处测定样品的OD 值,利用标准方程计算出总多酚的含量。以没食子酸为标准品,在50 mg/mL~500 mg/mL 范围内,用没食子酸标准溶液进行校正,结果用每100 g 干物质(dry matter,DM)所含没食子酸当量(gallic acid,GAE)表示(mg GAE/100 g DM)。
1.3.4.2 总花色苷
采用pH 示差法测定不同提取方法所得提取液中总花色苷的含量[16]。取上述不同提取方法获得的提取液,分别用氯化钾溶液(0.025 mol/L)和醋酸钠溶液(0.4 mol/L)进行稀释,然后用HCl 将其pH 值调整到pH1.0 和pH4.5。采用紫外-可见分光光度计分别在516 nm 和700 nm 处测量每个样品溶液的吸光度值。结果用每100 g 干物质所含矢车菊-3-葡糖苷毫克数表示(mg cyd-3-glu/100 g DM),其方程如下所示:
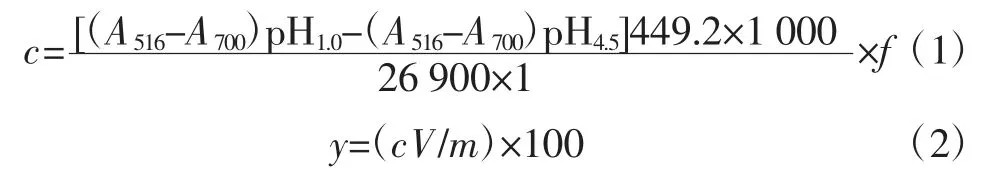
式中:c 为花色苷浓度,mg/mL;A 为提取液的吸光值;f 为稀释倍数;449.2 为矢车菊素-3-葡萄糖苷的相对分子质量;V 为花色苷提取液体积,mL;26 900 为矢车菊素-3-葡萄糖苷的消光系数;1 为比色皿光程,cm;m 为万寿菊花粉质量,g。
1.3.4.3 抗氧化活性
采用总自由基清除能力来评价不同提取方法所得提取物的抗氧化活性。在Wikes 的基础上稍作修改[17],称取20.00 mg DPPH 溶解于250 mL95%乙醇溶液,然后配制成浓度为0.2 mmol/L 的DPPH 溶液。分别取上述不同提取方法所得提取液10 μL,加入2 mL DPPH 溶液,充分混合,在室温(25 ℃)下避光放置30 min 后在517 nm 处测定吸光值。以α-生育酚为标准品,在5.8×10-5mol/L~2.3×10-3mol/L 范围内,用 α-生育酚标准溶液进行校正曲线,R2=0.989 3,结果可用每100 g 干物质所含 α-生育酚毫克数表示(mg α-tocopherol/100 g DM)。
1.3.4.4 动力学模型
采用二阶速率模型研究了HRE、UAE 和MAE 万寿菊花中总多酚、总花色苷和抗氧化活性的提取动力学。二阶速率模型能较好地解析在固液萃取过程中活性成分的传质机理。万寿菊花颗粒内活性成分的溶解速率可以用方程(3)表示[18]:

式中:Ct为任意t 时刻时萃取液中活性成分的浓度,mg GAE/100 g DM;Cs为任意t 时刻时万寿菊花颗粒内活性成分的浓度,mg GAE/100 g DM;k 为二阶萃取速率常数。
式(3)的初始条件和边界条件为:t=0,Ct=0 和 t=t,C=Ct,依据此条件利用 Matlab7.0 软件对式(3)进行编程求解,可得式(3)的解如式(4)所示:

对式(4)进行变形可得式(5):
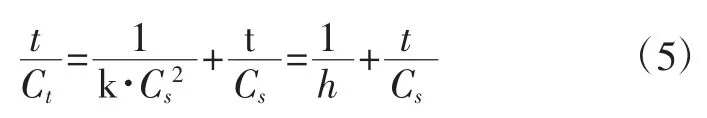
式中:h 为初始时刻活性成分的萃取率,mg GAE/(100 g DM×min)。
对式(5)再次进行变形可得在任意t 时刻时总多酚或总花色苷的浓度,其表达式如式(6)所示:
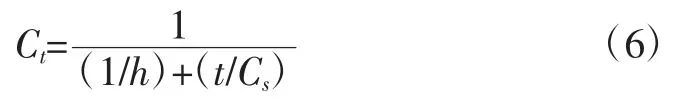
通过t/Ct对t 进行作图,通过直线的斜率和截距能确定初始时刻活性成分的萃取率(h)、饱和状态下总多酚、总花色苷和抗氧化活性以及二阶萃取速率常数(k)值。
决定系数(R2)和残差平方和(sum squared residual,SSE)大小作为评价模型标准,分别用式(7)和式(8)所示:

式中:yn为活性成分(总多酚和总花色苷)浓度和抗氧化活性的试验值为活性成分(总多酚和总花色苷)浓度和抗氧化活性的试验平均值;yn'为经模型计算的活性成分(总多酚和总花色苷)浓度和抗氧化活性。
1.4 数据处理
采用SPSS 22.0 软件对每一组试验数据进行方差分析(ANOVA);利用SAS 8.0 软件分析结果的显著差异;Origin 9.0 进行绘图和数据拟合;采用Matlab7.0 对建立的动力学模型进行求解和模拟。
2 结果与分析
2.1 总多酚含量动力学模型
采用HRE、UAE 和MAE 3 种萃取方式萃取万寿菊花总多酚,在不同料液比下,万寿菊花总多酚提取动力学曲线如图1 所示。
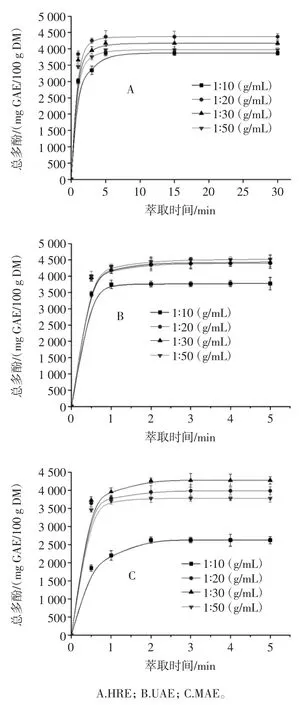
图1 在不同料液比条件下,采用HRE、UAE 和MAE 对万寿菊花总多酚试验值和模拟值动力学比较Fig.1 Kinetics comparison of total polyphenols in marigold by HRE,UAE and MAE under different solid-to-liquid ratios
由图1 可知,在不同萃取方式和料液比下,随萃取时间的延长万寿菊花总多酚含量均呈现先显著增加最后趋于稳定的趋势。其原因是随萃取时间的延长,总多酚被萃取溶剂溶解,然后从万寿菊花颗粒内向周围溶剂扩散,从而使总多酚含量增加[19]。随萃取时间进一步延长,颗粒内外多酚浓度趋于平衡,萃取液中多酚浓度已经达到饱和。因此,在萃取后期总多酚含量基本保持不变。在HRE、UAE 和MAE 萃取方式下,萃取液中总多酚含量到达平衡时所需要的时间分别为15、2 min 和 2 min,HRE 到达平衡所需时间是 UAE 和MAE 的7.5 倍,结果表明UAE 和MAE 方法具有强化萃取万寿菊花总多酚的效果。这归因于超声波的空化效应和微波体积热的方式直接作用与物料内部导致物料细胞结构发生改变,一方面使得萃取溶剂更容易进入颗粒内部溶解目标成分,另一方面细胞结构的改变使得目标成分在颗粒内传质阻力降低,扩散系数增加,从而达到强化萃取目标成分的目的。从图1(A)采用HRE 获得的总多酚动力学曲线得知,当料液比在1 ∶20(g/mL)时,获得的总多酚含量高于其它料液比条件下总多酚含量。由图1(B)可知,总多酚含量随溶剂体积的增加而增加,当料液比在 1 ∶50(g/mL)时,采用 UAE在平衡时获得的总多酚含量最高为[(4811±140)mgGAE/100 g DM]。其原因是随溶剂体积的增加,颗粒内外总多酚浓度梯度增加,浓度梯度作为目标成分传质驱动力,促进目标成分由内向外扩散,从而使萃取液中目标成分含量增大。这与Pradal 采用UAE 从菊苣中萃取总多酚结果相似[20]。由图1(C)可知,总多酚含量随溶剂体积的增加呈现先增加后减小的趋势,当料液比在1 ∶30(g/mL)时,采用 MAE 在平衡时获得的总多酚含量最高为[(4 275±99)mg GAE/100 g DM]。当料液比在1 ∶10(g/mL)时,总多酚含量明显低于其它料液比条件下总多酚含量。其原因可能是由于低的溶剂体积阻碍多酚从颗粒内部扩散到周围溶剂,不利于多酚的提取。
不同萃取方式下,在对二阶速率模型回归的基础上确定动力学参数(二阶速率常数,k、初始萃取率,h和饱和浓度,Cs)的值,其结果如表1 所示。

表1 在不同料液比下通过HRE、UAE 和MAE 方式提取万寿菊花中总多酚的二阶速率模型的动力学参数Table 1 Kinetic parameters of the second-order rate model of total polyphenols in marigold flower extracted by HRE,UAE and MAE at different solid-to-liquid ratios
由表1 可知,采用不同萃取方式,对所有试验条件下获得的万寿菊花总多酚试验值进行模型拟合,发现所有拟合的回归系数R2均高于0.9、残差平方和SSE均低于0.22。结果表明二阶速率动力学模型能较好地模拟不同萃取方式下万寿菊花总多酚的传递规律。如表 1 所示,在 HRE 方式下,当料液比在 1 ∶20(g/mL)时,获得总多酚含量最大为[(4 374±94)mg GAE/100 g DM]。在 UAE 方式下,当料液比在 1 ∶50(g/mL)时,获得总多酚含量最大为[(4 793±58)mg GAE/100 g DM]。而在 MAE 方式下,当料液比在 1 ∶30(g/mL)时,获得总多酚含量最大为[(4 275±35)mg GAE/100 g DM]。由表1 结果表明在UAE 方式下获得的总多酚含量高于HRE 和 MAE。
2.2 万寿菊花总花色苷动力学模型
在最佳料液比条件下,采用 HRE[1 ∶20(g/mL)]、UAE[1 ∶50(g/mL)]和 MAE[1 ∶30(g/mL)]3 种萃取方式萃取万寿菊花中总花色苷和提取物抗氧化活性,动力学曲线及参数分别如图2 和表2 所示。
由图2 可知,在 HRE、UAE 和 MAE 3 种萃取方式下,万寿菊花中总花色苷含量均随萃取时间的延长呈现先显著增加后保持稳定的趋势,UAE 和MAE 所得的花色苷含量明显高于HRE。其原因是超声波和微波作用改变了万寿菊花颗粒细胞结果,使得细胞内花色苷传质阻力显著降低,扩散系数增加[11]。采用HR 万寿菊花中的花色苷,其细胞结构未发生改变,花色苷的传质驱动力仅仅依靠细胞内外浓度差。因此,采用HRE 获得的总花色苷含量比UAE 和MAE 低。依据表2 数据可知,在最佳料液比下,采用UAE 方式获得的最大总花色苷含量为[(549±23)mg cyd-3-glu/100 g DM],其含量高于MAE[(527±17)mg cyd-3-glu/100 g DM]和HRE[(454±15)mg cyd-3-glu/100 g DM]方式下获得的最大总花色苷含量。与其它两种提取方法相比,UAE 具有更高的提取效率,这是由于UAE 具有最低的萃取常数[1.93×10-3100g DM mg/(cyd-3-glu×min)]和最高的初始萃取率[9.43×103mg cyd-3-glu/(100 g D M×min)]。采用不同萃取方式,在最佳料液比下获得的万寿菊花总花色苷拟合的回归系数R2均高于0.90、残差平方和SSE 均低于0.20。结果表明:不同条件下获得的试验值与模型预测值之间拟合较好,说明二阶速率动力学模型能较好地模拟不同萃取方式下万寿菊花色苷传递规律。

图2 在最佳料液比条件下,采用HRE、UAE 和MAE 方式对万寿菊花总花色苷试验值和模拟值动力学比较Fig.2 Kinetics comparison of total anthocyanins of marigold flower by HRE,UAE and MAE under the optimum solid-to-liquid ratio

表2 在最佳料液比下通过HRE、UAE 和MAE 方式提取万寿菊花中总花色苷的二阶速率模型的动力学参数Table 2 Kinetic parameters of the second-order rate model for extracting total anthocyanins from marigold flowers by HRE,UAE and MAE at the optimum solid-to-liquid ratio
2.3 万寿菊提取物抗氧化活性能力动力学模型
在最佳料液比条件下采用 HRE[1 ∶20(g/mL)]、UAE[1 ∶50(g/mL)]和 MAE[1 ∶30(g/mL)]3 种萃取方式萃取万寿菊花所获得提取物的抗氧化能力,其提取动力学曲线和动力学参数如图3 和表3 所示。

图3 在最佳料液比条件下,采用HRE、UAE 和MAE 方式对万寿菊花提取物抗氧化试验值和模拟值的动力学比较Fig.3 Kinetics comparison of antioxidant test value and simulated value of marigold extract by HRE,UAE and MAE at the optimum solid-to-liquid ratio
由图3 可知,在不同萃取方式下获得的试验值和动力学模型之间有良好相关性。提取物中总酚含量与提取物抗氧化活性能力之间存在着密切的关系,如表1 所示在不同萃取方式下获得最大总酚含量与最大抗氧化活性能力一致。其原因是由于提取物中总多酚含量越大,使单位体积提取液中的酚羟基数目越大,酚羟基作为主要的还原部位,在氧化过程中,酚羟基作为供氢体可以与氧化过程中产生的自由基发生反应,自身形成的自由基可以通过分子内氢键、半醌式自由基等形式得以稳定,从而中断自由基链的反应。因此,总酚含量决定着提取物抗氧化活性能力。依据表3 数据可知,在最佳料液比下,UAE 方式下获得的提取物最大抗氧化活性能力为[(4 252±83)mg α-toc/100 g DM],其含量高于MAE[(4 132±58)mg α-toc/100 g DM]和HRE[(3 899±65)mg α-toc/100 g DM]方式下获得的提取物的抗氧化活性。这与总多酚含量一致。采用不同萃取方式,在最佳料液比下获得万寿菊花提取物抗氧化活性能力的拟合回归系数R2均高于0.90、残差平方和SSE 均低于0.20。证明二阶速率模型能够较好预测HRE、UAE 和MAE 提取物抗氧化活性能力。

表3 在最佳料液比下通过HRE、UAE 和MAE 方式提取万寿菊花所得提取物抗氧化活性能力的二阶速率模型的动力学参数Table 3 Kinetic parameters of second-order rate model for extracting antioxidant activity of extracts from marigold flower by HRE,UAE and MAE at the optimum solid-to-liquid ratio
3 结论
在不同萃取方式和料液比下,获得的万寿菊花总多酚、总花色苷和抗氧化活性的能力的试验值和模拟值拟合较好,回归系数R2均高于0.90,残差平方和SSE 均低于0.25。说明二阶速率模型能够较好预测在HRE、UAE 和MAE 3 种提取方式下,万寿菊花总多酚、总花色苷含量以及提取物抗氧化活性的变化。分析不同萃取方式获得的总多酚的动力学发现,在HRE、UAE 和MAE 方式下获得的最佳料液比分别为1 ∶20、1 ∶50、1 ∶30(g/mL)。采用 UAE 获得的总多酚、总花色苷含量以及抗氧化活性均高于HRE 和MAE,表明UAE 更适用于提取万寿菊花中的活性成分。研究结果为万寿菊中活性成分提取提供一种有效的提取方法。

