武夷山不同土壤利用类型土壤氨氧化微生物群落的季节动态
李巍 黄彪 黄敏敏 刘文静 郭嘉 林香信
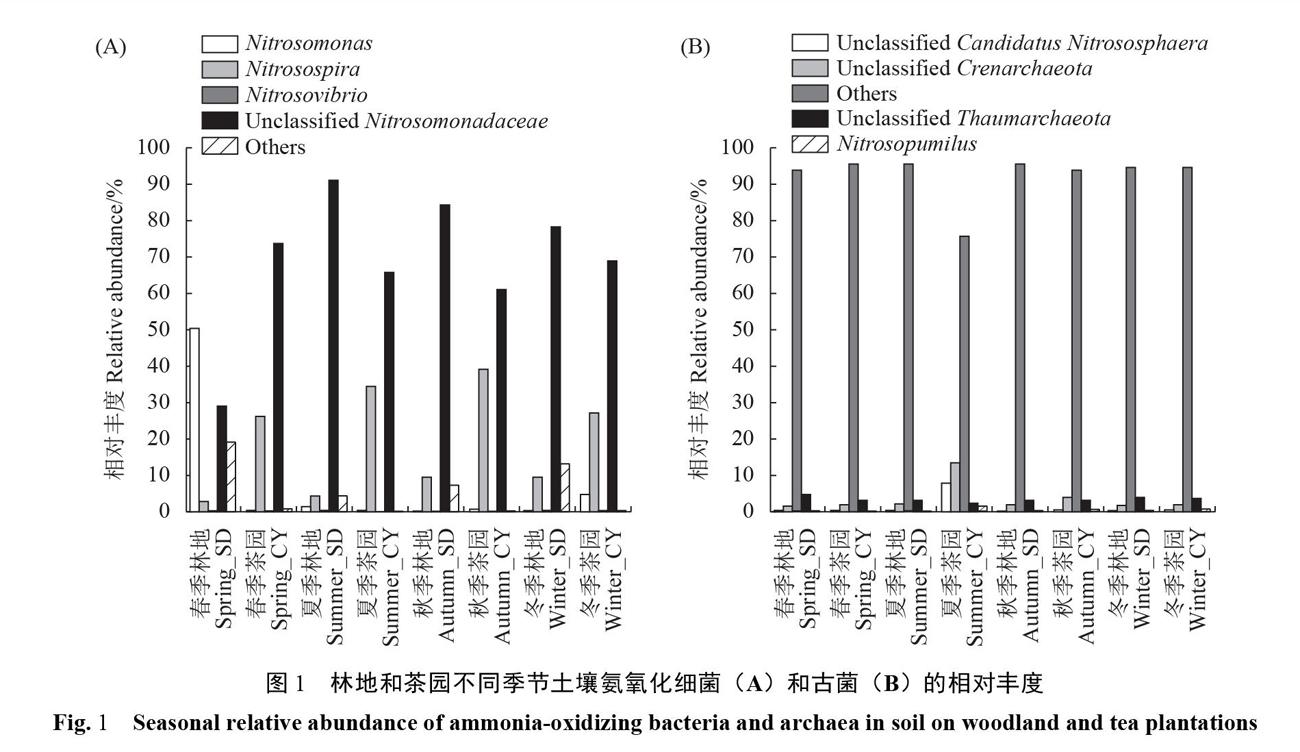
摘要:【目的】研究不同土地利用方式下土壤氨氧化微生物多样性的季节响应,以期了解武夷山不同土壤利用类型氨氧化微生物群落特征和季节变化。【方法】在福建省武夷山的常绿阔叶林区域,分别采集同一纬度下未被开发利用的原始林地和已被开发利用的茶园土壤,利用Illumina Hiseq高通量测序技术对土壤氨氧化微生物的相对丰度及多样性进行分析,同时测定土壤理化性质,并对二者进行关联性分析。【结果】(1)武夷山常绿阔叶林土壤含有丰富的氨氧化微生物资源,不同土地利用方式下土壤氨氧化微生物在Family水平相似,主要包括氨氧化古菌界的Unclassified CandidatusⅣitrososphaera、 Unclassified Crenarchaeota、 Unclassified Thaumarchaeota、Nitrosopumilus、Others;氨氧化细菌界的Nitrosomonas、Nitrosospira
Unclassified Nitrosomonadaceae、Others,其中茶园拥有独特的Ⅳitrosovibrio(亚硝化叶菌属)存在。(2)武夷山林地和茶园氨氧化微生物相对丰度有显著变化且随季节变化显著。(3)土壤氨氧化微生物群落结构与环境因子的关联性分析表明,不同的环境因子对土壤氨氧化细菌和土壤氨氧化古菌的影响不同,且不同季节的主要影响因子也存在差异,有效钾是影响氨氧化细菌变化的主要环境因子,而铵态氮是影响氨氧化古菌的主要环境因子。【结论】随季节变化武夷山常绿阔叶林土壤氨氧化微生物多样性呈现出规律性变化,不同土地利用方式对氨氧化微生物种类影响不大,但对其种群的相对丰度及季节相对丰度影响较大。
关键词:Illumina Hiseq高通量测序;不同土地利用方式;氨氧化细菌;氨氧化古菌
中图分类号:S 154
文献标志码:A
文章编号:1008-0384( 2020) 10-1119-12
0 引言
【研究意义】武夷山具有世界同纬度上现存面积最大、保存最完整的地带性常绿阔叶林群落,是武夷山分布面积最广、最具代表性的森林生态系统,具有丰富的生物资源和优良的自然环境,是研究生物多样性的优势自然基地[1]。氮素既是树木生长最主要的限制因子,直接影响土壤质量以及森林植被的生产力,又会影响生态环境的变化(如酸雨、温室效应、硝态氮淋溶导致的水体富营养化等)[2-7]。硝化作用是土壤氮循环的关键环节之一,对土壤氮素转化、吸收等过程有重要意义[8]。土壤微生物在土壤硝化过程中发挥着决定性作用,其中氨氧化细菌( Ammonia-oxidizing bacteria,AOB)和氨氧化古菌( Ammonia-oxidizing archaea,AOA)是土壤氮循环的重要驱动者,也是硝化速率限制性步骤的关键微生物[9-16]。因此,在林地生态系统中氮循环过程与土壤氨氧化微生物多样性密切相关[17]。【前人研究进展】近年来,国内外开展了对不同森林类型土壤氨氧化微生物群落多样性的相关研究,发现在森林土壤中氨氧化古菌是最丰富的氨氧化微生物,土壤中氨氧化古菌的amoA基因数量比氨氧化细菌高出2~3个数量级[18],但也有研究证明氨氧化古菌主导了苏格兰典型农田土壤氨氧化过程[19]。不同利用方式對草原氨氧化微生物的研究中发现放牧和围封样地的氨氧化古菌丰度均高于氨氧化细菌丰度[20]。四川南充市不同利用类型的土壤理化性质差异显著,氨氧化微生物群落结构存在明显的分异特征[21]。前人研究表明,耕作方式、施肥和种植不同作物等都会影响土壤的氨氧化微生物群落结构[22]。随着经济发展的需要,许多林地被开发利用,使土地利用方式发生了变化,造成土地退化和土壤生态功能的改变日益严重,土壤利用或管理方式的变化也逐渐引起了广大学者的关注[21-25]。武夷山林地改茶园的现象较为普遍,且据Zulkamaen等[26]的研究发现在红壤地区由于土地利用和管理方式的改变会降低土壤有机质含量,同时会加剧土壤酸化,茶园的AOB丰度大于森林。【本研究切入点】目前针对酸性森林土壤中氨氧化古菌对硝化过程贡献的研究虽有相关报道[17,20,22],但对于不同土壤利用类型下森林土壤氨氧化群落结构的变化研究报道甚少。土地利用方式的改变是如何改变土壤氨氧化微生物,从而影响硝化作用和反硝化作用的生理机制还有待进一步研究。【拟解决的关键问题】本研究采用土壤分析化学和Illumina Hiseq高通量测序技术相结合,研究武夷山常绿阔叶林不同土壤利用类型对土壤氨氧化微生物群落多样性的影响及其季节动态变化规律,探讨不同环境因子对土壤氨氧化微生物群落多样性及季节动态变化的影响,以期了解氨氧化微生物在武夷山常绿阔叶林森林生态系统氮循环中的作用,为维持武夷山自然生态系统平衡提供理论依据。
1 材料与方法
1.1 研究区概况
研究样地选自武夷山市星村镇四新村附近常绿阔叶林下两种土壤利用类型(山地和茶园)的地块(27°35'24.23”N,1 17°45'55.43”E),淘拔450—580m.该区域属典型的亚热带季风湿润气候,年均温17.0~18.4℃,年均相对湿度75%~84%,年降水量1 800mm,年均日照时数1 910.2 h,无霜期227~246 d[1]。土壤以黄壤和红壤为主,武夷山常绿阔叶林未开发利用原始林地的森林植被种类组成复杂,呈复层结构,优势种为米槠(Castanopsis carlesii)、甜槠(Castanopsis eyrei)、木荷(Schima superba)等;已被开垦的茶园区域,常年种植肉桂、水仙、105、304等品种的岩茶。
1.2 土壤样品采集
采集同一生境下两种不同土地利用方式的土壤为研究对象:未开发利用的林地(SD)和相邻开发利用的茶园(CY),茶园每年施用复合肥一次。根据不同季节设定取样时间为秋季2015年9月18日、冬季2015年12月22日,春季2016年3月29日、夏季2016年6月21日,共采样4次,分别采集不同土壤利用类型的表层土壤(0~10 cm),每种利用方式土壤选取3个样点,每个样点采用随机取点法取样,混合均匀后取1kg装入灭菌袋中,在4℃冷藏箱保存并尽快带回实验室,挑根去石砾,将土样分成2份,一份置于超低温冰箱(一70℃)中保存,用于土壤微生物多样性分析;另一份自然风干后过筛,用于土壤理化性质分析。
1.3 土壤理化性质测定
采用凯氏定氮法测定土壤全氮;氯化钾浸提.靛酚蓝比色法测定土壤铵态氮;重铬酸钾氧化.外加热法测定土壤总有机碳;冷硝酸浸提一火焰光度法测定土壤有效钾;电位法测定土壤pH;烘干法测定土壤湿度;土壤温湿度计测定土壤温度。具体测定方法参考《土壤农化分析》[27]。
土壤硝化势的测定参照宋亚娜等[13-14]在稻田测定土壤硝化势的方法,具体方法:称取5 g鲜土置于50 mL离心管中,加20 mL含(NH4) 2S04浓度为1 mmol.L-1的磷酸缓冲液,黑暗的条件下保持在室温培养24 h,加入质量浓度为10 g.L-1KC103来抑制亚硝酸盐氧化;培养完成后加入5 mL 2 mol.L-1的KCI,提取NO2-N后离心,再用格里斯试剂比色法测定提取液中NO2_N浓度(单位:μg.g-1.h-1干土)。
1.4 土壤氨氧化微生物群落多樣性分析
1.4.1 土壤DNA提取和测序 将上述-70℃保存的土壤样品进行宏基因组DNA提取,对检测合格的DNA样品进行高通量测序。土壤氨氧化细菌的测序以Illumina Hiseq 2 500 PE250为测序平台,以土壤总DNA作为模板,土壤氨氧化细菌基因利用特异引物对AOB+ad-1(5 '-TCCCTACACG ACGCTCTTCCGATCTGGGGTTTCTACTGGTGG T-3)和AOB+ad-2(5-AGACGTGTGCT CTTCCGAT CTCCCCTCKGSAAAG CCTTCTTC-3)进行扩增;土壤氨氧化古菌基因利用特异引物对AOA+ad-I(5,_TCCCTACACGA CGCTCTTCCATCTSTAATGGTCTGGC TTAGACG-3)和AOA+ad-2(5-AGACGTGTGCTCT TCCGATCTGCGGCCATCC ATCTGTATGT-3')进行扩增,引物由北京百迈客生物科技有限公司合成。
1.4.2土壤微生物数据分析 土壤氨氧化微生物序列分析利用QIIME software package和UPARSE pipeline完成。利用QIIME的默认参数过滤掉低质量、具有嵌合体结构的序列;然后利用UPARSE软件生成OTU( Operational taxonomic units),利用RDP从每个OTU中选择一条序列作为OTU代表;根据获得的OTU数据,以测序样本的序列数为横坐标,OTU值作为纵坐标绘出每个样品的稀释曲线,同时根据样本中所共有和独有的OTU数目作OTU分布Venn图。然后对数据进行冗余分析( Redundancy analysis,RDA)、直接梯度分析,从统计学角度评价一个或一组变量与另一组多变量数据之间的关系。同时,通过颜色梯度来代表数据矩阵中数值的大小并根据物种或样品丰度相似性进行聚类形成热图( Heat map)展示。
1.5 土壤理化性质与微生物多样性的相关性分析
利用Excel 2010和R语言进行数据分析,通过主成分分析( Principal Component Analysis,PCA)将多组数据的差异反映在二维坐标图上,坐标轴能够最大反映方差的两个特征值,两个样品距离越近表示这两个样品的组成越相似。
2 结果与分析
2.1 不同土地利用方式对土壤氨氧化微生物丰度的影响
武夷山林地土壤中的氨氧化细菌变化具有一定的规律性(图1-A),在春季,亚硝化单胞菌属Nitrosomonas是氨氧化细菌中的优势属,占50.08%,但至夏季时骤然减少,仅占0.98%,秋季低至0.000 695%,冬季略微上升至0.001 16%。在春季,相对丰度第二位为Nitrosomonadaceae的其他属,占28.7g%,但在夏季的土壤样品中达到90.92%,在秋冬季节分别为84.03%和77.94%。在春季相对丰度第三位的细菌是亚硝化螺菌属Nitrosospira,占2.50%,该属在夏、秋、冬季的丰度也相对较低,分别为4.02%、9.33%、9.20%。而亚硝化叶菌属Nitrosovibrio在四季的土壤中均未被检出。Others部分包括了大部分未归属的Proteobacteria及在界分类中未能归属的OTU,其在四季的相对丰度分别为18.62%、4.09%、6.63%、12.86%。
古菌界相对丰度变化比较稳定(图1-B),Unclassified Candidatus Nitrososphaera四季相对丰度分别为0.061%、0.021%、0.051%、0.042%;泉古菌属Unclassified Crenarchaeota的四季相对丰度分别为1.24%、1.72%、1.38%、1.51%; UnclassifiedThaumarchaeota的四季相对丰度为4.68%、2.77%、2.8g%、3.43%,Nitrosopumilus属相对丰度极低,仅在春季被检出,相对丰度为0.000 167%。
武夷山茶园土壤中的氨氧化微生物在属水平上的相对丰度较为稳定(图1)。细菌界中Nitrosomonadaceae下的其他属是氨氧化细菌中的优势属,在4个季节的样本中分别占73.75%、65.62%、60.95%、68.61%,即该属在春、夏、秋三季不断减少,在冬季回升。与林地土壤不同的是,Nitrosospira是茶园土壤中的第二大属,其变化规律与Nitrosomonadaceae下的其他属相反,在春、夏、秋三季不断增加,但在冬季降低。Nitrosomonas在四季中的相对丰度逐渐增加,分别为0.000 2%,0.01%,0.13%,4.74%.Nitrosovibrio的相对丰度是最低的,其规律为冬、春、夏季逐渐降低,秋季丰度最高,分别为0.005 6%、0.007 7%、0.0002 2%、0.018%。Others在四季的相对丰度分别为0.25%、0.055%、0.008 2%、0.022 8%,即在冬春季节逐渐增加,夏秋季减少。
武夷山茶园土壤中的氨氧化古菌的UnclassifiedCrenarchaeota与Unclassified Candidatus Nitrososphaera在秋、冬、春三季逐渐下降,但在夏季快速下降,变化规律与Others相反,仅在夏季表现出了较高的相对丰度,其中,Unclassified Crenarchaeota的四季相对丰度为1.42%、13.48%、3.32%、1.44%, UnclassifiedCandidatusNitrososphaera的相对丰度分别为0.028%、7.48%、0.30%、0.24%。
2.2不同土地利用方式对土壤氨氧化微生物组成的影响
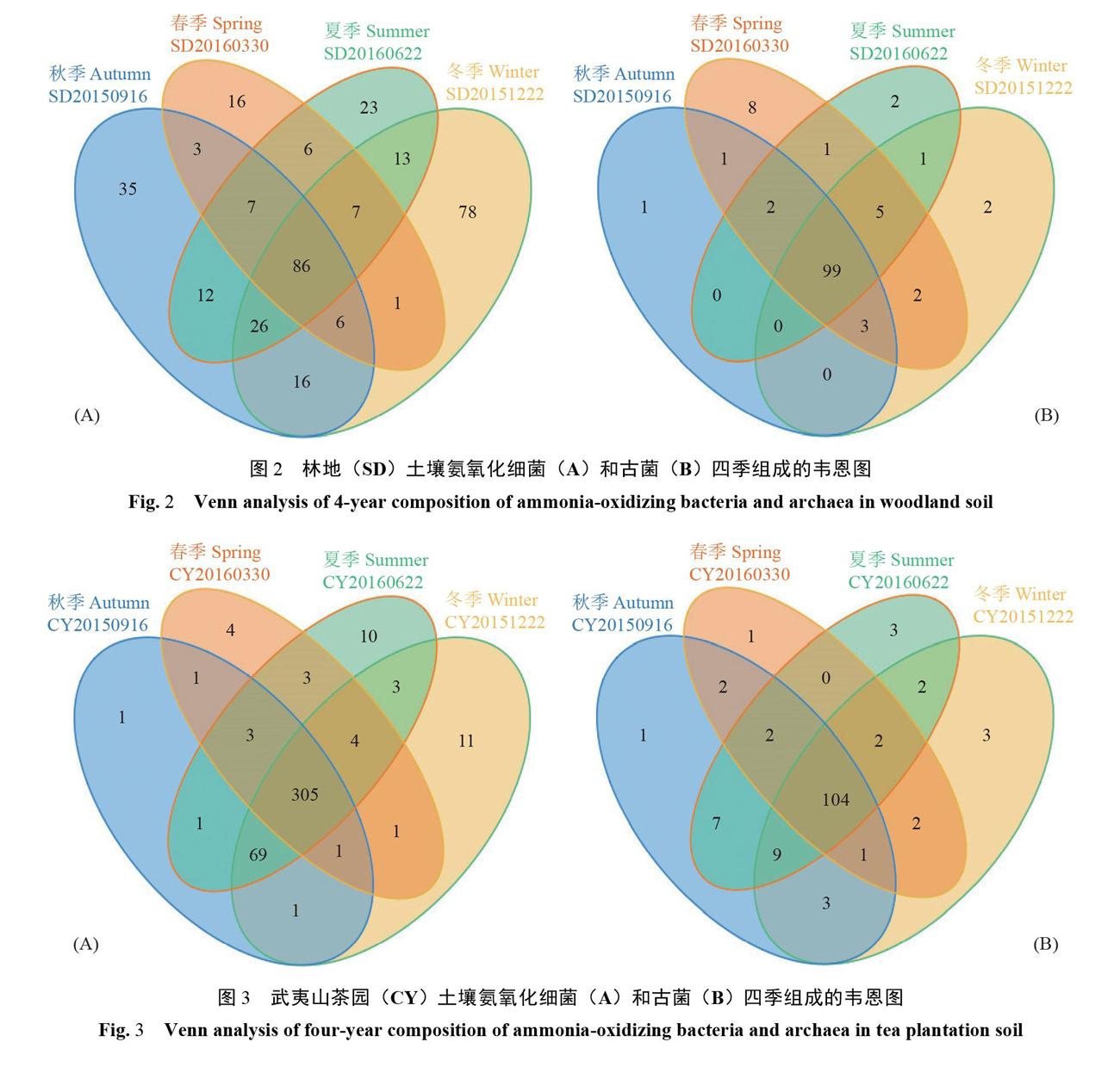
根据武夷山林地土壤样本不同分组绘制成OTU-Venn(韦恩)图,通过对土壤样品测序所得OTU(图2)进行比对,结果表明:林地土壤样品中,春季细菌界特有OTU 16个,夏季23个,秋季35个,冬季78个;春季古菌界特有OTU数为8个,夏季为2个,秋季1个,冬季2个。韦恩图能够在一定程度上从OTU层面反映出土壤菌群的季节多样性,利于发现特殊物种。从研究结果中可以看出,春季土壤古菌界中发现1条特有OTU,归属于Nitrosopumilus。由于所得OTU在RDP分类学数据库分类时大部分物种无法归类到属或种,导致特殊OTU所代表的物种无法被精确挖掘,但特殊OTU的数量可证明不同季节的样本中存在不同的微生物。其中,春季细菌界中特有OTU中有10个被归属为Nitrosomonas,但也有5个OTU属于Others,1条属于Nitrosomonadaceae;古菌界中则有7条属于Others,1条属于Nitrosopumilus。
根據武夷山茶园土壤微生物文库中的OTU绘制成韦恩图(图3),比较4个季节特有的OTU可知,细菌界中,春季拥有4个特殊的OTU,夏季10个,秋季1个,冬季11个。其中,春季特殊OTU中3个属于Others,1个属于Nitrosomonas;夏季的10个OTU中有6个被分类为Others,1个为Nitrosomonas,3个属于Nitrosomonadaceae的其他属;秋季仅含的1个特殊的OTU归属于Others;冬季细菌界包含11个特殊OTU。古菌界中所含的特有OTU数量较少,其中,春季1个,属于Others;夏季3个,2个OTU属于Others,1个属于Unclassified Crenarchaeota;秋季1个,属于Others;冬季3个,属于Others。虽然从RDP分类学数据库得到的分类结果无法识别出不同样本中氨氧化微生物的特殊核心微生物,但是从所得Venn图可知,不同样本中存在不同的微生物。
2.3不同土地利用方式对土壤氨氧化微生物群落结构的影响
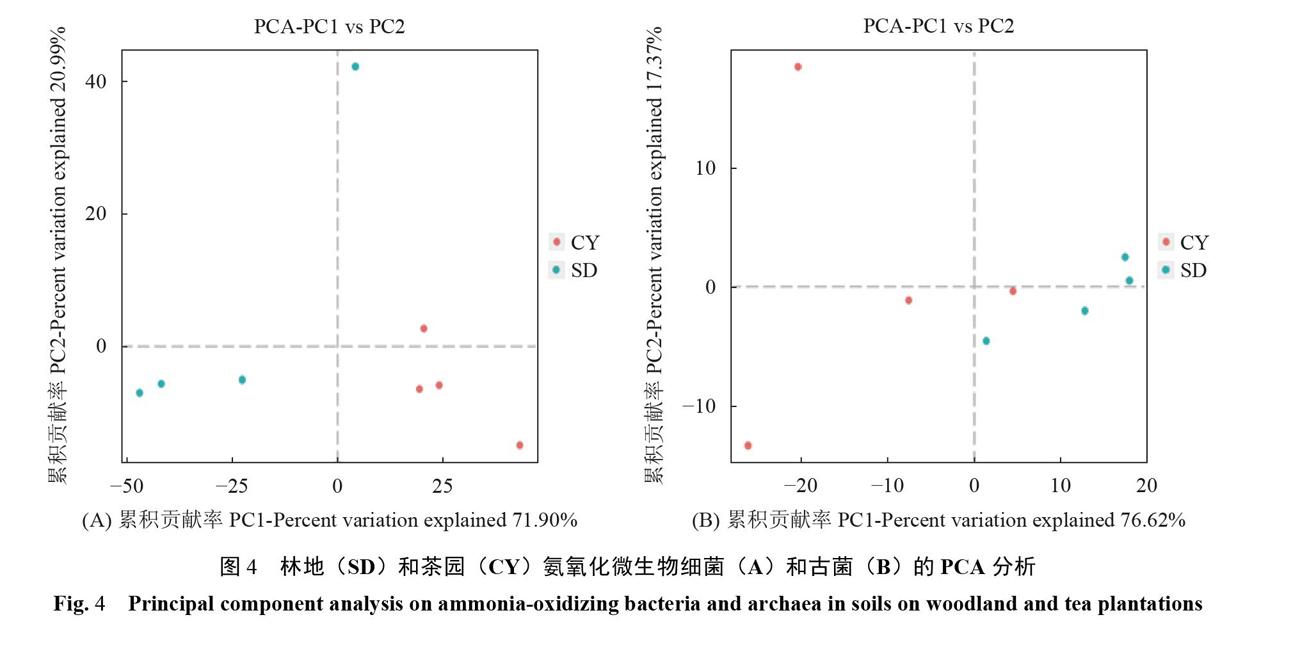
根据组间PCA分析结果,在第一、第二主成分上的累积贡献率大于90%,代表性强,在细菌界PCA图4-A中,茶园土壤与林地土壤组内、组间的样本离散性都很高,说明样本差异性受季节及采集地影响很大。在古菌界PCA图.B中,茶园土壤组内样本离散性很高,说明样本差异性受季节影响很大,但林地土壤样本的离散性较小,即具有重复性,说明样本内的古菌变化受季节影响较小。林地与茶园古菌组间离散型高,说明不同采集地获得的样本古菌组成差异性大。
从林地土壤及茶园土壤样品属分类水平上的Heat map聚类分析(图5),可以反映出不同季节、不同采集地样本群落组成的相似性和差异性。由样本细菌界热图聚类结果可知,夏季林地土壤样本与秋季林地土壤样本具有最高的相似性,春季林地土壤与其他土壤样本具有最大的差异性。在所有样本中,春季林地土壤含有最高Nitrosomonas及Others丰度;夏季林地土壤中Unclasified Nitrosomonadaceae相对丰度最高;Nitrosospira在秋季茶园土壤中相对丰度最高;Nirosovibrio在冬季茶园土壤中相对丰度最高。由样本古菌界的热图可知,夏季林地、秋季林地、春季茶园3个土壤样本古菌相对丰度具有很高的相似性;夏季茶园与其他土壤样品古菌相对丰度差异性最高,Nitrosopumilus,Unclassified CandidatusNitrososphaera,Unclassified Crenarchaeota在夏季茶园土壤样本中相对丰度最高,Unclassified Thaumarchaeota在春季林地土壤中的丰度最高。
在氨氧化细菌界中,由于土壤耕作的利用方式不同,在相同季节,茶园土壤中Nitrosospira相对丰度总是高于林地土壤,但四季丰度变化趋势相同,即气候变化对Nitrosospira的影响是相同的。此外,Nitrosovibrio仅存在茶园土壤中,而不存在林地土壤中。特别的是,林地土壤中Nitrosomonas的相对丰度在春、夏季比茶园土壤多,但在秋冬季节比茶园土壤少,而茶园土壤中Nitrosomonas的相对丰度较稳定;Unclassified Nitrosomonadaceae在林地土壤中的相对丰度波动较大,在茶园土壤中处于较稳定状态。因此,在对比相同季节不同采集地样品后可知,土壤中Nitrosomonas与Unclassified Nitrosomonadaceae的相对丰度与土地利用方式具有很大关系。
在氨氧化古菌界中,在相同季节,茶园土壤中的Nitrosopumilus的相对丰度始终比林地土壤高;林地土壤中Unclassified Thaumarchaeota相对丰度始终比茶园土壤高;在夏季时,茶园土壤中UnclassifiedCrenarchaeota及Unclassified Candidatus Nitrososphaera的相对丰度比林地土壤高出很多,而在其他季节则与林地土壤的相对丰度相似,因此,这些微生物在夏季相对丰度上升与茶园土壤的利用方式有很大关联。
2.4 土壤氨氧化微生物群落结构与环境因子的关联性分析
氨氧化微生物受多种环境因素影响,这些因素包括土壤中铵态氮浓度、pH值、温度等[28-30]。因此,本研究测定了武夷山常绿阔叶林下林地和茶园的有机质、铵态氮、速效磷、有效钾和pH值5项基本土壤理化性质(表1),对5个环境因子分别进行统计分析,得到其重要性排序,以评估每个备选环境变量对相应变量的解释贡献,其中,环境因子对细菌群落在约束性排序的前两轴的累积解释量为61.68%,对古菌的累积解释量为81.60%,因此,环境因子的变化能够解释林地土壤中氨氧化微生物的变化(表2)。
对环境因子和微生物物种之间进行相关系数和重要性分析(表3),结果表明,环境因子对氨氧化细菌的重要性由大到小依次为有效钾>pH值>总有机碳>铵态氮>速效磷;对氨氧化古菌结构影响重要性大小依次为铵态氮>有效钾>pH值>总有机碳>速效磷。由此可知,环境中的有效钾、pH值、总有机碳与氨氧化微生物的相关性较大,相关系数均大于0.2;铵态氮与古菌的相关性最大,相关系数为0.457 8,但其与细菌的相关性最小仅为0.066 9;速效磷与细菌丰度变化的相关系数0.056 4,与古菌的相关系数仅0.047 3,所以氨氧化微生物受土壤速效磷影响较小。
对武夷山常绿阔叶林下不同土地利用类型土壤中氨氧化细菌与古菌群落结构与季节变化中环境因子的关联性分别进行RDA分析(图6)的结果亦表明,不同的环境因子对氨氧化细菌和古菌的影响不同,而且不同季节的主要影响因子也存在差异。对于氨氧化细菌(图6-A)来说,相关性最大的环境因子是有效钾;而对于氨氧化古菌(图6-B),相关性最大的环境因子是铵态氮。对于林地样本来说,氨氧化细菌和古菌的物种结构相似性季节变化一致,均是夏、秋、冬三季相似性高,而春季则与其他3个季节相似性较低;而对于茶园样本来说,氨氧化细菌的物种结构为春夏两季相似性高,而与秋冬两季节相似性较低,氨氧化古菌的物种结构为春、秋、冬三季相似性高,而夏季则与其他3个季节相似性较低。
从RDA(图6-A)中可以看出Nitrosospira菌属与Apo、Aph呈正相关,而与pH、An、Oc呈负相关;Nitrosomonas和Others菌属与pH、An、Oc呈正相关,而与Apo、Aph负相关,分析物种垂直投影于环境变量延长线上距离可以看出,pH值上升对Nitrosomonas的生长最有利,UnclassifiedNitrosomon-adaceae适合相对低的pH值;有效钾对秋季茶园土壤氨氧化细菌群落结构的差异性具有较大贡献。从物种之间的卡方距离来看,Others与Nitrosomonas亲疏关系较近,可能存在互惠的生存关系,而与其他菌属亲疏关系较远,可能存在竞争关系。
从RDA(图6-B)中可以看出,UnclassifiedCandidatusNitrososphaera、Unclassified Crenarchaeota,Nitrosopumilus均与An呈正相关,而与Apo、pH呈负相关;Unclassified Thaumarchaeota与pH、Oc呈正相关,而与Apo、Aph呈负相关。分析物种垂直投影于环境变量延长线上距离可以看出,UnclassifiedCandidatus Nitrososphaera适合相对较高铵态氮的环境,而Others适合相对低的铵态氮的环境。铵态氮对春季林地土壤氨氧化古菌群落结构的差异性具有较大贡献。从物种之间的卡方距离来看,UnclassifiedCandidatus Nitrososphaera、Unclassified Crenarchaeota与Nitrosopumilus亲疏关系较近,可能存在互惠的生存关系,而与其他菌属亲疏关系较远,可能存在竞争关系。
硝化势是研究氨氧化微生物活动的重要指标,从图6-C中可以看出,Nitrosospira及Nirosovibrio适合在硝化势较低的环境中生长,即在硝化势较高的环境中可能因为无法适应环境而失去对硝化作用的贡献,而Unclassified Nitrosomonadaceae则在较高的硝化势环境中依然能够完成硝化作用。夏季林地的硝化势最高,因此夏季林地土壤中细菌的结构容易形成较高的硝化势。从图6-D中可以看出,Nitrosopumilus适合在较低的硝化势环境中生长,而Other适合在较高的硝化势环境中生长。秋季林地样本的硝化势是最高的,说明秋季林地土壤中古菌结构适合造成较高的硝化势。同时,针对夏季林地土壤中的细菌结构和秋季林地土壤中的古菌结构进行分析,细菌中的Unclassified Nitrosomonadaceae和古菌中的Other可能是形成高硝化势的主要微生物,抑或可能是这些时期的群落结构容易使菌群对土壤产生较高的硝化势,而不是单一微生物引起的。然而硝化势的形成是由微生物之间的缓慢的更替形成,若无低硝化势时期的微生物群落结构,可能也无法形成高硝化势的微生物群落结构。
3 讨论
土壤氨氧化微生物在武夷山常绿阔叶林森林生态系统的氮循环过程中具有重要的意义。本文结合了土壤化学和现代分子生态学研究方法对武夷山常绿阔叶林生态系统下不同土地利用类型的氨氧化微生物的群落多样性进行了初步分析,研究结果表明:武夷山常绿阔叶林原始林地土壤及同域下茶园土壤中氨氧化微生物种类相似,在茶园土壤中仅发现亚硝化叶菌属Nitrosovibrio被检出,但丰度极低。这与广东省国家级自然保护区的研究结果不同,在广东南岭亚热带森林生态系统中所有的氨氧化细菌都属于亚硝化螺菌属Nitrosospira[31],说明武夷山常绿阔叶林土壤的氨氧化细菌微生物的资源更加丰富。
武夷山林地和茶园中氨氧化微生物在不同的季节其群落结构的相对丰度大不相同,分别在以下季节中达到最高的相对丰度,土壤氨氧化细菌的林地样本中春季Nitrosomonas占比較大,夏、秋、冬季均是Unclasified Nitrosomonadaceae相对丰度占比最大,而茶园样本中4个季节均为Unclasified Nitroso-monadaceae相对丰度占比最大;土壤氨氧化古菌中林地样本除Others属外林地夏、秋季UnclassifiedThaumarchaeota占比较大,而茶园夏、秋季UnclassifiedCrenarchaeota占比较大。
对中国桃园研究站[32]3种土地利用类型中(农田、天然林、茶园)的研究结果表明,土地利用类型是引起氨氧化微生物的群落结构和相对丰度显著变化的主要因素之一,前人的研究结果[16, 33-36]与本文的研究结果一致。本研究也发现不同采集地的样本结构差异较大,武夷山常绿阔叶林下除春季茶园土壤样本与夏、秋季林地古菌的相对丰度相似外,其他样本的均无相似性,其中夏季茶园与其他土壤样品古菌相对丰度差异性最高,Nitrosopumilus,Unclassified Candidatus,Nitrososphaera.UnclassifiedCrenarchaeota在夏季茶園土壤样本中相对丰度最高,Unclassified Thaumarchaeota在春季林地土壤中的丰度最高。在对比相同季节不同采集地样品后可知,土壤中Nitrosomonas与UnclassifiedNitrosomonadaceae的相对丰度与土壤利用方式具有很大关系。
不同的环境因子对氨氧化细菌和古菌的影响不同,而且不同季节的主要影响因子也存在差异。有效钾是影响氨氧化细菌变化的主要环境因子;而铵态氮是影响氨氧化古菌变化的主要环境因子;速效磷对氨氧化古菌和细菌的影响均最小。有研究也证明[37]AOA和AOB在中国亚热带森林的酸性土壤中差异分布,其受土壤理化特性的影响也不同[37]。Nitrosospira菌属与铵态氮呈负相关;Nitrosomonas菌属与铵态氮呈正相关,这与曹彦强[38]等的研究结果也一致,Nitrosomonas菌属适合在高浓度铵环境下存在,而Nitrosospira菌属在自然环境中经常被发现对亚硝酸盐的亲和力较高。对于林地样本来说,氨氧化细菌和古菌的物种结构相似性一致,均是夏、秋、冬三季相似性高,而春季则与其他3个季节相似性较低;而对于茶园样本来说,氨氧化细菌的物种结构为春、夏两季相似性高,而与秋冬两季节相似性较低,氨氧化古菌的物种结构为春、秋、冬三季相似性高,而夏季则与其他3个季节相似性较低。
据Lu等人[39]的研究结果也证明,森林土壤改为茶园土壤后,其主导的AOA菌群从隶属于陆地分支的Group 1.1b变为隶属于海洋分支的Group 1.1a-associated;氨氧化微生物菌群丰度与土壤硝化势有相关性,如硝化潜势与隶属于54d9-like cluster的AOA呈正相关。这一研究结果与本研究的结论相似。在武夷山在较高的硝化势环境中,秋季林地样本中氨氧化古菌丰度及夏季林地中氨氧化细菌丰度都更为丰富,其中,细菌中的Unclassified Nitrosomonadac-eae和古菌中的Other均有可能是在高硝化势的土壤中形成的主要微生物,此外,也有可能是采样时间影响了群落结构(即各微生物的相对丰度结构,形成利于硝化势升高的代谢途径),容易使菌群对土壤产生较高的硝化势,而不是单一微生物引起的。
4 结论
武夷山常绿阔叶林土壤含有丰富的氨氧化微生物资源,不同土地利用类型的氨氧化微生物种类大致相似,但茶园有独特的Nitrosovibrio亚硝化叶菌属存在,且氨氧化微生物的相对丰度有显著差异;同时,氨氧化细菌和古菌菌落相对丰度随季节变化发生明显变化。有效钾是影响氨氧化细菌变化的主要环境因子,而铵态氮是影响氨氧化古菌变化的主要环境因子。本研究有助于增强对氨氧化微生物在武夷山常绿阔叶林生态系统氮循环中的作用的认识,同时为武夷山自然保护区的土壤利用开发及经营管理提供科学依据。
参考文献:
[1] 李巍,刘洋,罗钦,等.武夷山常绿阔叶林土壤微生物多样性的季节动态[J].热带亚热带植物学报,2017, 25 (2):115-126.
LI W, LIU Y, LUO Q, et al_ Seasonal dynamics in soilmicroorgamsms diversity of evergreen broad-leaved forest in Wuyimountains, southeastern China[J]. Journal of Tropical andSubtropical Botany, 2017, 25(2):115-126. (in Chinese)
[2] 沙丽清,孟盈,西双版纳不同热带森林土壤氮矿化和硝化作用研究[J].植物生态学报,2000. 24 (2):152-156.
SHA L Q,MENG Y, et al. Nitrification and net N mineralization rateof soils under different tropical forests in Xishuangbanna, southwestChina EJl. Acta Phvtoecologica Sinica, 2000, 24 (2):152-156. (inChinese)
[3]李检舟,沙丽清,王君,等,云南哀牢山中山湿性常绿阔叶林土壤氮矿化季节变化[J].山地学报,2006, 24 (2):186-192.
LI J Z,SHA L Q,WANG J, et aL Seasonal variation of soil nitrogenmineralization in a mountane moist evergreen broad-leaved forest inAilao Mountains, SW China EJl.Journal of Mountain Science, 2006,24 (2): 186-192. (in Chinese)
[4] 李贵才,韩兴国,黄建辉,等.森林生态系统土壤氮矿化影响因素研究进展[J].生态学报,2001, 21 (7):1187-1195.
LIGC,HANXG,HUANG JH,et al.A review of affecting factors ofsoil nitrogen mineralization in forest ecosystems [J].Acta EcologicaSinica. 2001, 21 (7): 1187-1195. (in Chinese)
SONG Y N, LIN Z M, LrN J. Composition of ammonia-oxidizingbacteria and ammonia-oxidizing archaea communities in paddy soilsof different rice cultivars [J] Chinese Journal of Eco-Agriculture,2009. 17 (6): 1211-1215. (in Chinese)
[15]宋亚娜,林智敏,红壤稻田不同生育期土壤氨氧化微生物群落结构和硝化势的变化[J].土壤学报,2010, 47 (5):987-994.
SONG Y N. LIN Z M. Changes in community structures of ammonia-oxidizers and potential nitrification rates in red paddy soil at differentgrowth stages of rice [J].Acta Pedologica Sinica. 2010, 47 (5):987-994. (in Chinese)
[16]叶磊,祝贵兵,王雨,等,白洋淀湖滨湿地岸边带氨氧化古菌与氨氧化细菌的分布特性[J].生态学报,2011, 31 (8):2209-2215.
YE L,ZHU G B,WANG Y, et al_Abundance and biodiversity ofammonia-oxidizing archaea and bacteria in littoral wetland ofBaiyangdian Lake. North China[J]. Acta Ecologica Sinica, 2011,31(8):2209-2215. (in Chinese)
[17]隋心,张荣涛,钟海秀,等.森林生态系统中主要功能微生物的研究进展[J].中国农学通报,2014, 30 (28):1-5.
SUI X, ZHANG R T,ZHONG H X. et aL Research progress on mainfunctional microorgamsms in forest ecosystems [J]. ChineseAgricultural Science Bulletin, 2014, 30 (28):1-5.( in Chinese)
[18] XIA W W, ZHANG C X, ZENG X W, et al.Autotrophic growth ofnitrifying community in an agricultural soil [J].The ISME Journal,2011.5 (7):1226.
[19] SEGAL L M, MILLER D N, MCGHEE R P,et al.Bacterial andarchaeal ammonia oxidizers respond differently to long-term tillageand fertilizer management at a continuous maize site [J]. Soil andTillage Research. 2017. 168:110-1 17.
[20]黄蓉,张金波,钟文辉,等.土地利用方式对万木林土壤氨氧化微生物丰度的影响[J].土壤。2012, 44 (4):581-587.
HUANG R,ZHANG J B,ZHONG W H. et al_Abundances ofammonia-oxidizing prokaryotes and gross nitrification activities inforest soils under different vegetations in a natural reserve [J]. Soils,2012, 44 (4): 581-587. (in Chinese)
[21]朱蕊,陈清,马成仓,等,不同利用方式对内蒙古羊草草原氨氧化微生物丰度的影响[J].草地学报,2019. 27 (2):437-442.
ZHU R, CHEN Q,MA C C,et al. Effects of land use pattem changeson abundance of ammonia-oxidizing nucroorganisms in LeymusChinensis grassland in Inner Mongolia [J]. Acta Agrestia Sinica,2019, 27 (2): 437-442. (in Chinese)
[22]路璐,何燕.不同林分土壤中氨氧化微生物的群落結构和硝化潜势差异及其驱动因子[J].南方农业学报,2018. 49 (11):2169- 2176.
LU L,HE Y.The difference of ammonia-oxidizing microorganismcommunities structure and nitrification potential in soils of differentforest stands and their driving factors [J]. Journal of SouthernAgriculture, 2018, 49( 11): 2169-2176. (in Chinese)
[23] LAMBIN E F,MEYFROIDT P.Global land use change, economicglobalization, and the looming land scarcity [J].Proceedings of theNational Academy of Sciences of the United States of America, 20u,108 (9):3465-3472.
[24] MOORE N. ALAGARSWAMY G, PIJANOWSKI B,et aL EastAfrican food security as influenced by future climate change and landuse change at local to regional scales [J]. Climatic Change, 2012,110( 3/4):823-844.
[25]刘灵芝,李景云,秦嗣军,等,“寒富”苹果园土壤氨氧化细菌的筛选与鉴定[J].沈阳农业大学学报,2015. 46 (4):486-491.
LIU L Z,LI J Y, QIN S J,et al.Screening and identification of soilammonia-oxidizing bacteria from "Hanfu" apple orchard [J]. Journalof Shenyang Agricultural UniversitV, 2015,46 (4):486-491. (inChinese)
[26] ZULKARNAEN N. ZHANG Y, ZHANG P,et al.Abundance ofAOA, AOB. nirS. nirK. and nosZ in red soil of China under differentland use[J]. IOP Conference Series: Earth and EnvironmentalScience. 2019, 393: 12007.
[27]鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000: 40, 81.
[28]辛亮,武传东,曲东.长期施肥对旱地土壤中氨氧化微生物丰度和分布的影响[J].西北农业学报,2012, 21 (6):41-46.
XIN L,WU C D,QU D.Long-term fertilization determiningammonia-oxidizing organism abundance and distribution in dryhighland soil of loess plateau [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2012,2l(6):41-46.( in Chinese)
[29]宋三多,陳强,熊璐,等.不同沼肥处理对小麦分蘖期土壤硝化作用强度及氨氧化细菌和古菌群落的影响[J].麦类作物学报,2016.36 (1):111-119.
SONG S D, CHEN Q, XIONG L,et al.Effect of biogas manure onsoil nitrification intensity and soil ammonia-oxidizing bacteria andammonia-oxidizing Archaea communities at wheat tillering stage [J].Journal of Triticeae Crops, 2016, 36(1):111-1 19.( in Chinese)
[30] NIU J. KASUGA L KURISU F, et al. Abundance and diversity ofammonia-oxidizing archaea and bacteria on gianular activated carbon and their fates during drinking water purification process [J] . AppliedMicrobiology and Biotechnology, 20 1 6, 100 (2 ): 729-742.
[31] LIU B, LI Y M. ZHANG J P, et al. Abundance and diversity ofammonia-oxidizing microorganisms in the sediments of Jinshanlake EJl . Current Microbiology, 2014, 69 ( 5 ): 75 1-757.
[32] LI M. CAO H L, HONG Y G. et aL Spatial distribution andabundances of ammonia-oxidizing archaea (AOA) and ammonia-oxidizing bacteria (AOB) in mangrove sediments EJl. AppliedMicrobiology and Biotechnology, 201 1, 89 (4 ): 1243-1254.
[33] ADAIR K L, SCHWARTZ E. Evidence that ammonia-oxidizingarchaea are more abundant than ammonia-oxidizing bacteria insemiarid soils of northern Arizona, USA [J]. Microbial Ecology,2008. 56 (3) : 420-426.
[34]CHEN Z M. Ecosystem functions in Nanling National Nature Reserveand protective measures concemed [J]. Shaanxi Forest Science &Technology, 2012, 61-63: 19.
[35] QIN H L. YUAN H Z. ZHANG H, et al. Ammonia-oxidizing archaea are more important than ammonia-oxidizing bacteria in nitrificationand NO3~N loss in acidic soil of sloped land[J]Biology and Fertilityof Soils,2013,49(6):767—776.
[36]JORDAN F L,CANTERA J J L,FENN M E,et al.Autotmphicammonia-0xidizing bacteria COntribute minimally to nitriflCatiOn in anitrogen—impacted forested ecosystem[J].Applied and Eenvironmental,Microbiology,2005,71(1):197—206.
[37]HAYDEN H L,DRAKE J,IMHOF M,et al.The abundance ofnitr09en CyCle genes AmoA and nim dependS on land-uSeS and S0iltypes in South-Eastem Australia[J].Soil Biology and Biochemistry,2010.42(lO):1774—1783.
[38]曹彥强,闫小娟,罗红燕,等.不同酸碱性紫色土的硝化活性及微生物群落组成[J].土壤学报,2018,55(1):194—202.
CAO Y Q,YAN X J,LUO H Y,et al.Nitrification activity andrnicrobial community structure in purple soils with differem pH[J]Acta Pedologica Sinica,2018,55(1):194—202.(in Chinese)
[39]LU L,HAN W Y,ZHANG J B,et al.Nitrification of archaealammonia oxidizers in acid soils is supported by hydr01ysis ofurea[J].The ISME Journal 2012.6(10):1978—1984.
(责任编辑:张梅)
作者简介:李巍(1984-),女,硕士,助理研究员,主要从事土壤化学与植物营养研究(E-mail: liwei6055@126.com)
通信作者:林香信(1972-),男,副研究员,主要从事农产品质量安全研究(E-mail: 1353645173@qq.com)

