江西铅山红芽芋超低温疗法脱毒苗的转录组分析
尹明华 张艺欣 邓雨晴 吴洪婷 陈婷 郭淑贞 杨于萱

摘要:【目的】探究江西铅山红芽芋对超低温疗法脱毒的转录组响应机制,为江西铅山红芽芋超低温疗法脱毒苗的规模化应用奠定理论依据。【方法】以江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)试验材料进行转录组比较分析。【结果】VF组Clean reads为42 406 188,GC含量为54.Og%;V组Clean reads为46 818 060,GC含量为50.36%。VF组和V组表达量FPKM的对数值在0~2,表达量密度在0~0.8。VF组和V组表达的共有基因数为23 820,V组单独表达的基因数为10 298,VF组单独表达的基因数为4 477。VF组和V组表达量的相关系数为0.287,样本间相关性较差。VF组和V组共产生差异表达基因5 282个,与V组比较,VF组上调基因3 011,下调基因2 271。GO富集分析显示,差异基因主要注释到过氧化氢分解过程、过氧化氢代谢过程、一元羧酸生物合成过程、多糖分解代谢过程、金属离子输运、细胞外区、细胞壁、外部封装结构、膜的固有成分、质膜固有成分、核酸结合转录因子活性、序列特异性DNA结合转录因子活性、单加氧酶活性、铁离子结合、血红素结合等功能。KEGG富集分析显示,差异基因主要注释到苯丙酸生物合成、类黄酮生物合成、二苯乙烯类和二芳基庚烷类以及姜辣素的生物合成、MAPK信号通路一植物、淀粉和蔗糖代谢、酪氨酸代谢、植物激素信号转导、戊糖和葡萄糖醛酸的相互转化、过氧化物酶体、α-亚麻酸代谢、苯丙氨酸代谢、氰胺酸代谢、类胡萝卜素生物合成、异喹啉生物碱的生物合成、泛醌和其他萜类醌的生物合成、甘氨酸、丝氨酸和苏氨酸代谢、植物昼夜节律、果糖和甘露糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢等途径。【结论】F-box家族蛋白、脱落酸受体PYR1、乙烯受体2、生长素响应因子1、BZIP转录因子家族蛋白、过氧化物酶、过氧化氢酶1、超氧化物歧化酶[Cu-Zn]、植物抗病反应蛋白、抗病蛋白、抗病蛋白RPS2、抗病蛋白RPS5、抗病蛋白RGA2、抗病反应蛋白、转座子TNT的逆转录病毒相关Pol多蛋白、逆转录病毒相关Pol多聚蛋白系1、类烟草病毒增殖蛋白3、烟草病毒增殖蛋白1、转座子RE1的逆转录病毒相关Pol多蛋白、蔗糖合成酶等基因是江西铅山红芽芋的超低温疗法脱毒的主要响应基因。
关键词:江西铅山红芽芋;超低温疗法脱毒苗;超低温疗法带毒苗;转录组分析
中图分类号:S 532
文献标志码:A
文章编号:1008-0384( 2020) 10-1050-13
O 引言
【研究意义】江西铅山红芽芋(ColocasiaesculentaL.Schott Var. Cormosus CV. Hongyayu), 属天南星科( Araceae)芋属(Colocasia)多年生宿根性草本植物,多作为一年收获的粮菜兼用作物,属江西省上饶市铅山县特产,2013年4月15日被核准为国家地理标志农产品(登记证书编号:AGI01110)[1]。铅山红芽芋药食兼优。食用,粉而不粘,细致松滑,糯香可口,淀粉颗粒细小易吸收,品质风味居芋类之首[2];药用,含天然多糖,补脾益肠止泻;富微量元素,增强人体免疫;氟含量较高,洁齿防龋护齿;具膳食纤维,润肠通便止秘[3]。江西铅山红芽芋多采用无性繁殖,易积累病毒(如芋花叶病毒、黄瓜花叶病毒等),导致种性退化、早衰严重、抗性不足、产量下降、品质变劣,影响红芽芋种质保存和新品种选育,更影响红芽芋商品性和生产效益,给芋农带来极大损失[4-6]。【前人研究进展】基于超低温保存(Cryopreservation)的超低温疗法(Cryotherapy)是新兴植物脱毒技术[7],可同步实现种质资源“快速脱毒”和“长期保存”双重目标[8-12]。超低温疗法已成为国内外植物脱毒的研究前沿和学术热点。“超低温疗法脱毒”的成功实现主要依赖于“超低温保存技术体系”的建立,理论上只要能利用“超低温”保存种质的植物均可实现“超低温疗法脱毒”,应用前景广阔。目前,国内外的种质资源超低温保存专家开始关注“超低温疗法脱毒”在其他植物(马铃薯、苹果等)上的适用性和广谱性,取得了一系列研究成果[13-14]。病毒侵染对植物来说是一种生物胁迫[15]。从植物转录组数据着手,获得转录组与生物胁迫之间的关系,是研究植物抗逆性的重要手段[16]。转录组测序(RNA—Seq)随着第2代测序技术的快速发展已成为植物分子生物学研究的重要手段,一般用于功能基因挖掘、分子标记开发、代谢通路和调控机制研究等方面[17-18]。【本研究切入点】超低温疗法脱毒是感染病毒的一个逆向过程,是解除病毒这种生物胁迫的过程。超低温疗法脱毒后植物在转录组水平上的分子响应机制还有待深入研究。【拟解决的关键问题】本试验以江西铅山红芽芋为研究对象,通过超低温疗法对其进行脱毒,然后采用RNA.Seq技术,对超低温疗法脱毒苗和超低温疗法帶毒苗进行转录组测序,筛选差异表达显著的基因进行序列分析、比较和功能聚类,初步了解江西铅山红芽芋“超低温疗法脱毒”的响应机制,为江西铅山红芽芋超低温疗法脱毒苗的规模化应用提供依据。
1 材料与方法
1.1 试验材料
江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)由上饶师范学院生命科学学院上饶市药食同源植物资源保护与利用重点实验室制备。材料获得方法:切取江西铅山红芽芋1 cm左右的茎尖,进行超低温保存,最后对其再生苗进行病毒RT.PCR检测,获得江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)。
1.2试验方法
1.2.1 RNA提取 参照说明书用Trizol试剂提取江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)总RNA。所提RNA的质量由Nanodrop 2000和琼脂糖凝胶电泳检测,Agilent 2100测定RIN值。单次建库若RNA总量5 μg,浓度≥200 ng.μL-1,OD260/280为1.8~ 2.2即为可用。
1.2.2 Illumina Hiseq测序RNA测序送由上海美吉生物科技股份有限公司完成。
1.2.3数据分析 使用Trinity软件对clean reads进行de novo拼接,形成Unigene序列。利用Trinity软件组装得到转录本与参考蛋白质数据库NR进行BLAST比对。使用软件Trans Decode对组装结果进行CDS预测。再将序列注释到Swiss-Protein、 KEGG和GO数据库中获得基因功能信息。根据错误发现率(False discovery rate, FDR≤0.001)和表达量倍数变化( IFold changel> 1.5)的阈值筛选出2个样本间差异表达的基因( Degs)。对显著性差异表达基因进行KEGG Pathway显著性富集分析。
1.2.4差异基因的qRT-PCR验证 根据转录组试验结果,采用Primer BLAST在线工具对相关差异表达基因TRINITY- DN22900_cO_gl( F-box family protein)、TRINITY_DN22529_cO_gl( Abscisic acid receptorPYRl)、 TRINITY_ DN2690_cO_gl( Ethylene receptor2). TRINITY___ DN3279- cO_gl( Auxin response factor1)、TRINITY DN7214_cl_gl( BZIP transcriptionfactor family protein).TRINITY_DN768l_cO_g2( Peroxidase)、TRINITY_ DN298一cO_g2( Catalase l)、TRINITY__ N7108_cO_gl( Superoxide dismutase [Cu-Zn])、TRINITY—DN22649_cO_gl( Plant diseaseresistance response protein). TRINITY_DN15482_c0_gl( Disease resistance protein)、TRINITY- DN14303_cO_g2( Disease resistance protein RPS2)、 TRINITY_DN17886_cO_g2( Disease resistance protein RPS5)、TRINITY DN8674_cO_g5( Disease resistance proteinRGA2)、 TRINITY- DN183_cl_gl( Disease resistanceresponse protein)、TRINITY_DN4074_cl_gl( Retrovirus-related Pol polyprotein from transposonTNT)、 TRINITY_ DN10839_cO_gl( Retrovirus-relatedPol polyprotein LINE-I)、 TRINITY_ DN7938_cO_g1( Tobamovirus multiplication protein 3-like)、TRINITY_DN214l_c0_g2( Tobamovirus multiplication protein l).TRINITY DN27902_cO_gl( Retrovirus-related Polpolyprotein from transposon REl)、 TRINITY__ DN840l_cO_gl( Sucrose synthase)進行引物设计(表1),每个样品以GAPDH为内参,3个技术重复,采用1.2.1的方法提取2种材料的总RNA,按照Prime ScriptTM RT reagent Kit with gDNA Eraser (Perfect RealTime)试剂盒说明书合成cDNA的第1条链,在荧光定量PCR仪中进行扩增反应,每个反应重复3次。数据采用SPSS 19.0进行显著性分析。
2 结果与分析
2.1 江西铅山红芽芋超低温疗法脱毒苗测序数据产出分析
碱基质量值(Quality Score或Q-score)是碱基识别( Base Calling))出错概率映射。碱基质量值越高表明碱基识别越可靠。通常Quality scores大于20即满足分析对测序质量的要求。经过测序质量控制,江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)的文库构建质量和测序质量较好,可用于后续的转录组分析(表2)。
2.2 江西铅山红芽芋超低温疗法脱毒苗测序数据与组装结果
将每个样本的clean reads与Trinity组装获得的参考序列进行比对,获得每个样本的mapping结果,也是后续进行各样本基因和转录本定量的基础。一般能定位到组装转录本上的clean reads所占百分比大于70%即为比对结果较好。由表3可知,测序数据与组装结果比对结果较好,可以进行后续VF组和V组样本基因和转录本定量等工作。
2.3 江西铅山红芽芋超低温疗法脱毒苗表达量分析
TPM( Transcripts Per Millionreads):即每百万读段中来自某转录本的读段数。TPM和FPKM -样,都对基因长度和测序深度进行了均一化。但不同的是,FPKM是先对测序深度进行均一化,然后对基因长度进行均一化;而TPM是先对基因长度进行均一化,然后再对测序深度进行均一化。TPM的均一化过程使得不同样本中的总表达量一致,这样可以更直观地进行表达量的比较。由图1-A,VF组和V组表达量FPKM的对数值在0~2。由图1-B展示的VF组和V组样本unigene/transcript的表达量密度分布情况可知,VF组和V组表达量密度在0~0.8。
2.4 江西铅山红芽芋超低温疗法脱毒苗表达量样本间Venn分析
从图2可知,VF组和V组表达的共有基因数为23 820,V组单独表达的基因数为10 298,VF组单独表达的基因数为4 477。VF组单独表达的基因数远远少于V组单独表达的基因数。
2.5 江西铅山红芽芋超低温疗法脱毒苗表达量样本间相关性分析
由图3可知,VF组和V组表达量的相关系数为0.287,表明基因在VF组和V组2个样本间的表达量相似度较低,即样本间相关性不大。
2.6 江西铅山红芽芋超低温疗法脱毒苗差异表达分析
VF组和V组共产生差异表达基因(Differentiallyexpressed gene,DEG)5 282个,与V组比较,VF组上调基因3 011,下调基因2271(图4)。从表4可知,VF组和V组前10个差异表达基因大多为假设蛋白和外壳蛋白。
2.7 江西铅山红芽芋超低温疗法脱毒苗差异表达基因GO富集分析
从图5和表5可知,通过富集,过氧化氢分解过程、过氧化氢代谢过程、一元羧酸生物合成过程、多糖分解代谢过程、金属离子输运、细胞外区、细胞壁、外部封装结构、膜的固有成分、质膜固有成分、核酸结合转录因子活性、序列特异性DNA结合转录因子活性、单加氧酶活性、铁离子结合、血红素结合等GO term富集显著。这可能是江西铅山红芽芋响应超低温疗法脱毒的主要功能变化。
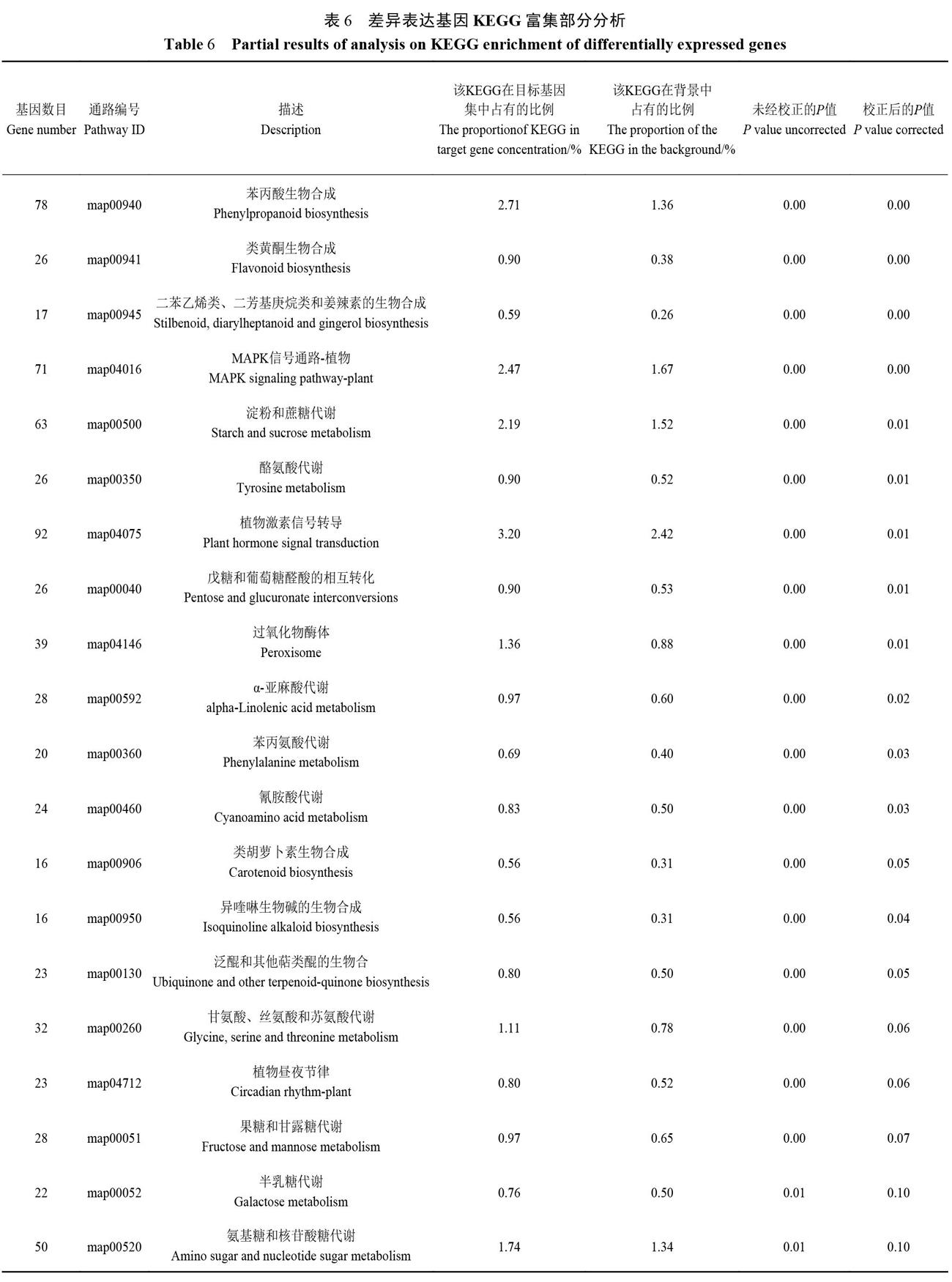
2.8 江西铅山红芽芋超低温疗法脱毒苗差异表达基因KEGG注释
从图6和表6可知,VF组和V组差异表达基因富集的KEGG通路主要有苯丙酸生物合成、类黄酮生物合成、二苯乙烯类和二芳基庚烷类以及姜辣素的生物合成、MAPK信号通路.植物、淀粉和蔗糖代谢、酪氨酸代谢、植物激素信号转导、戊糖和葡萄糖醛酸的相互转化、过氧化物酶体、α-亚麻酸代谢、苯丙氨酸代谢、氰胺酸代谢、类胡萝卜素生物合成、异喹啉生物碱的生物合成、泛醌和其他萜类醌的生物合成、甘氨酸、丝氨酸和苏氨酸代谢、植物昼夜节律、果糖和甘露糖代谢、半乳糖代谢、氨基糖和核苷酸糖代谢等。其中植物激素信号转导(基因数92)、苯丙酸生物合成(基因数78)、MAPK信号通路.植物(基因数71)、淀粉和蔗糖代谢(基因数63)、氨基糖和核苷酸糖代谢(基因数50)、过氧化物酶体(基因数39)以及甘氨酸、丝氨酸和苏氨酸代谢(基因数32)注释的基因数均超过30,这可能是江西铅山红芽芋响应超低温疗法脱毒的主要机制。
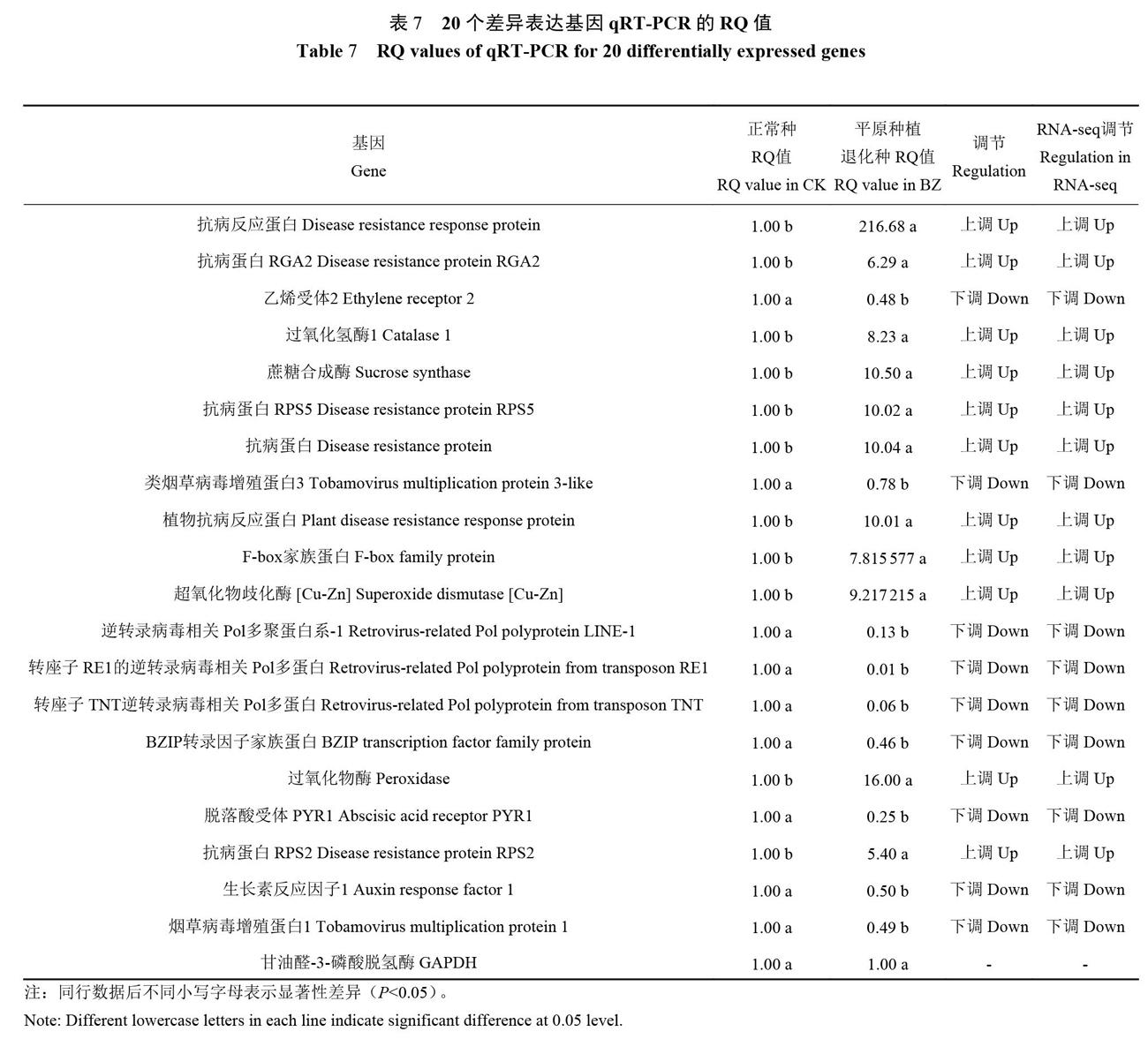
2.9 江西铅山红芽芋超低温疗法脱毒苗相关差异表达基因的qRT-PCR分析验证
从RNA-seq数据中挑选20个在KEGG通路注释数量较多的差异表達基因TRINITY DN22900一c0一gl( F-box family protein)、TRINITY DN22529_cO_gl( abscisic acid receptor PYRl)、 TRINITY DN2690-cO_gl( ethylene receptor 2)、 TRINITY DN3279__ c0_gl( auxin response factor l)、TRINITY DN7214一cl一gl( BZIP transcription factor familyprotein)、TRINITYDN7681 _cO_g2 ( Peroxidase ) 、TRINITY DN298_cO_g2 ( catalase l ) 、TRINITY DN7108_cO_gl ( superoxidedismutase [Cu-Zn] ) 、 TRINITY DN22649_cO_gl ( Plantdisease resistance response protein) 、TRINITYDN15482_cO_gl ( disease resistance protein ) 、 TRINITY_DN14303_cO_g2 ( Disease resistance protein RPS2 ) 、TRINITY DN17886_cO_g2 ( Disease resistance proteinRPS5 ) 、TRrNITY DN8674_cO_g5 ( disease resistanceprotein RGA2 ) 、 TRINITY DN183_cl_gl ( Diseaseresistance response protein)、TRINITY_DN4074_cl_gl( Retrovirus-related P01 polyprotein from transposonTNT)、 TRrNITY_ DN10839_cO_gl( Retrovirus-relatedPol polyprotein LINE-1)、 TRINITY—DN7938_cO_gl( tobamovirus multiplication protein 3-like)、TRINITY_DN214l_cO_g2( tobamovirus multiplication protein l)、TRINITY_ DN27902_cO_gl( Retrovirus-related Polpolyprotein from transposon REl)、TRINITY DN8401_cO_gl( sucrose synthase),并利用qRT-PCR技术对其表达量进行验证(表7),结果显示,20个基因表达量的变化趋势均与RNA-seq结果一致,说明本次转录组测序数据可信度高。qRT-PCR也进一步验证了F-box家族蛋白、脱落酸受体PYR1、乙烯受体2、生长素响应因子1、BZIP转录因子家族蛋白、过氧化物酶、过氧化氢酶1、超氧化物歧化酶[Cu-Zn]、植物抗病反应蛋白、抗病蛋白、抗病蛋白RPS2、抗病蛋白RPS5、抗病蛋白RGA2、抗病反应蛋白、转座子TNT的逆转录病毒相关Pol多蛋白、逆转录病毒相关Pol多聚蛋白系1、类烟草病毒增殖蛋白3、烟草病毒增殖蛋白1、转座子REI的逆转录病毒相关Pol多蛋白、蔗糖合成酶等基因是江西铅山红芽芋的超低温疗法脱毒的主要响应基因。
3 讨论与结论
与常规茎尖培养脱毒法相比,茎尖超低温疗法脱毒率显著提高,且脱毒率不受茎尖大小影响,操作简便,试验周期短、成本低,可同时实现种质保存和病毒脱除双重目[20-22]。目前,超低疗法脱毒苗的转录组分析一般专注于超低温保存程序本身。百子莲胚性愈伤组织超低温保存前脱水和恢复培养材料的转录组分析表明,差异表达基因主要参与到外源刺激响应(517个)、胁迫响应(302个)、植物激素信号转导(207个)等,逆境响应主要表现在细胞膜质结构、还原性物质和植物激素的变化、细胞结构修复及发育相关物质合成代谢等方面[23]。冷冻胁迫下MLP2-1拟南芥与野生型拟南芥植株差异表达基因的KEGG代谢通路富集在植物激素与信号转导代谢通路[24]。本试验结果专注于超低温保存后脱毒苗的内在分子响应机制,与上述结果的出发点不同。在本试验中,江西铅山红芽芋超低温疗法脱毒苗(VF组)和江西铅山红芽芋超低温疗法带毒苗(V组)差异表达基因富集的KEGG通路主要有植物激素信号转导(基因数92)、苯丙酸生物合成(基因数78)、MAPK信号通路一植物(基因数71)、淀粉和蔗糖代谢(基因数63)、氨基糖和核苷酸糖代谢(基因数50)、过氧化物酶体(基因数39)以及甘氨酸、丝氨酸和苏氨酸代谢(基因数32)等通路,这可能是江西铅山红芽芋响应超低温疗法脱毒的主要机制。
植物激素对于江西铅山红芽芋超低温疗法脱毒后的生长发育起着重要作用。植物激素的作用在于形成植物激素信号传导系统,响应内外因素诱导植物激素基因表达[25],激素受体或组件因互作或串话产生协同或拮抗作用从而使植物激素信号转导途径形成网络化[26],最终综合产生效应,使江西铅山红芽芋经过超低温疗法脱毒恢复种性。苯丙氨酸类代谢能合成次生酚类物质和抗菌作用产物(如木质素、绿原酸和植保素等)[27],阻止病原菌生长繁殖,苯丙氨酸解氨酶( PAI)是苯丙氨酸类代谢的定速酶[28]。江西铅山红芽芋超低温疗法脱毒后,会通过提高PAL的活性,促使木质素和绿原酸的积累和植保素的合成,以增强江西铅山红芽芋超低温疗法脱毒苗的抗病性。MAPK(丝裂原活化蛋白激酶)信号通路主要参与各种植物激素信号转导和各种内外因素的应激反应,调控生物非生物胁迫、激素、细胞分裂及植物生长发育[29]。研究表明。MAPK信号通路与植物激素信号传导系统可能存在交叉调控[30-31]。江西铅山红芽芋超低温疗法脱毒苗可增强感知和传递刺激信号的能力,通过MAPK级联通路将信号传递给细胞,启动信号传导系统,对信号级联放大,最终导致植株内部的生理生化变化。江西铅山红芽芋球茎的生长发育(包括形态建成和贮藏物质的积累)是通过光合作用蔗糖的不断合成来完成的[32]。蔗糖和淀粉是变态器官(如球茎)糖类的主要积累形式,可调节和平衡碳水化合物的形态[33]。超低温疗法脱毒可能促使江西铅山红芽芋“淀粉一蔗糖”代谢酶(蔗糖合成酶、蔗糖磷酸合成酶、酸性转化酶、中性转化酶、Q酶)的活性升高,进而对江西铅山红芽芋球茎的发育及其品质起到调控作用。氨基糖最常见的形式是葡糖胺和半乳糖胺,氨基糖代谢与植物生长发育及与环境适应性密切相关。核苷酸糖是糖类合成或相互转换时的活化形式。超低温疗法脱毒可能促使江西铅山红芽芋氨基糖和核苷酸糖各类代谢酶的活性升高,对江西铅山红芽芋球茎的形态建成及质量起到调控作用。过氧化物酶体是过氧化氢产生的细胞器[34],是活性氧类( ROS)的重要来源[35]。研究表明,ROS作为植物激素信号的第二信使,调节植物发育过程和应答反应[36]。过氧化物酶体可能在江西铅山红芽芋超低温疗法脱毒苗中调控ROS,感知環境变化,平衡氧化还原反应,调控细胞各类代谢途径,参与体内不同的重要生理反应。氨基酸是植物新陈代谢关键的参与者[37]。甘氨酸、丝氨酸和苏氨酸代谢可提供一碳单位,合成其他氨基酸、核苷酸、脂质以及合成还原性物质,调控核酸、蛋白质和脂质的合成[38],使江西铅山红芽芋超低温疗法脱毒苗细胞内氧化还原处于动态平衡状态,对维持江西铅山红芽芋超低温疗法脱毒苗的生物代谢及其表观遗传稳定十分重要。本研究表明,F-box家族蛋白、脱落酸受体PYR1、乙烯受体2、生长素响应因子1、BZIP转录因子家族蛋白、过氧化物酶、过氧化氢酶1、超氧化物歧化酶[Cu-Zn]、植物抗病反应蛋白、抗病蛋白、抗病蛋白RPS2、抗病蛋白RPS5、抗病蛋白RGA2、抗病反应蛋白、转座子TNT的逆转录病毒相关Pol多蛋白、逆转录病毒相关Pol多聚蛋白系1、类烟草病毒增殖蛋白3、烟草病毒增殖蛋白1、转座子RE1的逆转录病毒相关Pol多蛋白、蔗糖合成酶等基因是江西铅山红芽芋的超低温疗法脱毒的主要响应基因。
参考文献:
[1] 余志平,林海红,余俊红,等,铅山红芽芋产业发展概况[J].长江蔬菜.2016 (20):34-36.
YU Z P,LIN H H,YU J H,et al.Development of red bud taroindustry in Yanshan [J]. Journal of Changjiang Vegetables,2016 (20): 34-36. (in Chinese)
[2] 姜绍通,程元珍,郑志,等,红芽芋营养成分分析及评价[J].食品科学,2012, 33( ll): 269-272.
JIANG S T,CHENG Y Z,ZHENG Z, et al. Analysis and evaluation ofnutritional components of red bud taro (Colocasia esulenlaL.Schott) EJl. Food Science, 2012, 33 (11): 269-272. (in Chinese)
[3] 山娜,杨文俊,李斌,举全县之力,打造铅山红芽芋支柱产业[J].长江蔬菜,2016 (4):9-10.
SHAN N,YANG W J,LI B.Take the efforts of the whole county tobuild the pillar industry of red bud taro EJl. Journal of ChangiangVegetables, 2016 (4):9-10. (in Chinese)
[4]李火金.铅山红芽芋茎尖脱毒组培繁育及高产栽培[J].中国蔬菜,2012 (2):45-46.
LI H J.Virus free tissue culture and high yield cultivation of the shoottips of the red bud taro EJl China Vegetables, 2012(2):45-46. (inChinese)
[5]江芹,廖华俊,董玲,等.红芽芋的丛生芽诱导和再生体系建立[J].分子植物育种,2015, 13 (3):675-679.
JIANG Q,LIAO H J,DONG L, et al. Induction of multiple shoot andestablishment of regeneration system in Clocasia escalenta schott EJl.Molecular Plant Breeding, 2015, 13(3):675-679.( in Chinese)
[6] 鄧接楼,曹吴玮,李玲,等.脱毒红芽芋试管芋盆栽种植的农艺性状分析[J].分子植物育种,2019. 17( 22):7500-7506.
DENG J L,CAO H W. LI L,et aL Analysis on agronomic traits ofvirus-free test-tube taro planted in pots EJl.Molecular Plant Breeding,2019. 17 (22): 7500-7506. (in Chinese)
[7] 胡国君,董雅凤,张尊平,等.植物类病毒脱除技术进展[J].植物保护学报,2017, 44 (2):177-184.
HU G J,DONG Y F,ZHANG Z P,et al.Progress in plant viroidelimination techniques [J].ActaPhytophyZacicaSinica, 2017,44 (2): 177-184. (in Chinese)
[8]YANG X X,POPOVA E, SHUKLA M R,et al. Root cryopreservationto biobank medicinal plants:A case study for Hypericum perforatumL[J]。In Vitro Cellular&Developmental BioZogy-Plant, 2019,55 (4):392-402.
[9] KULUS D,REWERS M, SEROCKA M, et al.Cryopreservation byencapsulation-dehydration affects the vegetative growth ofChrvsanthemum but does not disturb its chimeric structure EJl.PlantCell. Tissue and Organ Culture (PCTOC), 2019, 138(1):153-166.
[10] 11 W B,HARTUNG J S,LEVY L Quantitative real-time PCR fordetection and identification of Candidatus Liberibacter speciesassociated with Citrus huanglongbing [J] Journal of Microbiological Methods, 2006. 66(1):104-115.
[11] WANG Q C,VALKONEN J P T.Cryotherapy of shoot tips: Novelpathogen eradication method [J]. Trends in Plant Science, 2009.14 (3):119-122.
[12] HELLIOT B, PANIS B,POUMAY Y,et al.Cryopreservation for theelimination of cucumber mosaic and banana streak viruses from banana (Musaspp) [J].Plant Cell Reports, 2002. 20 (12):1117-1122.
[13]李涵,陆琳,瞿素萍,等,杂交兰种苗超低温脱毒技术研究[J].中国农业科技导报。2018. 20 (1):147-153.
LI H,LU L, QU S P,et aL Study of hybrid orchid seedlings on viruselimination using cryopreservation technology [J]. Journal ofAgricultural Science and Technology, 2018, 20(1):147-153. (inChinese)
[14]李艳林,渠慎春,栾雨婷,等,苹果茎尖超低温脱毒体系的建立[J].分子植物育种,2019, 17 (9):2982-2995.
LI Y L,QU S C,LUAN Y T,et al. Establishment of cryopreservationdetoxification system of apple shoot-tips [J]. Molecular PlantBreeding, 2019, 17 (9):2982-2995. (in Chinese)
[15]周金鑫,胡新文,张海文,等.ABA在生物胁迫应答中的调控作用[J].农业生物技术学报,2008. 16 (1):169-174.
ZHOU JX,HUX W. ZHANGH W, et al. Regulatory role of ABA inplant response to biotic stresses [J]. Journal of AgriculturalBiotechnology, 2008, 16 (1):169-174. (in Chinese)
[16] XANTHOPOULOU A, GANOPOULOS I, PSOMOPOULOS F, et al.De novo comparative transcriptome analysis of genes involved in fruitmorphology of pumpkin cultivars with extreme size difference anddevelopment of EST-SSR markers EJl. Gene, 2017, 622: 5066.
[17] UNAMBA C I N,NAG A,SHARMA R K.Next generationsequencing technologies: The doorway to the unexplored genomics ofnon-model plants [J].FrontiersmPlant Science, 2015,6:1074.
[18] COSTA v,ANGELINI C,DE FEIS I,et al.Uncovering thecomplexity of transcriptomes with RNA-seq EJl. Journal ofBiomedicine and Biotechnology, 20 10, 2010:1一19.
[19] WANG Z,GERSTEIN M. SNYDER M. RNA-Seq:a revolutionarytool for transcriptomics [J]. Nature Reviews Genetics, 2009. 10(1):57-63.
[20] VIEIRA R L,SILVA A L,ZAFFARIG R,et aL Efficient eliminationof virus complex from garlic (Allium sativum L.) by cryotherapy ofshoot tips EJl.Acta PhysioZogiae Plantarum. 2014. 37(1):1-11.
[21] WANG B,WANG R R,CUI Z H,et aL Potential applications ofcryogenic technologies to plant genetic improvement and pathogeneradication EJl.Biotechnology Advances. 2014, 32(3):583-595.
[22] WANG Q C,PANIS B, ENGELMANN F, et al. Cryotherapy of shoottips:A technique for pathogen eradication to produce healthy plantingmaterials and prepare healthy plant genetic resources forcryopreservation [J]. Annals of Applied Biology, 2009, 154 (3):351-363.
[23]何廣深,百子莲胚性愈伤组织超低温保存中钙离子的分布变化及逆境应答机制初探[D].上海:上海交通大学,2014.
HE G S.Distribution change of Ca24- and stress response mechanismresearch of Agapanthus praecox embryogenic callus duringcryopreservation [D]. Shanghai: Shanghai Jiaotong University,2014.(in Chinese)
[24]滕进婧,李梦芸,郭纯,等,冷冻胁迫转金柑MLP2-I基因拟南芥的转录组测序和代谢通路[J].湖南农业大学学报(自然科学版),2018, 44 (4):376-381.
TENG J J,LI M Y,GUO C,et al.Transcriptome sequencing andmetabolic pathway analysis of transgenic MLP2-1 gene in Arabidopsisunder cold stress EJl. Journal of Hunan Agricultural University(Natural Sciences Edition). 2018,44(4):376-381.(in Chinese)
[25]苏谦,安冬,王库.植物激素的受体和诱导基因[J].植物生理学通讯,2008, 44 (6): 1202-1208.
SU Q,AN D,WANG K.Phytohormone receptors and induced genesin plants [J]. Plant Physiology Communications. 2008,44 (6):1202-1208. (in Chinese)
[26] OHRI P,BHARDWAJ R,BALI S G,et al_The common molecularplayers in plant hormone crosstalk and signaling [J]. Current Protein&Peptide Science, 2015, 16(5):369-388.
[27]楊家书,吴畏,吴友三,等.植物苯丙酸类代谢与小麦对白粉病抗性的关系[J].植物病理学报,1986, 16 (3):169-174.
YANG J S,wu w. WU Y S,et al.Relation of metabolism of plantphenylalanine and resistance of wheat to powdery mildew [J].ActaPhytopathologica Sinica, 1986, 16(3):169-1 74.( in Chinese)
[28]陈建中。盛炳成,刘克均,苯丙酸类代谢与苹果对轮纹病抗性的关系[J].果树科学,1986, 16 (3):169-174.
CHEN J Z,SHENG B C,LIU K J,et al_The relation betweenmetabolism of phenylalanine and resistance to Physalospora piricolaNose in apple trees [J].Acta Phytopathologica Sinica, 1986.1 6(3):169-174. (in Chinese)
[29] DUAN PG,RAOYC,ZENGDL,et al.SMALL GRAIN l, whichencodes a mitogen-activated protein kinase kinase 4, influences grainsize in rice [J].The Plant Journal. 2014. 77 (4):547-557.
[30] LIU S Y,HUA L, DONG S J,et al.OsMAPK6,a mitogen-activatedprotein kinase, influences rice grain size and biomass production [J].The Plant Journal, 2015, 84 (4): 672681.
[31] 11YB,FANCC,xrNGYz,et al_ Natural variation in GS5 plays animportant role in regulating grain size and yield in rice[J]. NatureGenetics, 2011, 43 (12): 1266.
[32]苑智华,何秀丽,徐哲,等.唐菖蒲球茎形成期蔗糖和淀粉代谢及其相关酶活性[J].林业科学,2008.44 (8):47-51.
YUAN Z H,HE X L,XU Z, et al.Metabolism and related enzymesactivities of sucrose and starch in the stages of bulb formation ofGladiolus hybridus [J]. Scientia Silvae Sinicae. 2008. 44 (8):47-51. (in Chinese)
[33]孙红梅,何玲,王微微,等.IBA与GA3调控百合鳞片扦插繁殖的“淀粉一蔗糖”代谢机制[J].中国农业科学,2011, 44 (4):798-806.
SUN H M, HE L, WANG W W, et al.Mechanism of starch-sucrosemetabolism regulated by IBA as well as GA3 during scale cuttingpropagation in Lilium [J].Scientia Agricultura Sinica, 2011,44(4):798-806. (in Chinese)
[34] HUJ P,BAKER A, BARTEL B, et al. Plant peroxisomes: Biogenesisand function [J].The Plant Cell, 2012. 24 (6):2279-2303.
[35] SANDALIO L M. RODRfGUEZ-SERRANO M. ROMERO-PUERTAS M C,et al.Role of peroxisomes as a source of reactiveoxygen species (ROS) signaling molecules[C]//Peroxisomes and TheirKey Role in Cellular Signaling and Metabolism, 2013:231 -225.
[36] MITTLER R,VANDERAUWERA S,SUZUKI N, et al.ROSsignaling: The new wave? [J]. Trends in Plant Science. 2011,16 (6):300-309.
[37]于妍,宋万坤,刘春燕,等.植物天冬氨酸代谢途径关键酶基因研究进展[J].生物技术通报,2008( S1):7-11. 17.
YU Y,SONG W K,LIU C Y,et al.Research development of keyenzymes gene on aspartic acid metabolic pathway in plants [J].Biotechnology Bulletin, 2008( S1):7-11,17. (in Chinese)
[38]马瑞肖,张慧杰,李馨慧,等,丝氨酸/甘氨酸代谢在肿瘤中的研究进展[J].现代肿瘤医学,2020. 28 (6):1021-1024.
MA R X,ZHANG H J,LI X H,et aL The progress of serinelGlycinemetabolism in tumor [J]. Journal of Modern Oncology,2020,28 (6): 1021-1024. (in Chinese)
(责任编辑:张梅)
作者简介:尹明华(1973-),女,硕士,副教授,主要从事植物生物技术方面研究(E-mail: yinminghua04@163.com)

