基于DNA甲基化的散发性子宫内膜癌生物学标志物的荟萃分析
范宇,王南,高原,王宇,傅少志,文庆莲
西南医科大学附属医院肿瘤科健康管理部,四川 泸州 646000
子宫内膜癌是源自女性生殖系统的三种主要肿瘤之一。在许多国家,其发病率高于宫颈癌,并且位于妇科恶性肿瘤的第一位[1-2]。子宫内膜癌患者经常出现阴道异常出血;虽然许多患者在疾病仍然局限于子宫时被诊断出来,但大约30%的患者在其晚期被诊断。大多数用于治疗晚期和复发性子宫内膜癌的临床试验仅显示出有限的生存获益,并且在过去几年中死亡率急剧增加[3-4]。异常的遗传学和表观遗传学改变已被广泛认为与子宫内膜癌有关[5-6]。然而,遗传学标记尚未被证实可用于从整体上鉴定疾病,特别是散发性子宫内膜癌。异常DNA甲基化是被最广泛研究的表观遗传修饰之一,在子宫内膜癌中具有关键作用[7-8]。最近已经发现基于基因甲基化的诊断标记,并且已经显示出用于检测子宫内膜癌的可能,而异常DNA启动子甲基化已经被发现是子宫内膜癌的发生早期和广泛的改变[9]。然而,目前缺乏子宫内膜癌的有效诊断生物标志物,并且迫切需要新颖、准确的标志物。既往的研究已经提示了组织样本中异常基因甲基化作为子宫内膜癌的潜在诊断生物学标志物的用途,并且其结果令人鼓舞但是具有差异性。因此,需要通过进一步研究来描述不同抑癌基因中DNA甲基化与散发性子宫内膜癌的临床病理特征间的关联。因此亟待更新关于DNA甲基化和散发性子宫内膜癌这一主题的荟萃分析,原因如下:研究该主题的一些其他研究和试验已经发表,因此可以更全面地综合性分析数据;其他同样适用于研究DNA甲基化在癌症特征描述中的影响(前期研究显示DNA甲基化与临床病理学特征之间仅存在一个显著相关性);子宫内膜癌中潜在的新的抑癌基因已被纳入在内。
1 资料与方法
1.1 文献检索 通过系统的文献检索,确定了DNA甲基化作为散发性子宫内膜癌早期诊断生物学标志物的研究。本研究在PubMed、EBSCO、Google Scholar和Embase数据库中搜索了2018年10月31日之前发布的所有相关的英文文章,并使用以下关键字组合进行文献搜索:[tissue(or)sample(or)specimen(or)circulating cell free DNA(or)cfDNA(or)ctDNA(or)circulating tumor DNA(or)circulating tumor cell(or)CTC(or)blood(or)white blood cell(or)serum(or)plasma](and)[endometrial(or)endometrioid(or)endometrium(or)endometria](and)[neoplasm(or)cancer(or)tumor(or)carcinoma(or)adenocarcinoma(or)malignancy](and)[methylation(or)methylated(or)hypermethylation(or)hypomethylation]。两名研究者独立地进行了评估并通过文章的标题和摘要进行筛选。本文作者对所有研究进行了评估和讨论,直至达到一致的筛选标准。系统回顾和荟萃分析的首选报告项目(preferred reporting items for systematic reviews and meta-analyses,PRISMA)[10]被用作文献搜索过程的模板。
1.2 纳入标准与排除标准 重复的文章在合并数据库中检索的文章后被删除,通过审查标题和摘要进行初步筛选,并且排除了会议摘要、评论和社论,仅有全文形式的原始研究被包括。本研究还排除了不关注组织中DNA甲基化变化,且不是散发性子宫内膜癌检测/诊断背景的文章。在第一轮审查和排除后,根据以下排除标准进一步全文审查以获得最终纳入文献:没有健康正常个体或对照的研究(例如不考虑仅有配对样本或良性疾病的研究);不是病例对照研究;没有报告或无法从公布的数据计算出对散发性子宫内膜癌诊断的敏感性和特异性值的研究;样本量小(n≤10)的研究;以及基于细胞系或动物模型而不是人类临床样本进行的研究。
1.3 数据提取与统计分析 根据纽卡斯尔-渥太华量表(newcastle-ottawa scale,NOS)[11],两名研究者独立审查和评估了符合条件的研究,并且认为被授予五颗星或更多的研究是高质量的。然后,两位作者使用Cochrane协作工具(Cochrane干预系统评价手册5.1.0版)的标准化形式提取以下数据:第一作者、出版年份、地区、样本量、检测技术、生物标志物、改变类型、诊断敏感性和特异性值以及偏倚风险。使用标准化方法评估以下偏倚风险项目:随机顺序生成、分配隐藏、患者和研究人员双盲、结果评估盲法、不完整结果数据、选择性报告和其他偏倚。所有作者通过进一步讨论解决了任何分歧。如果没有明确报告甲基化值,则尽可能从可用的表格或图中提取信息。通过Meta-DiSc分析[12]诊断变量,如敏感性、特异性、阳性似然比(positive likelihood ratio,PLR)和阴性似然比(negative likelihood ratio,NLR),诊断比值比(diagnostic odds Ratio,DOR)和受试者工作特性曲线,以评估散发性子宫内膜癌的甲基化基因的诊断价值或准确性。PLR>5.0和NLR<0.2被认为具有临床意义。DOR代表甲基化基因患者与无甲基化患者相比,子宫内膜癌风险增加。使用Review Manager 5.3分析敏感性和发表偏倚,并使用漏斗图呈现发表偏倚。当I2>50%时,认为存在显著的异质性。如果研究之间存在异质性,则使用随机效应模型合并分析结果;否则采用固定效应模型。
2 结果
2.1 文献特征 系统文献检索的工作流程如图1所示。PubMed、EBSCO、Google Scholar和Embase的主要检索发现了1 448篇文章,其中851篇是重复的文章,再对标题、摘要和全文筛选过滤后,最初获得了134项研究。进一步根据以下标准排除了108项研究:基于使用体外/离体细胞系和人异种移植物13项研究;41项研究没有健康的正常对照;15项不是病例对照研究;33项研究不可提取或计算诊断灵敏度和特异性;6项研究的样本量很小(n≤10)。所有纳入的研究都集中探讨组织DNA甲基化或高甲基化。因此,系统文献检索最终获得了26项研究,包括2 299例参与者(1 676例散发性子宫内膜癌患者和623名正常个体)。没有患者接受过术前化疗、放疗或激素治疗。纳入的研究发表于2001—2018年,分别来自于10个国家或地区(中国、捷克共和国、香港、日本、韩国、荷兰、俄罗斯、斯洛伐克共和国、台湾和美国)(表1)。这些研究的样本量范围为19~156(中位数87)。18项研究评估了单个基因甲基化的诊断价值,5项研究评估多个基因,其他3项研究评估单基因和组合基因。再者,21项研究采用甲基化特异性聚合酶链反应(methylation specific PCR,MSP)检测基因的甲基化情况,3项研究采用结合重亚硫酸盐的限制性内切酶法(combined bisulfite restriction analysis,COBRA),1项采用定量MSP(quantitative methylation-specific PCR,qMSP),1项采用MSP和COBRA分别用于两个基因的检测。DNA甲基化生物学标志物的具体细节及其诊断能力显示在表2中。所有26篇选择性纳入的文章由两位研究者进行评估和检查,并且根据NOS量表观察到均具有高水平的方法学质量(超过五颗星)。

图1 文献检索流程图(截至2018年10月31日)
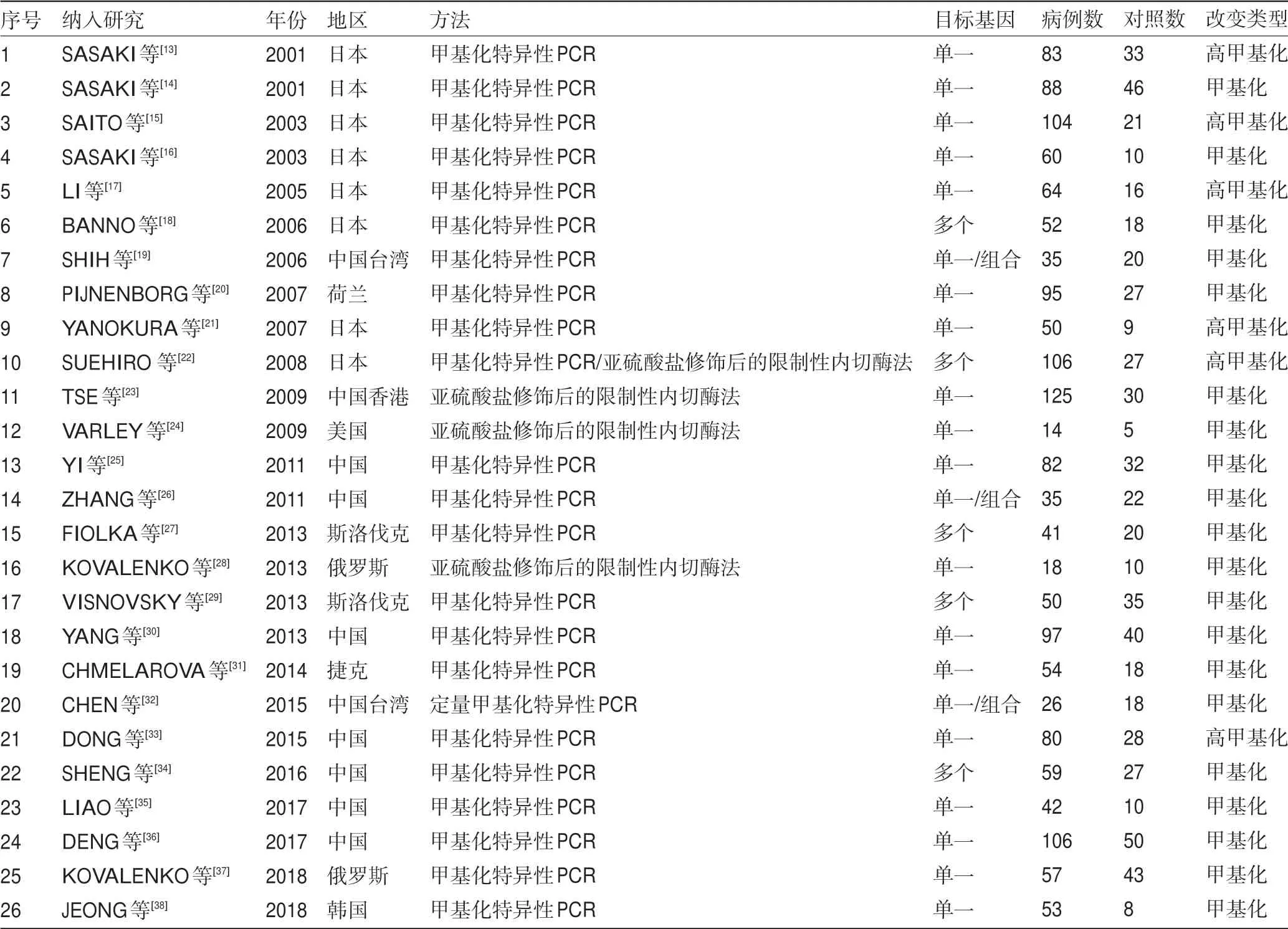
表1 纳入研究文献的主要特征
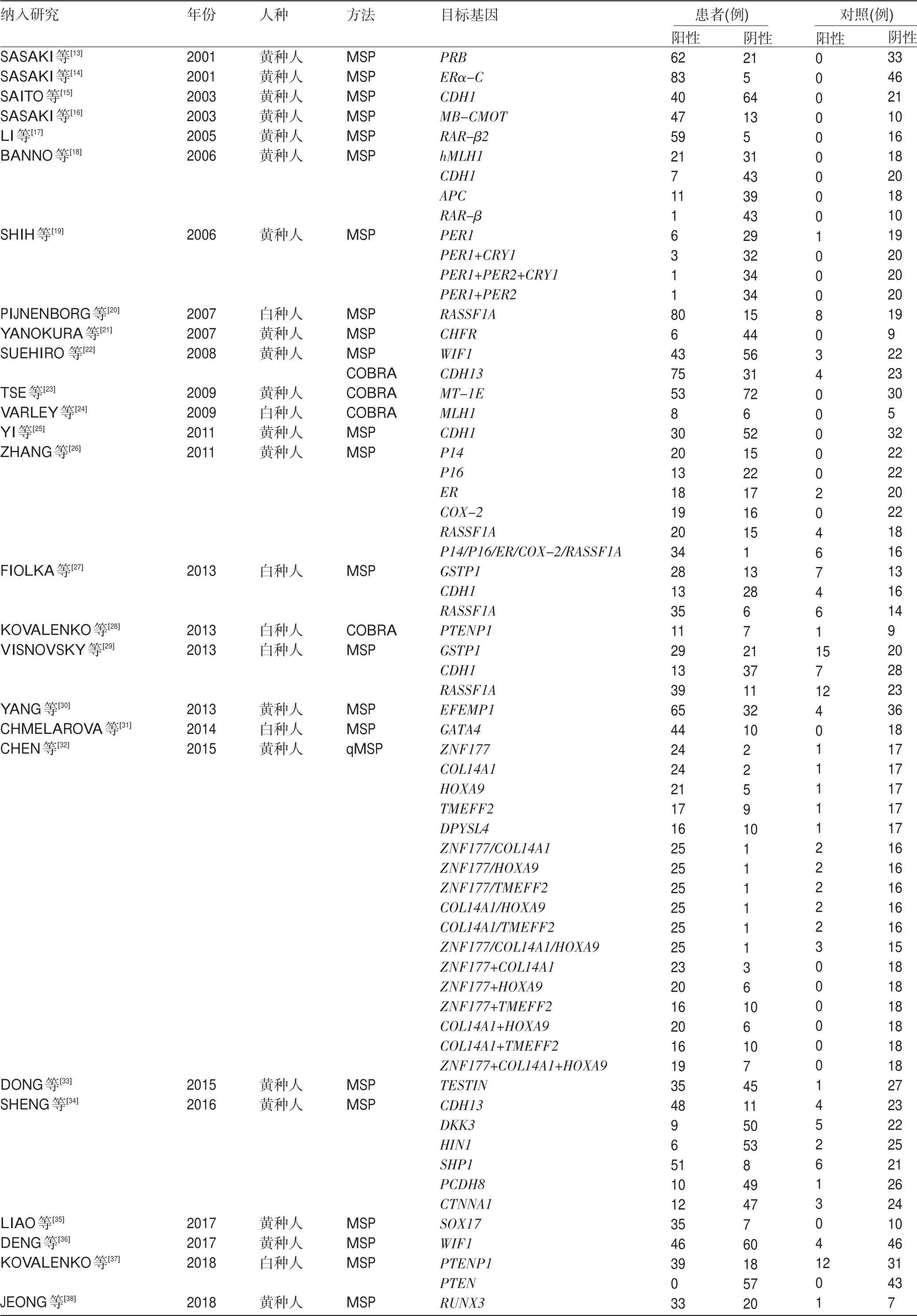
表2 甲基化生物学标志物的具体细节及其诊断能力
2.2 诊断价值的荟萃分析 本研究评估了每项研究的偏倚风险。每个项目的详细评估标准和结果分别显示在表3和图2中,偏倚风险总结在图3中。大多数纳入研究中偏倚的风险高或不明确。4项研究表明参与者顺序是随机产生的。在69%的研究中报告了所有评估的甲基化生物学标志物的诊断值,表明没有选择性报告。9项研究没有其他偏倚,被定义为低风险。本研究合并了26项研究用于诊断准确性的荟萃分析。合并敏感性和特异性分别为0.92(95%置信区间:0.91~0.94)和0.48(95%置信区间:0.46~0.50)(图4)。DNA甲基化的存在对于散发性子宫内膜癌的风险具有相对高的诊断能力(曲线下面积=0.8743)(图5)。阳性拟然比和阴性拟然比分别为1.98(95%置信区间:1.76~2.22)和0.16(95%置信区间:0.11~0.21),合并诊断比值比为17.64(95%置信区间:11.64~26.74)。在这些研究的诊断荟萃分析中观察到显著的异质性(敏感性:I2=70.2%,P<0.001;特异性:I2=86.2%,P<0.001)。根据Spearman相关性分析发现没有显著的阈值效应(P=-0.172,P=0.178)。因此,亚组分析(表4)根据五个不同的参数进行:样本量(≤85与>85)、改变类型(甲基化与高甲基化)、种族(黄种人与白种人)、检测方法(MSP、COBRA与qMSP)和目标基因(单一、任何一种与两种基因)。敏感性的低异质性仅在COBRA亚组(敏感性:I2=44.8%,P=0.143)、qMSP亚组(敏感性:I2=0%,P=0.547)、任何一个基因亚组(敏感性:I2=0%,P=0.920)和两个基因亚组(敏感性:I2=0%,P=1.0)中检测到;而特异性的低异质性在白种人亚组(特异性:I2=42.1%,P=0.069)和任何一个基因亚组(特异性:I2=0%,P=1.0)中被发现。诊断比值比的亚组分析揭示了高甲基化、COBRA、qMSP和任何一个或两个基因的同质趋势(高甲基化:I2=49.9%,P=0.062;COBRA:I2=0%,P=0.871;qMSP:I2=0%,P=0.994;任何一个基因:I2=0%,P=0.998;两个基因:I2=32.65,P=0.157)。这些结果表明甲基化检测方法和基因组合的类型可能有助于降低异质性。表4总结了亚组诊断价值的其他指标。基于这些因素的荟萃回归分析也用于探索可能的异质性来源,如表5所示,只有检测方法才能显著改变诊断价值的异质性(P<0.001)。总之,本研究认为检测方法和基因组合是异质性的主要因素。因此,需要使用不同检测方法的精心设计的研究来阐明基因甲基化在散发性子宫内膜癌中的诊断作用。

表3 偏倚风险的详细标准
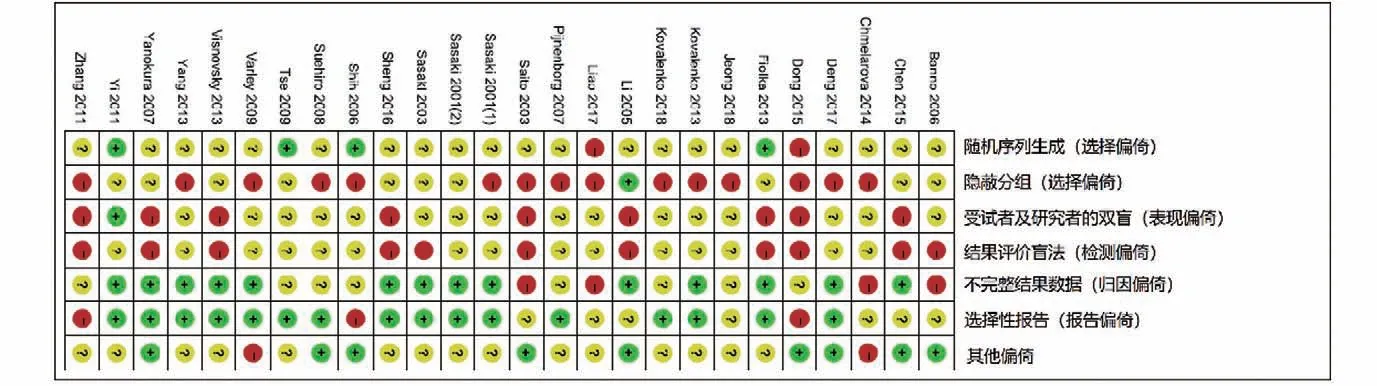
图2 偏倚风险汇总(绿色:低风险;黄色:不确定风险;红色:高风险)
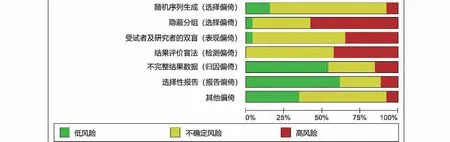
图3 偏倚风险图(对偏倚项目每一风险的判断,以纳入研究的百分比表示)
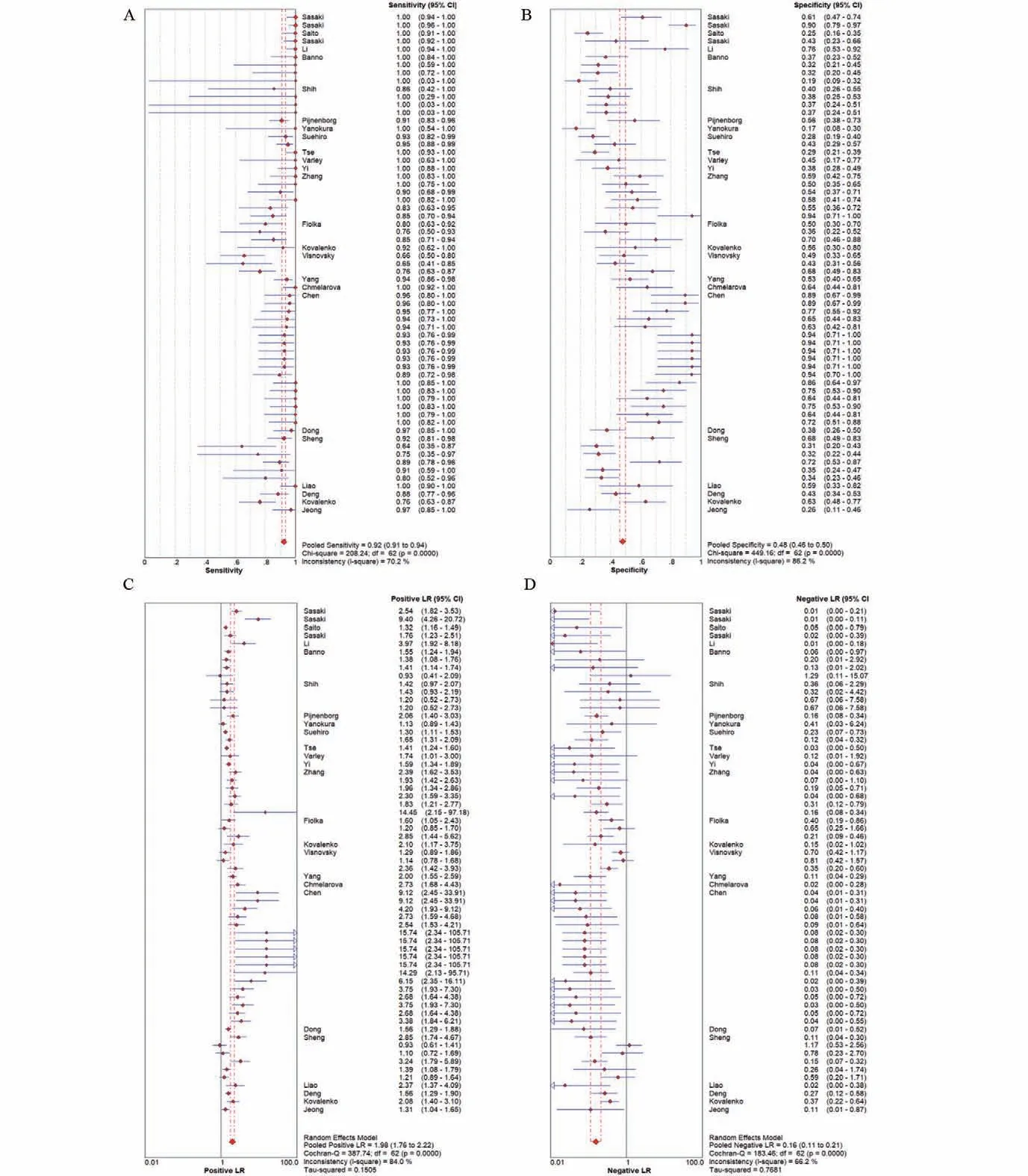
图4 诊断准确性的森林图
2.3 散发性子宫内膜癌患者DNA甲基化与临床病理特征的关系 本研究基于16项不同的研究评估了DNA甲基化与散发性子宫内膜癌患者的几种临床病理特征之间的关联,其中3项涉及多个基因。没有分析与DNA甲基化相关的年龄,因为不同研究的患者之间无统一的年龄界值。甲基化状态与淋巴结转移和肿瘤分期显著性相关(淋巴结阴性/阳性,合并比值比:0.34,95%置信区间:0.19~0.59,P<0.001;Ⅰ~Ⅱ/Ⅲ~Ⅳ,合并比值比:0.62,95%置信区间:0.45~0.85,P=0.003)(表6),提示基因甲基化与散发性子宫内膜癌患者的淋巴结转移和肿瘤分期的风险正相关,因此可能预后相对较差。然而,基因甲基化与体重指数(≤25.9/>25.9,合并比值比:1.04,95%CI:0.44~2.47,P=0.92)、病理类型(子宫内膜样/其他,合并比值比:0.63,95%CI:0.21~1.88,P=0.41)、组织学分级(G1/G2~3,合并比值比:0.82,95%CI:0.46~1.46,P=0.50)和侵袭(<1/2/≥1/2,合并比值比:0.59,95%CI:0.22~1.57,P=0.29)无显著相关性,见图5。
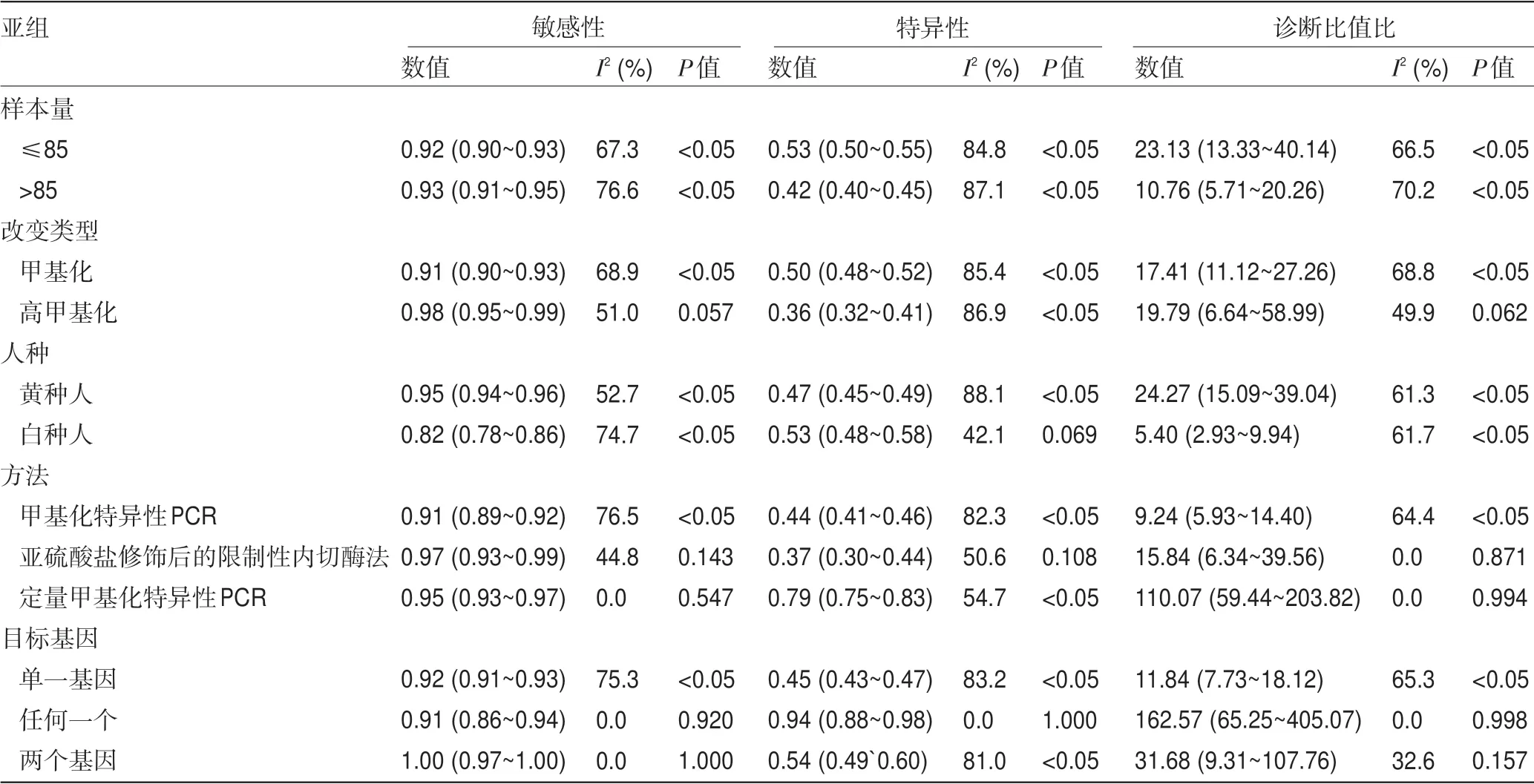
表4 诊断参数的亚组分析

表5 诊断价值的荟萃回归分析
2.4 敏感性分析和发表偏倚 通过一次移除一项研究,进行敏感性分析以评估结果的稳定性。然而,这并未显著影响合并比值比或异质性指数,表明本次荟萃分析的稳定性。漏斗图相对对称,基本没有一项研究落在漏斗外(图6),这表明在散发性子宫内膜癌患者的基因甲基化荟萃分析中没有显著的发表偏倚。
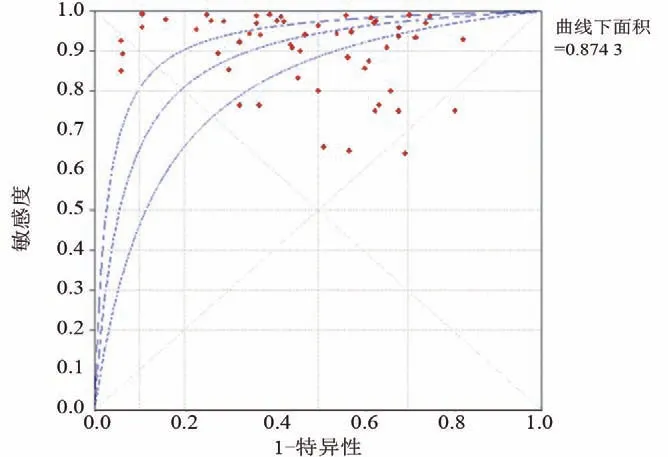
图5 含95%置信区间的受试者工作特性曲线图(summary receiver operating characteristic,SROC)

表6 DNA甲基化与临床病理特征相关性的荟萃分析

图6 评价发表偏倚的漏斗图
3 讨论
DNA甲基化在既往研究中已经证明可能成为子宫内膜癌的生物学标志物,其在子宫内膜癌和正常组织之间显示出明显不同的甲基化模式[39]。DNA甲基化的改变反映了子宫内膜癌发生过程中的基因转录变化。根据最近的综述,许多研究已经探讨了子宫内膜癌中不同基因的异常启动子甲基化[40]。此外,来自一项全基因组甲基化数据的分析提示了DNA甲基化生物学标志物对子宫内膜癌的诊断和预后的效用[41]。尽管与子宫内膜癌相关的DNA甲基化研究目前仍处于临床前阶段,但许多结果提示了其临床用作诊断、预后和治疗反应生物学标志物以及表观遗传治疗靶点的潜力。然而,尽管P16和RASSF1A的异常甲基化对子宫内膜癌诊断具有一定的敏感性和特异性[42-43],但是其他基因(例如ER、PR、MLH1、MGMT、APC和CDH1)的异常甲基化已经显示出用于子宫内膜癌诊断的准确性差异[40]。
本研究基于前期研究,再次评估了散发性子宫内膜癌的甲基化标志物的诊断准确性。总体而言,DNA甲基化对诊断的合并敏感性和特异性分别为0.92和0.48,并且DNA甲基化的存在对于散发性子宫内膜癌的风险具有相对高的诊断能力(曲线下面积=0.8743),但特异性相对较低(0.48)。就敏感性而言,DNA甲基化是化学稳定的,并且在其他肿瘤中显示出高灵敏度[44]。目前的证据表明,甲基化基因优于单独或联合使用的CA125等血清蛋白标志物,CA125诊断灵敏度仅为40%~80%[45-46]。子宫内膜癌的临床诊断目前依赖于超声、磁共振成像和CA125的组合,尽管这些检查手段都不是完全令人满意。CA125通常用作卵巢癌的血清标志物,但也被认为是子宫内膜癌良好的预后标志物[45]。循环肿瘤DNA(circulating tumor DNA,ctDNA)的存在被认为对某些癌症具有高度特异性,主要是因为肿瘤DNA中鉴定的体细胞突变不存在于正常DNA中,而基因甲基化可能发生在正常和癌症DNA中[47]。本研究证实,临床样本中DNA甲基化的检测对子宫内膜癌具有相对较低的诊断特异性(合并特异性:0.48,95%CI:0.46~0.50),这表明需要更具特异性的甲基化基因。
目前的研究包括基因甲基化或高甲基化改变,这可能导致大多数情况下肿瘤抑制基因的异常沉默。与这些类型的基因改变一致,最常见的甲基化检测方法是MSP,其具有包括相对高的灵敏度等各种优点[48]。在本次荟萃分析中,多项研究检测到MLH1、CDH1和RASSF1A基因甲基化。MLH1被确定为异常DNA错配修复和微卫星不稳定性(microsatelliteinstability,MSI)的原因,其功能障碍可能与Lynch综合征(也称为遗传性非息肉病性结直肠癌综合征,hereditary nonpolyposis colorectal cancer syndrome,HNPCC)有关[49]。尽管在许多子宫内膜癌患者中检测到MSI,但其突变频率极低,这表明它可能是MSI阳性子宫内膜癌患者中启动子异常甲基化的结果[18]。此外,除了qMSP,子宫内膜癌的异常DNA甲基化的诊断价值不受所用技术的显著影响,表明这种测定可能显示出更高的特异性。基因甲基化标记物的组合在散发性子宫内膜癌中也显示出潜在的更高的诊断准确性。
本项研究清楚地表明,检测基因甲基化模式可以为散发性子宫内膜癌提供高敏感性但低特异性的诊断方式。子宫内膜癌患者中DNA甲基化的存在可预测淋巴结转移、晚期肿瘤和不佳预后。目前缺乏用于子宫内膜癌诊断和预后的生物学标志物,因此甲基化标志物可用于区分阴道出血异常女性的恶性或非恶性原因。需要尚需进一步的荟萃分析,以使用更为准确的甲基化基因和合适的检测技术,同时迫切需要利用一致性和标准化方法的更多前瞻性研究来解决这些问题。这项研究还存在一些局限性。首先,由于报告阳性结果的倾向性,可能已经发生选择偏倚,并且一些选定文献中相对较小的样本量也可能导致偏倚。此外,使用不同的MSP引物或设备,以及散发性子宫内膜癌中缺乏广泛接受的甲基化基因也可能是偏倚的潜在来源。最后,甲基化相关生存预后及来自宫颈刷等其他部位组织的进一步分析可以帮助在子宫内膜癌中找到潜在的DNA甲基化生物学标志物。

