洋参御糖丸对糖尿病大鼠心肌微血管病变的干预作用
隋艳波,孙 艺,王瑞楠,谢 宁*
(1.黑龙江中医药大学附属第一医院,哈尔滨 150040;2.黑龙江中医药大学,哈尔滨 150040)
糖尿病微血管病变是糖尿病最常见的慢性并发症,更是所有糖尿病患者致死致残最为主要的原因。本研究采用民间验方洋参御糖丸,以前期临床及动物研究证实其治疗糖尿病安全有效为基础[1-2],进一步观察洋参御糖丸对糖尿病大鼠心肌超微结构及血管内皮功能紊乱的干预作用,为洋参御糖丸推广应用奠定理论基础。
1 实验材料
1.1 实验动物 SPF 级健康Wistar 雄性大鼠80 只,体质量(180±20)g,购买自黑龙江中医药大学GCP实验动物中心。所有大鼠自由饮水和进食饲料,适应性喂养1 周,保障实验室空气流通,相对湿度维持在40%~70%之间,温度保持在20~24 ℃之间。
1.2 实验药品 中药饮片包括黄芪、西洋参、玉竹、麦冬、乌梅、白芍、山药、葛根、女贞子、龟板、山茱萸等,上述饮片均购自北京同仁堂科技发展股份有限公司;洋参御糖丸由黑龙江省中西医结合研究所所属制剂室加工生产;盐酸二甲双胍片,商品名:格华止;生产批号:国药准号H20 023370;生产厂家:中美上海施贵宝制药有限公司。
1.3 实验试剂 血糖试纸(美国强生公司);磷酸二氢钠、柠檬酸、丙酮、柠檬酸钠(天津市化学试剂三厂);多聚甲醛、磷酸戊二醛固定液(北京赛驰生物科技有限公司);链脲佐菌素(批号s-0130,AIGMA公司);糖化血红蛋白试剂(南京建成生物工程研究所);二抗PV6001(北京中山生物有限公司);大鼠血管内皮细胞粘附分子1(VCAM-1)免疫组化试剂盒、大鼠血管内皮细胞生长因子(VEGF)免疫组化试剂盒、大鼠糖基化终产物(AGCs)免疫组化试剂盒(北京博奥森生物有限公司)。
1.4 仪器 血糖仪(美国强生公司);电热恒温干燥箱(上海一横有限公司);超低温冰箱(日本三洋公司);组织切片机(2135):德国莱卡;医用微波炉(日本);透射电镜(1220):Olympus 公司。
2 实验方法
2.1 实验动物饲料 普通饲料由黑龙江中医药大学实验动物中心加工生产;高糖高脂饮食饲料配置:在常规普通饲料的基础上,混合加入10%白砂糖、10%蛋黄粉、2%胆固醇和13%猪油,上述饲料混匀后,每周一次由黑龙江中医药大学实验中心加工成颗粒,谨防饲料霉变。
2.2 造模及分组 随机选择10 只Wistar 大鼠作为空白组,给予常规普通饲料饲喂;70 只大鼠高脂高糖饲料连续饲喂8 周后,一次性腹腔注射链脲佐菌素进行糖尿病造模(链脲佐菌素给药剂量:30 mg/kg),72 h 后检测尾静脉血糖,筛选随机连续2 次以上血糖≥16.7 mmol/L 做为糖尿病模型大鼠成功标准,筛选符合上述标准的糖尿病大鼠给予高脂高糖饲料继续饲喂12 周,诱导糖尿病大鼠形成微血管病变。
筛选符合标准大鼠随机分为模型组、洋参御糖丸高剂量组、洋参御糖丸低剂量组以及二甲双胍组进行后续实验。各组大鼠均自由进行摄食和饮水,药物灌胃4 周后进行组织取材和相应指标检测。
2.3 给药方法 各组大鼠每日固定时间灌服相应药物,疗程4 周,结合前期实验结果并参照“人与动物间体表面积折算等效剂量比值表”各组大鼠给药剂量确定如下:二甲双胍组70 mg/(kg·d);洋参御糖丸高剂量组:2.7 g/(kg·d);洋参御糖丸低剂量组1.35 g/(kg·d);空白组大鼠每日同等量蒸馏水;模型组大鼠予相同体积蒸馏水。
2.4 标本采集 灌胃4 周后次日清晨空腹进行标本采集,尾静脉采血测血糖,去眼球收集全血4 mL,3 000转/min,离心5 min,分离保存血清和红细胞备检糖化血红蛋白;乌拉坦麻醉状态下,剪毛备皮消毒,开胸,剪开心包膜,直接暴露心脏,剪断主动脉,迅速取出整个心脏,置于冰袋上,剪去心房和血管,保留左心室心肌,分离切割成3 mm×3 mm×3 mm 心肌块,虑纸拭干血渍,4%多聚甲醛固定液内固定免疫组化指标检测;左心室心肌分离切割成1 mm×1 mm×3 mm 组织块,戊二醛溶液固定,以备电镜检测。
2.5 指标检测 全自动生化仪测定各组大鼠空腹血糖;比色法测定糖化血红蛋白;电镜观察心肌超微结构;免疫组化法检测心肌AGEs、VEGF、VCAM-1:以积分光密度(IOD)代表AEGS、VCAM-1和VEGF的相对表达量,积分光密度(IOD)=阳性面积×平均光密度。
2.6 统计分析 实验数据采用SPSS 20.0 进行统计和分析,计量资料用均数±标准差()表示,各组大鼠组间比较满足方差齐性时采用方差分析,方差不齐则采用T 检验。
3 结果
3.1 洋参御糖丸对糖尿病大鼠糖代谢及糖化血红蛋白的影响 见表1。
表1 洋参御糖丸对糖尿病大鼠糖代谢及糖化血红蛋白的影响()

表1 洋参御糖丸对糖尿病大鼠糖代谢及糖化血红蛋白的影响()
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05;与二甲双胍组比较,▲P <0.05
模型组大鼠血糖、HbA1C较空白组显著升高(P<0.05);二甲双胍组大鼠以及洋参御糖丸高剂量组和洋参御糖丸低剂量组均不同程度降低大鼠血糖、糖化血红蛋白,与模型组相比差异显著(P<0.05);而且二甲双胍组在降低血糖、糖化血红蛋白方面的作用明显优于洋参御糖丸组,差异有统计学意义(P<0.05)。
3.2 洋参御糖丸对糖尿病大鼠心肌超微结构的影响 见图1~5。透射电镜下观察空白组大鼠心肌结构清晰,肌纤维排列整齐,闰盘链接规整;细胞核结构完整,形态一致;线粒体清楚;明暗带分布均匀清晰;肌丝排列整齐,微血管数目正常,微血管基底膜未见增厚。模型组心肌细胞核畸形,结构紊乱;闰盘扭曲、断裂,形态参差不齐;肌原纤维明显减少,明暗带模糊,Z 线和M 线看不清,部分肌丝及基质溶解;线粒体肿胀,结构不清,甚至空化,大小及形状不一致;心肌微血管数目明显增加,但完整清晰的微血管数目较少,基底膜明显增厚。二甲双胍组大鼠肌原纤维排列整齐,肌丝结构正常,明暗带清楚,细胞核椭圆形,结构正常;线粒体大小及形态一致,结构清晰,心肌微血管数目及基底膜厚度正常。洋参御糖丸高剂量组大鼠肌原纤维排列整齐,Z 线和M 线清楚,可见明暗带;细胞核结构完整清晰;线粒体排列规整,部分肿胀,未见空泡化;闰盘链接较完整;与模型组比较,心肌微血管数目增多,但未见明显基底膜增厚。低剂量组大鼠心肌细胞核及线粒体结构完整,排列均匀,肌原纤维轻度减少,闰盘链接尚算完整,仅见少量肌丝断裂,部分线粒体肿胀,微血管数目尚可,基底膜厚度轻度增加。

图1 各组大鼠电镜下心肌细胞超微结构
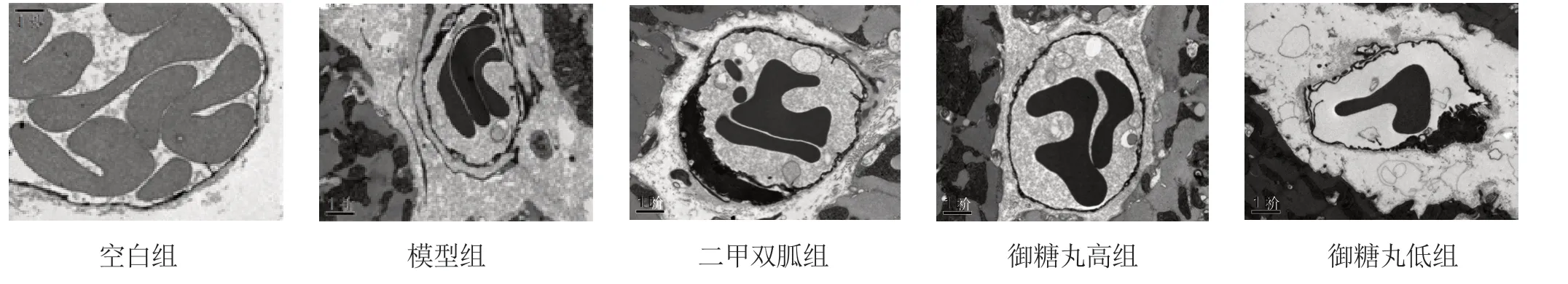
图2 各组大鼠电镜下心肌微血管形态
3.3 洋参御糖丸对糖尿病大鼠心肌AGEs、VEGF、VCAM-1 的影响 见表2。本研究结果显示糖尿病心肌病模型大鼠心肌AGEs、VEGF、VCAM-1 表达水平较空白组明显增加,差异有统计学意义(P<0.05);空白组仅有少量上述物质表达;二甲双胍和洋参御糖丸高剂量组大鼠心肌AGEs、VEGF、VCAM-1 表达水平较糖尿病心肌病模型组大鼠显著下降,差异有统计学意义(P<0.05);洋参御糖丸低剂量组上述指标表达水平下降并不明显(P>0.05)。
4 讨论
根据各医家对糖尿病微血管病变的认识以及临床经验,在该病辨证论治方面尚无一致的结论和标准,脉络中的孙络在形态和功能上与微血管基本一致,络病思想符合糖尿病微血管病变特点。临床研究表明,中医药在防治糖尿病微血管病变中有着较好的疗效优势[3-4]。洋参御糖丸中君药为西洋参、黄芪,臣药为山药、山茱萸,诸药合用共同起到益气养阴、补脾益肾之功效。此方经过长期临床应用表明其对糖尿病慢性并发症具有良好的功效[5-6]。
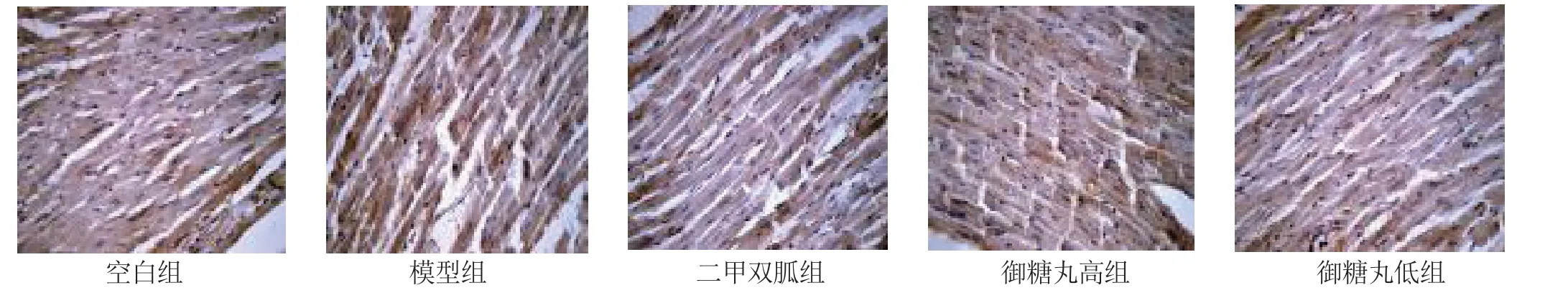
图3 各组大鼠心肌AGEs
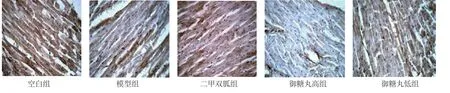
图4 各组大鼠心肌VCAM-1

图5 各组大鼠心肌VEGF
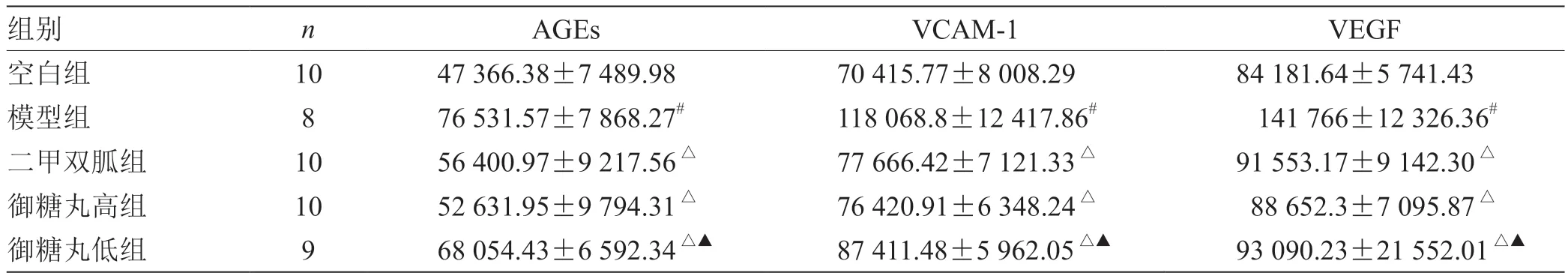
表2 洋参御糖丸对糖尿病大鼠心肌AGEs、VEGF、VCAM-1 的影响
糖尿病心肌微血管病变主要病理特征为微血管内皮损伤、管壁通透性增加、微血管基底膜增厚、舒缩功能障碍,微血栓形成,最终导致管腔狭窄甚至闭塞。VCAM-1 会增加内皮细胞间的黏附效应,参与组织修复、炎症反应、血栓形成等病理生理过程;VEGF 在促进血管内皮细胞增殖、分化及迁移的同时,还会增加血管通透性,进而影响血液动力学。AGEs 积聚造成细胞间通透性增高,内皮细胞间氧弥散功能降低,导致微血管内皮细胞增殖和微血管功能退化。高糖高脂联合腹腔注射链脲佐菌素建立的糖尿病大鼠模型具有典型的心肌微血管损伤病理特点。洋参御糖丸高剂量组治疗后糖尿病大鼠血糖、HbA1C均有所下降;心肌纤维排列整齐,肌丝结构正常,细胞核线粒体结构清晰,心肌微血管数目正常,表明本方在降糖同时能够修复心肌超微结构的损伤;大鼠心肌AGEs、VEGF、VCAM-1 表达显著下降,说明洋参御糖丸具有降低AGEs、抑制病理性微血管促新生效应、抑制促内皮细胞黏附积聚作用,进而可能延缓糖尿病微血管病变进程。前期研究亦表明,洋参御糖丸能够降低微血管通透性、清除心肌自由基、提高心肌抗氧化能力[7],表明该方具有防治糖尿病微血管病变的功效。现代药理学研究表明,洋参御糖丸方中主要药味及其有效成分均有降糖及改善微血管病变作用,西洋参茎叶皂苷及葛根素有调脂、降糖、改善胰岛素敏感性和改善心肌缺血作用[8-11],另外可以调节高糖损伤血管内皮细胞PI3K/Akt 信号通路[12];黄芪活性成分、黄芪甲苷、黄芪多糖均有调节血糖、抗氧化及改善内皮细胞功能作用[13-16];山茱萸环烯醚萜总苷、女贞子提取物总三萜酸、女贞子中齐墩果酸具有调节糖脂代谢,改善血流变,恢复血管收缩与舒张功能作用[17-20];综上所述,洋参御糖丸具有调节血糖,修复高糖损伤心肌病理结构的作用,可能通过减少血管内皮细胞与单核细胞黏附以及抑制血管内皮细胞增殖来减缓血管内皮细胞功能紊乱,进而改善糖尿病心肌微血管病变。

