响应面优化超声辅助裸燕麦蛋白/β-葡聚糖糖基化改性工艺
蒋 琳,杨志伟
(广西大学轻工与食品工程学院,广西高校特色农产品精深加工与安全控制重点实验室,广西南宁 530004)
裸燕麦俗称莜麦,是燕麦的一种,营养价值高,其中蛋白含量约13%~17%,是大米的3倍,面粉的1.6倍,具备人体所含的8种必需氨基酸,有“超级谷物”之称[1]。裸燕麦蛋白含量在谷物蛋白中居于首位,其中球蛋白含量超过50%。由于裸燕麦蛋白本身的理化性质较差,致使裸燕麦的加工特性低,限制其研发与应用[2-3]。为了改良裸燕麦蛋白的相关理化性质,并使之具有一定功能性,扩宽裸燕麦资源的开发前景,可以对裸燕麦蛋白进行改性处理[4]。而糖基化改性是较为理想的一种改性方式,是在没有任何化学试剂参与下,通过蛋白质或多肽的游离氨基与还原糖中羟基化合物在常温或者加热时发生的共价结合的美拉德改性,生成蛋白-糖共价复合物[5]。
β-葡聚糖,一种结构性非淀粉多糖,是葡萄糖通过β-(1→3),(1→4)糖苷键连接而成的高分子聚合物,特有的高黏性使其与蛋白质复合能增加乳化液的乳化稳定性,增强蛋白凝胶性,且具有降低血糖,增强免疫力的功效[6-7]。然而,β-葡聚糖作为一种功能性优越的多糖,在蛋白质的糖基化改性中应用较少[8]。
此外,在近年来的研究中发现,超声波技术处理产生的热效应、剪切力、空化作用等对于提高改性速率,改善产物性质有着重要的作用[9]。目前,关于超声波辅助糖基化改性的研究多集中在谷物蛋白与葡萄糖、乳糖等小分子糖的复合,对于蛋白与分子量较大的葡聚糖的糖基化改性的工艺研究以及相关理化和功能性质的研究较少[4,10-12]。因此,本文将采用超声波辅助裸燕麦蛋白与β-葡聚糖进行糖基化改性,研究超声处理对裸燕麦蛋白分子结构和溶解特性的影响,使溶液体系中的自由氨基数量增多,更多的游离氨基与β-葡聚糖发生共价结合,从而促进糖基化产物的生成。研究不同反应条件(超声功率、超声时间、超声温度、β-葡聚糖与裸燕麦蛋白质量比)对裸燕麦蛋白糖基化改性的影响,通过响应面优化得到最优工艺条件,为后续糖基化改性产物的理化和功能性的研究提供基础[13-14]。
1 材料与方法
1.1 材料与仪器
裸燕麦米 市售;β-葡聚糖(≥98%) 西安千叶草生物科技有限公司;邻苯二甲醛(O Phthalic Aldehyde,OPA) 源叶生物有限公司;十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、无水碳酸钠(≥99.8%) 天津博迪化工股份有限公司;酒石酸钾钠、四硼酸钠 分析纯,天津市大茂化学试剂厂;氢氧化钠、硫酸铜 分析纯,成都金山化学试剂有限公司;甲醇 分析纯,成都市科隆化学品有限公司;Folin-酚 北京索莱宝科技有限公司。
HH-S6数显恒温水浴锅、HJ-3控温磁力搅拌器 江苏金怡仪器科技有限公司;TLE204E分析天平 上海梅特勒-托利多仪器有限公司;JAC-300N型数控超声波清洗机 山东省济宁市奥波超声电气有限公司;TECAN酶标仪 上海勒菲生物科技有限公司。
1.2 实验方法
1.2.1 裸燕麦蛋白的制备 裸燕麦粉碎过40目筛,正己烷1∶3 (W/V)振荡脱脂,过滤后在通风橱下放置,待正己烷挥发完全后即可。脱脂裸燕麦粉与蒸馏水按1∶13 (W/V)的比例混合,用0.5 mol/L NaOH调节溶液pH至10,40 ℃下磁力搅拌90 min,4000 r/min离心20 min,取上清液[15]。用 1 mol/L HCl调节上清液pH至4.3,静置30 min后4000 r/min离心20 min,沉淀物水洗两次调pH至7,透析48 h后冷冻干燥。
1.2.2 裸燕麦蛋白/β-葡聚糖糖基化复合物的制备 称取一定量的裸燕麦蛋白(精确到0.001),用pH为7的磷酸盐缓冲溶液配制浓度为1%的蛋白溶液,按照一定的糖/蛋白质量比加入β-葡聚糖,磁力搅拌20 min使溶液混合均匀。密封后放入超声装置中,在一定的超声功率、一定的超声温度下进行糖基化改性反应,反应一定时间后取出冰浴冷却。5000 r/min离心20 min,将上清液冷藏备用[16]。
1.2.3 单因素实验设计 为了使裸燕麦蛋白与β-葡聚糖糖基化反应更完全,接枝度更高,糖基化产物理化性质更好,本实验采用超声波辅助工艺,通过超声处理改变裸燕麦蛋白的溶解特性,使体系中的自由氨基增多,促进β-葡聚糖与裸燕麦蛋白的共价结合[10]。因此,本实验的单因素实验以溶解度和接枝度为指标,探究超声波处理对裸燕麦蛋白糖基化改性的影响,为最优实验条件的确定提供依据。
1.2.3.1 超声功率对裸燕麦蛋白/β-葡聚糖糖基化改性的影响 在β-葡聚糖与裸燕麦蛋白质量比2∶1、超声温度70 ℃、超声时间60 min、pH7.0条件下,以接枝度和溶解度为指标,研究超声功率在0、120、180、240、300 W条件下对裸燕麦蛋白糖基化改性的影响。
1.2.3.2 超声时间对裸燕麦蛋白糖基化改性的影响 在质量比2∶1、超声温度70 ℃、超声功率240 W、pH7.0条件下,以接枝度和溶解度为指标,研究超声时间在0、30、60、90、120 min条件下对裸燕麦蛋白糖基化改性的影响。
1.2.3.3 超声温度对裸燕麦蛋白糖基化改性的影响 在质量比2∶1、超声功率240 W、超声时间60 min、pH7.0条件下,以接枝度和溶解度为指标,研究超声温度在50、60、70、80、90 ℃条件下对裸燕麦蛋白糖基化改性的影响。
1.2.3.4β-葡聚糖与裸燕麦蛋白质量比对裸燕麦蛋白糖基化的影响 在超声功率240 W、超声时间60 min、超声温度70 ℃、pH7.0条件下,以接枝度和溶解度为指标,研究β-葡聚糖与裸燕麦蛋白质量比在1∶2、1∶1、2∶1、3∶1、5∶1条件下对裸燕麦蛋白糖基化改性的影响。
1.2.4 响应面优化试验设计 在单因素实验的基础上,选取超声时间、超声功率、超声温度、β-葡聚糖与裸燕麦蛋白质量比作为自变量,根据 Box-Behnken 设计建立四因素三水平试验,以接枝度为响应值,通过响应面分析对裸燕麦蛋白与β-葡聚糖的接枝条件进行优化,确定最优糖基化改性工艺条件。水平设计见表1。

表1 响应面因素水平设计表Table 1 Factors and levels of RSM
1.2.5 接枝度的测定 称取40 mg的OPA溶于1 mL甲醇中,分别加入20%(W/V)SDS溶液2.5 mL,0.1 mol/L硼砂溶液25 mL,β-巯基乙醇100 μL,混合均匀后用蒸馏水定容至50 mL,得到OPA试剂。取4 mL OPA试剂于试管中,加入200 μL糖基化后的上清液,混合均匀后于35 ℃水浴2 min,在340 nm处测定溶液吸光值,同时作空白对照[15]。
接枝度(%)=[A1-(A2-A0)]÷A1×100
式中:A1-相同条件下未参与糖基化改性的溶液吸光度值;A2-糖基化改性后溶液吸光度值;A0-相同条件下糖空白对照溶液的吸光度值。
1.2.6 溶解度的测定 采用福林酚法[16]测定上述上清液中溶解的蛋白含量。

1.3 数据处理
实验数据为5次重复的均值,均以“平均值±标准误差”表示。数据采用Origin 8.0与Design Expert 8.0.6软件进行分析和图像处理。用SPSS 20.0软件进行差异显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声功率对裸燕麦蛋白糖基化改性的影响 从图1可以看出,随着超声功率的增加,裸燕麦蛋白糖基化改性的接枝度和溶解度呈先增大后减小的趋势。当超声功率达到240 W时,接枝度为最大值32.36%±1.16%,溶解度达到12.87%±0.12%,之后随着超声功率的增大,接枝度和溶解度都逐渐减小。这可能是因为超声处理产生的空化效应、热效应和机械剪切作用使得蛋白质分子发生机械性振荡,蛋白质空间结构遭到破坏,使原本有序的螺旋结构中次级键断裂,肽链打开,蛋白质的分子结构疏松[17],同时,超声处理使得蛋白质分子表面的自由氨基和羧基之间的静电引力被打断,蛋白质分散开来,随着超声功率的增大,蛋白质溶解度增大,溶液体系中自由氨基增多,接枝改性结合位点也相应增多,接枝度增大[18]。但是,过大功率的超声处理产生的热效应会使得蛋白局部温度过高,使得原本展开的肽链发生聚合,使得蛋白溶解度减小。接枝改性位点被掩盖,使得蛋白糖基化改性受阻[19],接枝度下降。

图1 超声功率对裸燕麦蛋白 糖基化改性接枝度和溶解度的影响Fig.1 Effects of ultrasonic power on the degree of grafting and solubility of OP glycosylation
2.1.2 超声时间对裸燕麦蛋白糖基化改性的影响 从图2可以看出,随着超声时间的不断增加,裸燕麦蛋白糖基化改性体系中,接枝度先增大后减小,在超声时间为90 min时,接枝度达到最大值32.59%±1.34%。溶解度在90 min时达到12.3%±0.18%,之后趋于平缓。这可能是因为超声波产生的空化作用和热效应使得蛋白质的空间结构疏松[20],蛋白质分子的扩散速率增大,增强了蛋白的溶解性,同时也增加了自由氨基与β-葡聚糖分子的碰撞机率,接枝度升高。但当超声时间过长时,使得原本断裂的肽链重新聚合,蛋白的疏水性基团增多,溶解度降低[21-22],同时,可与糖分子结合的自由氨基位点被掩埋,接枝度下降。

图2 超声时间对裸燕麦蛋白 糖基化改性接枝度和溶解度的影响Fig.2 Effects of ultrasonic time on the degree of grafting and solubility of OP glycosylation
2.1.3 超声温度对裸燕麦蛋白糖基化改性的影响 从图3可以看出,随着超声温度的升高,接枝度呈现先增高后缓慢下降的趋势。当温度在70 ℃时,接枝度达到最大值33.49%±1.66%。溶解度在70~80 ℃之间下降,80~90 ℃开始上升(通过差式扫描量热仪测得,裸燕麦蛋白变性温度为89 ℃)。这可能是由于随着改性的进行,蛋白质分子与β-葡聚糖结合,引入了亲水性羟基,在一定程度上从空间上保护了蛋白质,使蛋白质不易聚集,溶解度增大[22]。溶液体系中自由氨基增多,接枝改性速率也就增大。随着温度的升高,改性进一步进行,裸燕麦蛋白糖基化改性进入美拉德最终阶段,产物进一步反应生成类黑精,并与蛋白质发生交联作用阻碍了糖基化改性的进行[22-23]。同时,高温使得蛋白质发生变性,空间结构被破坏,链与链之间的分子间氢键容易聚集成团,不易被溶解[24],从而使得溶解度和接枝度降低。

图3 超声温度对裸燕麦蛋白 糖基化改性接枝度和溶解度的影响Fig.3 Effects of ultrasonic temperature on the degree of grafting and solubility of OP glycosylation
2.1.4β-葡聚糖与裸燕麦蛋白质量比对裸燕麦蛋白糖基化的影响 从图4可以看出,随着溶液体系中糖浓度的增高,接枝度先增大后减小。当糖/蛋白质量比为2∶1时,接枝度达到最大值31.66%±0.76%,随后接枝度缓慢下降。这可能是因为在适当的糖浓度范围内,糖浓度的增大使得自由氨基与β-葡聚糖分子羟基的碰撞结合机率增大,促进接枝改性的进行,接枝度增大[25]。然而,当糖浓度过高,溶液粘性变大,流动性变小,使得分子间的相互作用缓慢。另外,由于β-葡聚糖为大分子糖,过高的糖浓度产生的空间位阻效应进一步阻碍了接枝改性的进行[26]。同时,溶解度随着糖浓度的增高而增大之后趋于平稳。这可能是由于接枝度的增大引入了更多的亲水性基团,但当接枝改性受阻后,溶液体系处于饱和状态,溶解度趋于平缓[27]。
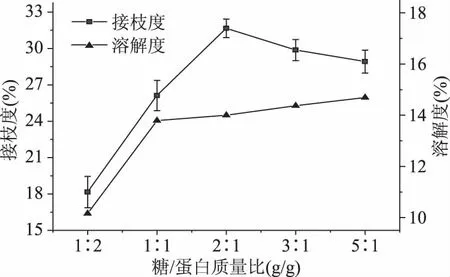
图4 糖/蛋白质比对裸燕麦蛋白 糖基化改性接枝度和溶解度的影响Fig.4 Effects of mass ratio on the degree of grafting and solubility of OP glycosylation
2.2 响应面法实验结果与分析

表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken design with experimental results

对响应面实验结果进行多元二次回归分析,可以获得接枝度关于超声功率A、超声时间B、超声温度C、糖/蛋白质量比D的二次多元回归方程为:
接枝度(%)=37.29+1.85A+4.93B+0.031C-1.288D+0.84AB+1.50AC+1.36AD+1.36BC+1.76BD+2.97CD-11.22A2-5.38B2-3.22C2-4.62D2
2.2.2 响应面图和等高线图分析 图5~图10分别给出了超声功率、超声时间、超声温度、糖/蛋白质量比对糖基化改性裸燕麦蛋白接枝度影响的响应曲面图和等高线图。从响应面图可知,在因素较低水平条件下响应值随着每个因素的增大而增大,当响应值增大到极值后,又逐渐减小。由表3和图5分析可知,在响应组合试验中,超声时间B不显著(P>0.05),对裸燕麦蛋白糖基化改性的接枝程度影响不大,在一定时间内,随着超声温度的升高,接枝度呈现先增大后减小的趋势,且超声温度C的一次项极显著(P<0.0001)影响接枝度大小。同时,BC响应面的等高线图密集呈椭圆状,由此也说明超声时间和超声温度的交互作用显著,交互作用对接枝度影响较大。从表3和图6~图10可知,超声功率A、超声时间B、糖/蛋白质量比D的一次项均极显著(P<0.0001)影响裸燕麦蛋白糖基化改性的接枝程度。同时,由方差表中可以看出,AB、AC、AD、BD、BC的交互项都呈现极显著性(P<0.0001),且等高线图呈椭圆状,表明AB、AC、AD、BD、BC的交互项均极显著影响接枝度的大小。

表3 响应面回归模型方差分析Table 3 ANOVA for the regression model
注:*:P<0.05表示显著,**:P<0.01表示极显著。
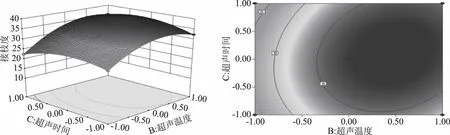
图5 超声时间与温度交互作用对接枝度影响的曲面图和等高线图Fig.5 Surface and contour plots of mutual-influence of ultrasonic time and ultrasonic temperature on grafting reaction

图6 超声温度与糖/蛋白质量比交互作用对接枝度影响的曲面图和等高线图Fig.6 Surface and contour plots of mutual-influence of ultrasonic temperature and sugar/protein mass ratio on grafting reaction

图7 超声时间与糖/蛋白质量比交互作用对接枝度影响的曲面图和等高线图Fig.7 Surface and contour plots of mutual-influence of ultrasonic time and sugar/protein mass ratio on grafting reaction

图8 超声功率与糖/蛋白质量比交互作用对接枝度影响的曲面图和等高线图Fig.8 Surface and contour plots of mutual-influence of ultrasonic power and sugar/protein mass ratio on grafting reaction

图9 超声功率与温度交互作用对接枝度影响的曲面图和等高线图Fig.9 Surface and contour plots of mutual-influence of ultrasonic power and ultrasonic temperature on grafting reaction

图10 超声功率与时间交互作用对接枝度影响的曲面图和等高线图Fig.10 Surface and contour plots of mutual-influence of ultrasonic power and ultrasonic time on grafting reaction
通过软件Design-Expert 8.0对方程求极大值,得出超声辅助裸燕麦蛋白糖基化改性的最优理论条件为超声功率240.93 W,超声时间94.20 min,超声温度74.86 ℃,糖/蛋白质量比2.11∶1,此时接枝度为37.33%±1.68%。结合到实际操作的可行性,选择以下实验条件:超声功率240 W,超声时间95 min,超声温度75 ℃,糖/蛋白质量比2∶1。在此条件下,进行三次平行验证实验得到裸燕麦蛋白糖基化改性的接枝度为35.79%±0.86%。达到预测值的95.03%,与未超声处理,加热温度75 ℃,加热时间95 min,糖/蛋白质量比2∶1,条件下的接枝度15.3%±0.63%相比,提高了2.34倍。
3 结论
本实验讨论了不同改性条件对裸燕麦蛋白糖基化改性中接枝度的影响,通过单因素及响应面优化设计建立了超声辅助裸燕麦蛋白糖基化改性工艺的模型,并对此模型进行了优化,得到裸燕麦蛋白糖基化改性的最优工艺条件为超声时间95 min,超声功率240 W,超声温度75 ℃,糖/蛋白质量比2∶1,在此条件下,糖基化改性的接枝度达35.79%±0.86%,约为未超声条件下(温度75 ℃,加热时间95 min,糖/蛋白质量比2∶1,接枝度为15.3%±0.63%)的2.34倍。采用超声波辅助蛋白质糖基化改性,成本低,效率高。同时,最优工艺条件下的裸燕麦蛋白糖基化改性产物的制备也为后续研究其理化和功能性提供基础,有利于裸燕麦蛋白资源在食品中的开发和利用,提高经济效益。

