苦参碱对阿尔茨海默症学习记忆功能的影响及脑内氧化应激水平的变化
郑双佳,魏成喜
(内蒙古民族大学,内蒙古 通辽 028000)
0 引言
本文将结合苦参碱对阿尔茨海默症学习记忆功能的影响与对脑内氧化应激水平的变化结合大鼠试验进行观察研究与分析。
1 资料与方法
1.1 一般资料
选用PC12细胞分别加入不同浓度Aβ25-35进行MTT实验,然后确定最终造模浓度;选用大鼠进行本项试验,并将大鼠随机分为5组,分别是空白组、模型组、模型+低剂量组、模型+中剂量组与模型+高剂量组,对大鼠的学习记忆功能以及脑内氧化应激水平的变化进行研究分析。
1.2 方法
1.2.1 实验动物
SD大鼠60只,雄,体重于180~220 g,各组大鼠均符合试验动物合格标准,分5组饲养,给予相同大鼠饲料,可自由饮水,温度恒定25 ℃。
1.2.2 细胞活性实验
PC12细胞,5000/孔进行铺板;第2天:换液、加Aβ25-35,分 别 为0.125 μM、0.25 μM、0.5 μM和1 μM;孵育48 h后进行MTT读板,观察细胞活性实验模型损伤达50%即为造模成功,确定最终造模浓度。
1.2.3 药品
苦参碱(河南莱尔因生物科技有限公司,国药准字L161216),1 g/支,纯度为98%,溶剂为乙醇,试验剂量分别为0.1 mg/mL、0.5 mg/mL和1 mg/mL。
1.2.4 仪器
二氧化碳保温箱进行培养,并结合倒置生物显微镜、台式低速自动平衡离心机、海尔冰箱、洁净工作台作为试验仪器准备、凝胶成像分析系统、ELISA(酶联免疫吸附实验)检测仪、MDA(丙二醛)试剂盒、SOD(超氧化物歧化酶)试剂盒;将Aβ25-35(品牌:aladdin,货号:A107853,批号:J1617015,规格:5 mg,纯度:97%,分子量:1059)注入大鼠大脑皮质内,观察注射部位组织的变化。
表1 苦参不同剂量()
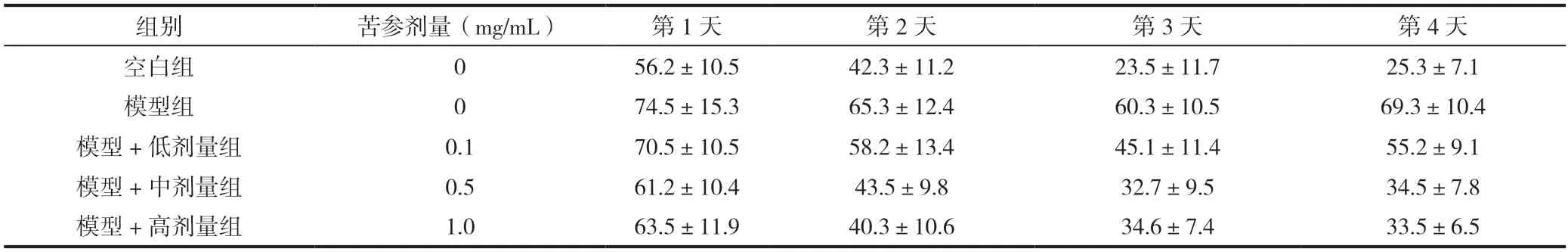
表1 苦参不同剂量()
1.3 疗效标准
观察细胞活性实验模型损伤达50%即为造模成功;观察Aβ25-35注射部位组织的变化;观察苦参碱对大鼠脑组织中MDA含量以及SOD活性的影响。
1.4 统计学方法
将数据纳入SPSS 17.0软件中分析,计量资料采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 MMT实验确定Aβ25-35最终造模浓度
观察细胞活性实验模型损伤达50%即为造模成功,确定最终Aβ 浓度为0.5 μM,详见图1。
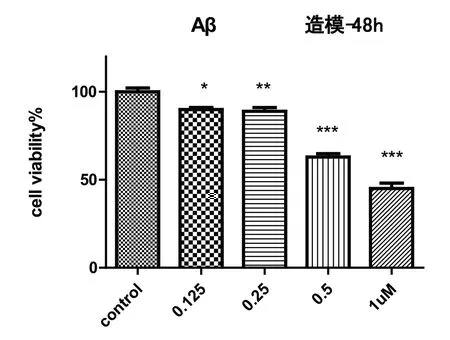
图1 Aβ25-35造模48 h浓度
2.2 观察Aβ25-35观察注射部位组织的变化
模型组将0.5 μM Aβ25-35注入大鼠的大脑皮质,结果发生注射部位的组织坏死,同时周围的神经元发生缺失以及神经角质的增生。
与空白组相比,应用苦参碱的各组大鼠的学习记忆功能明显更好,同时大鼠脑内氧化应激水平降低,苦参碱各组也要明显优于空白组,见表1。
与空白组相比,模型组MDA含量以及SOD活性显著降低,其中模型+高剂量组与模型+低剂量组对比MDA含量以及SOD活性显著降低,差异显著(P<0.05),有统计学意义,表明苦参碱的剂量依赖性能够显著降低大鼠脑组织的氧化应激水平,详见表2。
表2 苦参碱对于大鼠脑组织MDA含量以及SOD活性比较的影响()
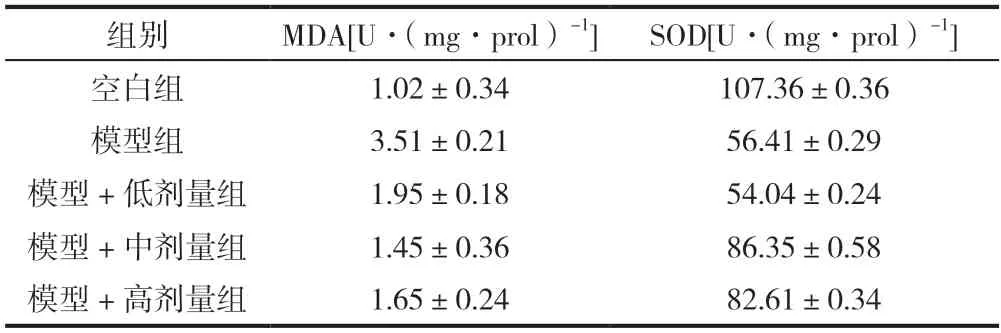
表2 苦参碱对于大鼠脑组织MDA含量以及SOD活性比较的影响()
3 讨论
苦参碱是一种生物碱,由苦参的干燥根、植株与植柱以及乙醇等有机溶剂提取而来,苦参碱具有利尿、抗病原体以及抗HBV及降酶、抗炎抗过敏、抗肝纤维、抗病原体、抗肝炎病毒的作用,还对免疫系统的调节作用同时苦参碱具有良好的生物安全性与耐受性,通常无毒副反应。结合本次实验研究,在对大鼠进行实验时,应用不同剂量,也可产生不同效用[1-5]。
Aβ 是指β-淀粉样蛋白,可由多种细胞产生,循环于血液、脑脊液和脑间质液中,一般Aβ 沉积会与神经元的退行性病变有关[6]。尤其它还在阿尔茨海默病的病程进展中发挥着主要作用,使血管周围沉积从而导致血管壁淀粉样变从而导致血管硬化,甚至血管破裂或发生血栓等[7]。SOD能够反映机体清除自由基的能力,而MDA是机体当中一种重要的过氧化氢产物,对于细胞代谢以及功能也具有着重义,对于机体的氧化应激水平可进行反应[8]。
结合本次实验,将Aβ 注入大鼠的大脑皮质,结果发生注射部位的组织坏死,同时周围的神经元发生缺失以及神经角质的增生[9]。且当Aβ 处于溶解状态时能在短期内导致神经突的生长,但对于沉积状态的神经元会加速其消亡,引起神经突的退缩与变性,而这一点与阿尔兹海默症的病理变化特点也十分类似[10]。
综上所述,结合大鼠试验的结果分析,应用苦参碱可以对阿尔兹海默症的学习记忆功能进行改善,也能有效降低其脑内氧化应激水平。

