药物洗脱微球联合碘化油栓塞治疗原发性肝癌的疗效
钱瑞坤
(济宁市第一人民医院 肝胆外科,山东 济宁 272100)
0 引言
原发性肝癌大部分患者在临床发现时已经失去了手术切除的机会。当今对于肝癌的治疗手段主要包括:手术切除(开腹、腹腔镜及机器人)、TACE、局部消融治疗、靶向药物、免疫治疗及中医中药治疗[1]。
TACE是碘化油和化疗药物混合对肿瘤供血动脉超选择性注射,从而达到抑制肿瘤生长和使肿瘤局部坏死的目的,其姑息性治疗不可切除的肝细胞癌成为很多患者的首选治疗方法[2]。肿瘤坏死不彻底的原因是TACE难以将肿瘤的供血动脉完全栓塞及随着药物碘化油混合着血液流动迅速冲刷进入全身血液循环,局部药物浓度较低,在短时间内可能导致发热等不良反应的发生。药物洗脱微球是指将化疗药物负载于微球上,当微球到达肿瘤病灶后,再缓慢释放出来的一种栓塞剂。微球具有良好的灵活性并可以迅速恢复到原始状态,以提高精准持久的杀伤肿瘤的治疗[3]。
1 资料与方法
1.1 资料来源
本研究回顾性收集了我院肝胆外科2017年1月至2018年6月术中使用载药微球联合碘油和仅使用碘油患者的临床资料共计64例。纳入标准:①肝癌临床诊断准确且符合TACE手术指征;②负载药物均为表柔毗星50mg。排除标准:①除肝癌外,合并其他恶性肿瘤;②介入治疗联合靶向药物;③Child-Pugh分级C级。
1.2 对照方法
1.2.1 两组治疗方法
常规造影明确腹腔血管走行及肝肿瘤动脉供血情况。载药微球联合碘化油组:用20 mL注射器抽取载药微球,经微导管将药物缓慢推注到病灶内直至靶血管血流明显减慢,随后根据靶血管的直径选取相应大小的栓塞微球,直至主干血流停止,异常肿瘤染色消失[5]。单纯碘化油组:充分混合表柔毗星与碘化油,将碘油推注至病灶内,直至靶血管血流明显减慢,异常肿瘤染色消失。
1.2.2 术后疗效评估
患者术后第1、3个月复查肝脏强化MRI。肿瘤病灶动脉期无强化为完全缓解(CR);肿瘤病灶动脉期显影的直径总和缩小>30%为部分缓解(PR);肿瘤直径动脉期显影缩小未达到30%或增加未达到20%为疾病稳定(SD);肿瘤直径动脉期显影总和增加<20%或出现新病灶为疾病进展(PD)。疾病缓解(OR)为CR+PR/总例数×100%,疾病控制(DC)为CR+PR+SD/总例数×100%。所有患者术前、术后第1个月及第3个月分别测定血清AFP,AFP>200 μg/L为阳性。
1.3 统计学分析
使用EXCEL建立数据库,采用SPSS 20.0进行统计分析,利用T检验和检验来对两组数据进行差异性比较。
2 结果
2.1 基本资料
64例样本中,DEB-TALE组共计32例,其中男性29例,女性3例;年龄为32~75岁,平均年龄54±12岁;Child-Pugh分级A级21例,B级11例;病灶数目1~2的22例,3个及以上的10例;病灶最大直径为11.21±3.24。cTACE组共计32例,其中男性30例,女性2例;年龄为35~77岁,平均年龄57±10岁;Child-Pugh分级A级22例,B级10例;病灶数目1~2的18例,3个及以上的14例;病灶最大直径9.67±3.89。以上参数两组均无统计学差异(P>0.05)(见表1、表2)。

表1 DEB-TALE组与cTACE组均数比较
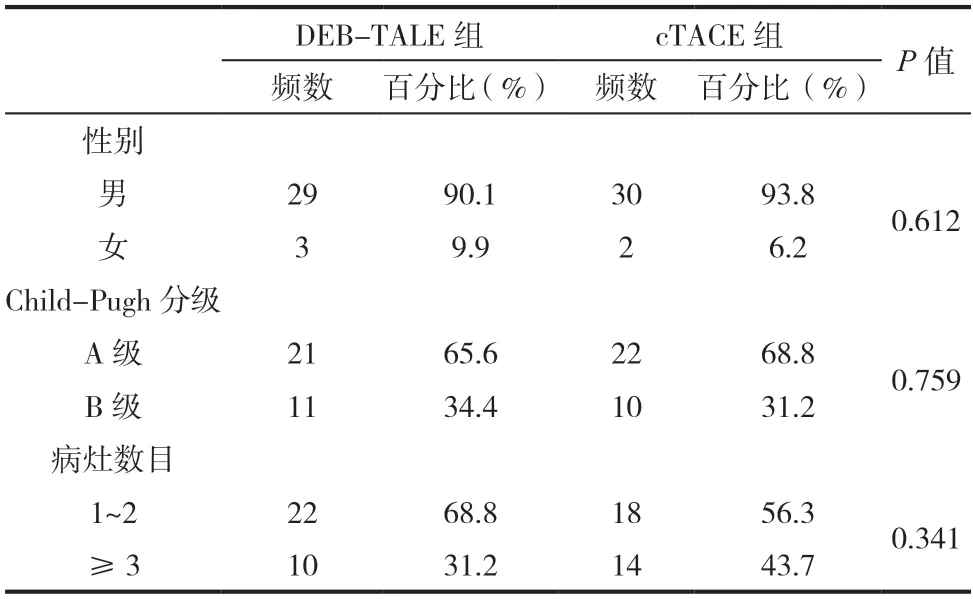
表2 DEB-TALE组与cTACE组频数比较
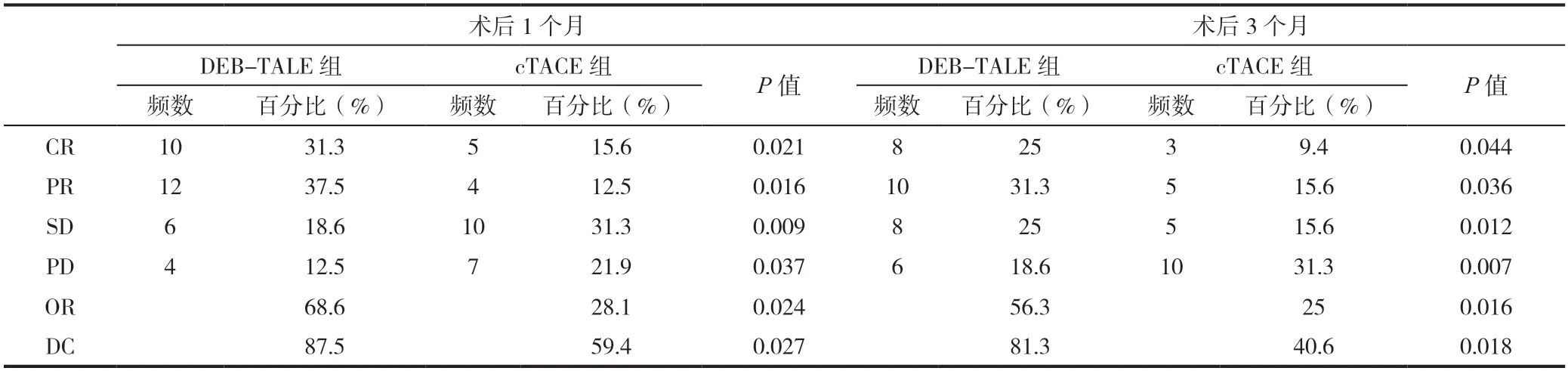
表3 DEB-TALE组与cTACE组疗效比较
2.2 疗效评估
术后病灶控制率:DEB-TALE组1个月复查CR,PR,SD,PD患者分别为31.3%完全缓解、37.5%部分缓解、18.6%疾病稳定、12.5%疾病进展,3个月复查结果分别为25%完全缓解、31.3%部分缓解、25%疾病稳定、18.6%疾病进展。术后第1个月疾病缓解OR值为68.6%,疾病控制CD值为87.5%;术后第3个月疾病缓解OR值为56.3%,疾病控制CD值为81.3。与cTACE组相比较,两组间均有统计学差异(P<0.05)。cTACE组疾病进展PD值高于DEB-TALE组,两组间有统计学差异(P<0.05),DEB-TALE组病灶缓解率优于TACE组(见表3)。术后1个月和术后3个月血清AFP升高的水平两组间有统计学差异(P<0.05)(见表4)。
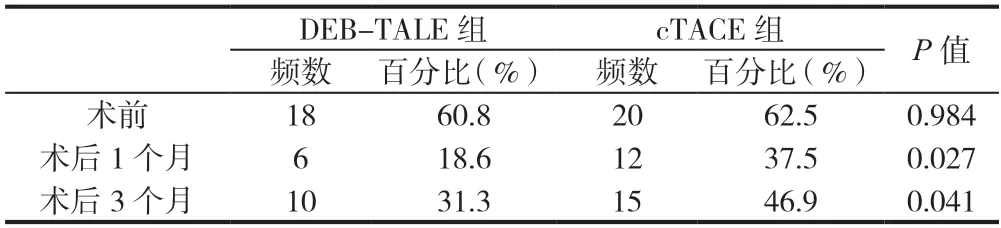
表4 DEB-TALE组与cTACE组血清AFP ≥200μg/L比较
3 讨论
载药微球是一种网状结构,主要是通过离子交换和氢键。与常规碘油栓塞材料相比,携带药物的微球具有持久的栓塞,更缓慢的释放药效,从而最大程度的发挥药效[6]。介入效果主要是供应肿瘤血液的血管栓塞程度,并且能尽量长时间维持体内的药物浓度和减少系统性药物不良反应的发生[7]。本研究结果显示载药微球组1个月或3个月的疾病控制率高于对照组。因此载药微球可以增加肿瘤坏死的细胞毒性,最大程度发挥化疗药物效果,延长肝癌进展的时间。甲胎蛋白是判断肝癌诊断、临床疗效和预后的重要指标[8]。研究结果表明,载药微球组和常规组对比术后1月及3月血清AFP水平明显下降,统计上有显著差异。
本篇为回顾性研究,且基于两组病人的手术方案不同,患者可能存在的抽样误差及非随机化设计的选择迁移,多中心,大样本研究需要进一步证实[9]。这项研究表明,载药微球肿瘤控制率相对较好,但只有最近的1个月或3个月随访,对长期患者影响无法得出结论[10]。

