杨梅素通过磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路诱导MTB感染巨噬细胞发生自噬的研究
孙锦霞 张晴雯 李银虹 姜昕
结核病仍然是威胁全球健康的一种感染性疾病。2019年WHO最新数据显示,2018年感染MTB的新发患者约1000万例,有55.8万例利福平耐药新发患者,其中有82%是耐多药结核病患者,排名前三位的国家是印度、中国和印度尼西亚[1]。我国的结核病防治形势依然非常严峻。耐药、潜伏感染、与HIV并发感染等问题是实现控制结核病面临的巨大挑战[2]。
MTB是胞内寄生菌,主要存在于巨噬细胞内,因此固有免疫在清除MTB中发挥关键的作用。自噬是存在于真核生物体内的一种高度保守的生物过程,指通过溶酶体介导的胞内组分的自我消化和再利用来维持细胞稳态的过程[3]。自1963年首次提出自噬这一概念以来,自噬在抵抗、清除胞内病原体中的重要作用也被越来越多的研究所证实[4-8]。通过诱导或增强巨噬细胞的自噬作用来清除胞内的MTB在2004年被Gutierrez等[9]首次证明。
宿主为导向的治疗策略(host-directed therapies,HDT)是一种新兴的治疗理念,通过小分子化合物对宿主免疫反应的调控来更好地控制MTB。与抗生素作用不同的是:HDT药物直接调节宿主细胞的免疫功能,从而避免了MTB耐药性的发生。在结核病治疗过程中,辅以自噬诱导剂来增强宿主细胞的自噬功能,能缩短治疗周期,降低复发和再感染率[10-11]。
杨梅素(myricetin,MYR)是一种多羟基黄酮类化合物,具有较强的抗肿瘤[12]、抗氧化[13]、抗炎[14]、抗菌[15]、抗病毒[16]和镇痛[17]等多种生物活性。杨梅素在MTB感染中的作用,还未见相关报道。本课题组在前期研究中发现了杨梅素具有一定的调控MTB感染巨噬细胞自噬的能力,为此本研究以杨梅素为研究对象,探讨经典自噬通路——磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路在杨梅素诱导MTB感染的巨噬细胞发生自噬中的作用。
材料和方法
一、材料及试剂
MTB H37Ra(ATCC25177)、小鼠巨噬细胞Raw 264.7由本实验室保存;杨梅素购自上海同田生物技术股份有限公司;DMEM高糖培养液购自美国Hyclone公司;胎牛血清购自以色列BI公司;Middlebrook 7H9、7H10培养基购自美国BD公司;CCK8购自上海基剑生物科技公司;BCA蛋白浓度测定试剂盒、RIPA细胞裂解液购自上海碧云天公司;兔抗鼠LC3、p62、mTOR、p-mTOR、Akt、p-Akt单克隆抗体购自美国CST公司;小鼠抗β-actin单克隆抗体购自美国Proteintech公司;HRP标记的羊抗兔、羊抗鼠二抗购自美国CST公司。
二、方法
1. Raw 264.7细胞的培养:Raw 264.7细胞用含10%胎牛血清的DMEM培养基,在37 ℃、含5% CO2的培养箱中培养。
2. 杨梅素对Raw 264.7细胞的细胞毒性实验:杨梅素用DMSO溶解制备成100 mmol/L的药物储液,Raw 264.7细胞生长至对数期,收集后铺板于96孔板中,细胞浓度为2×104/孔,加入不同浓度(25、50、100、150、200 μmol/L)的杨梅素,并设空白组、DMSO对照组,每组设6复孔。在37 ℃、含5% CO2的培养箱中培养24、48、72 h后,避光加入CCK-8(cell counting kit-8),10 μl/孔,放入培养箱继续培养30 min后,酶标仪测定各孔的吸光度值(A450值),根据各孔平均值,绘制细胞的生长曲线。细胞存活率(%)=(待测样品-空白组)/(对照组-空白组)×100%。
3. MTB H37Ra的培养:H37Ra菌株用含有10% 白蛋白-葡萄糖-过氧化氢酶(albumin dextrose catalase,ADC)营养添加剂的Middlebrook 7H9液体培养基,37 ℃培养箱培养约21 d生长至对数期。
4. H37Ra菌株感染Raw 264.7细胞模型的建立:Raw 264.7细胞离心收集后,铺板于6孔板中,细胞浓度为1×106/孔,设空白组、模型组、药物处理组,每组3个复孔,37 ℃培养箱培养过夜。收集生长至对数期的MTB,磷酸盐缓冲液(PBS)洗3遍,按感染复数(MOI,即细菌∶细胞=10∶1)加入模型组、药物处理组,共孵育4 h后,PBS洗3遍,以便弃掉未进入胞内的MTB;而后细胞分别采用不同浓度的杨梅素处理不同的时间,模型组用PBS处理。
5. 菌落形成单位(CFU)法检测杨梅素对MTB感染的Raw 264.7细胞中细菌的杀灭作用:杨梅素诱导自噬的最佳浓度100 μmol/L作用于感染细胞模型,并设空白组、模型组。37 ℃、5% CO2培养72 h 后,PBS洗3遍,收集细胞中加入100 μl的0.1% Triton-100,冰浴10 min,释放胞内MTB,各组分别用PBS稀释至106倍,设3个复孔,涂板于7H10固体培养基,37 ℃培养21 d后进行菌落计数。杨梅素对胞内MTB的抑制率(%)=(模型组胞内菌-杨梅素组胞内菌)/模型组胞内菌×100%。
6. 蛋白免疫印迹法(western blot,WB)检测Raw 264.7细胞相关蛋白的表达水平:在自噬相关蛋白(LC3和p62)的检测中,以不同浓度(12.5、25、50、100 μmol/L)的杨梅素处理模型组细胞24 h;在自噬通路相关蛋白(p-Akt和p-mTOR)检测中,以100 μmol/L杨梅素处理模型组细胞30、60、180 min。不同处理组细胞分别用预冷的PBS洗3遍,加入预冷的RIPA细胞裂解液,冰上裂解30 min。4 ℃、r=10 cm,12 000 r/min 离心15 min,收集蛋白上清。BCA法检测蛋白浓度,然后将蛋白与上样缓冲液(loading buffer)混合后煮沸。在SDS-聚丙烯酰胺凝胶(PAGE)(SDS-PAGE)上分离蛋白并转印至硝酸纤维素膜(NC膜)上,5%脱脂牛奶封闭2.5 h后,将NC膜转移至预先按1∶1000进行稀释好的兔抗LC3、p62、mTOR、 p-mTOR、Akt、p-Akt单克隆抗体,小鼠抗 β-actin单克隆抗体中,4 ℃ 孵育过夜。TBST洗3遍,每遍10 min后,将膜放入1∶5000稀释的HRP标记的羊抗兔或羊抗鼠二抗中,室温下孵育1 h,TBST洗3次。用ECL试剂盒在Protein Sample仪器上进行显影,并通过Image J软件对蛋白质的表达进行像素的灰度值测定与分析。
三、制图与统计学分析
结 果
一、杨梅素对Raw 264.7细胞活力的影响
在不同时间点(24、48、72 h)用CCK8法检测不同浓度(0、12.5、25、50、100、200 μmol/L)杨梅素处理后细胞的存活情况。结果显示,杨梅素作用24 h和48 h细胞的存活率均能保持在90%左右,200 μmol/L 的杨梅素处理细胞72 h后,Raw 264.7细胞的生存率仍能达到(79.65±1.36) %(表1)。为此后续实验选择100 μmol/L为最大药物安全使用浓度。
二、杨梅素诱导MTB感染的Raw 264.7细胞自噬
利用Western bolt检测自噬相关蛋白LC3Ⅱ和p62蛋白的表达情况。以小鼠肌动蛋白(β-actin)为内参,模型组与药物处理组的LC3Ⅱ和p62蛋白的表达差异见图1。与模型组相比,杨梅素作用24 h能明显诱导MTB感染的Raw 264.7细胞发生自噬,且随药物浓度的增加,呈现一定的剂量依赖性。模型组LC3Ⅱ蛋白的相对表达量较低,杨梅素不同浓度(12.5、25、50、100 μmol/L)处理均能促进LC3Ⅱ的表达;相较于模型组p62蛋白,药物处理亦能抑制p62的表达,25 μmol/L杨梅素处理组差异无统计学意义,12.5、50、100 μmol/L处理组差异均有统计学意义,具体见表2。杨梅素在最高作用浓度100 μmol/L 下,其LC3Ⅱ蛋白表达最高,同时p62蛋白表达最低。
三、杨梅素能明显杀伤Raw 264.7细胞内的MTB
杨梅素能降低Raw 264.7细胞的荷菌量。模型组胞内的MTB数量为(39.67±2.33)×106,100 μmol/L 杨梅素处理72 h后,胞内MTB的数量降为(31.33±0.88)×106,差异有统计学意义(t=3.34,P=0.03)。杨梅素对胞内MTB的抑制率(%)为21.02%(图2)。
四、杨梅素通过抑制PI3K/Akt/mTOR通路诱导自噬
利用Western bolt检测自噬经典途径PI3K/Akt/mTOR通路中关键接头蛋白Akt、mTOR的磷酸化水平。以各组p-Akt/Akt和p-mTOR/mTOR来表示该组p-Akt和p-mTOR蛋白的相对灰度值。与空白组相比,空白+杨梅素组Akt和mTOR蛋白的磷酸化水平没有变化,可见杨梅素本身对空白
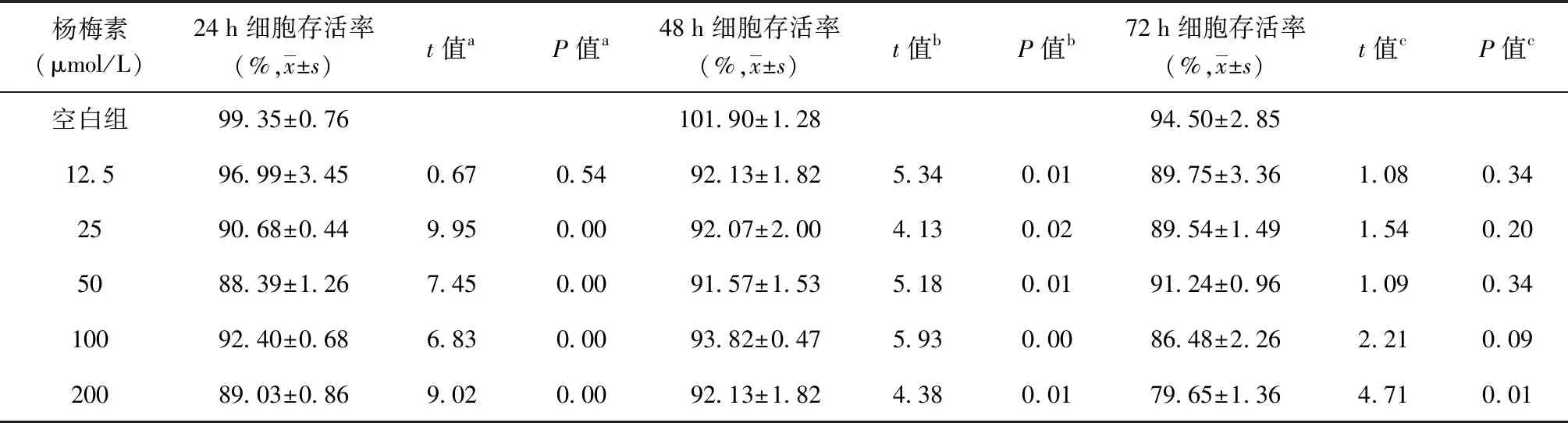
表1 不同浓度杨梅素作用下Raw 264.7细胞的存活率

图1 Western bolt检测不同浓度杨梅素作用下细胞中自噬相关蛋白LC3Ⅱ和p62的表达情况。与模型组相比,不同浓度杨梅素处理组能明显促进LC3Ⅱ的表达,同时促进p62蛋白的降解
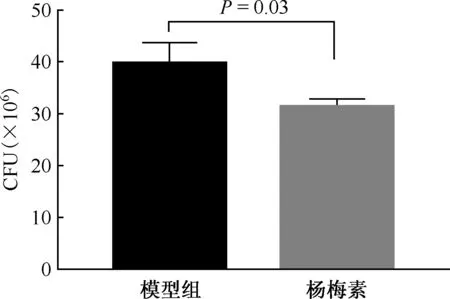
图2 杨梅素对Raw 264.7细胞内MTB的杀伤作用
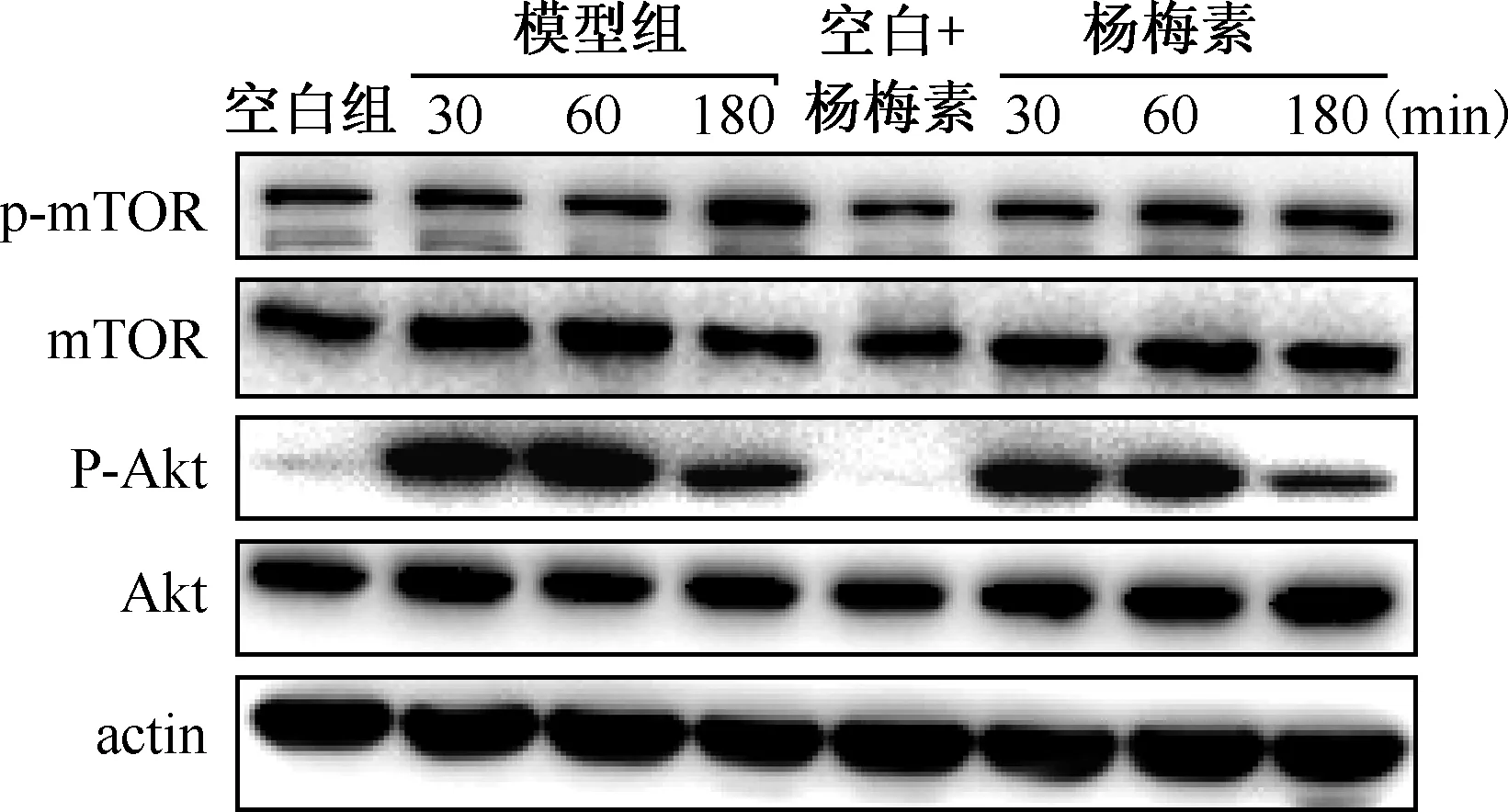
空白+杨梅素组与空白组相比,杨梅素本身对细胞的Akt和mTOR蛋白的磷酸化无影响。与模型组相比,在不同时间点(30、60、180 min),杨梅素均能明显抑制Akt蛋白的磷酸化,差异有统计学意义;模型组p-mTOR蛋白水平仅在MTB感染后180 min明显增加,杨梅素作用180 min亦能明显抑制mTOR蛋白的磷酸化图3 Western bolt检测杨梅素对细胞中PI3K/Akt/mTOR通路相关蛋白磷酸化水平的影响
讨 论
目前,治疗结核病的主要手段仍然是化疗,而临床普遍使用的一线抗结核药物,仍停留在20世纪90年代研发的链霉素、异烟肼、利福平。然而由于耐药、耐多药、与HIV并发感染等问题的出现,使得开发新的抗结核药物成为全球结核病防治事业的当务之急。针对杀灭MTB的药物研发进展缓慢,HDT疗法另辟蹊径,从宿主角度出发,通过增强宿主的免疫力来清除MTB。MTB是一种胞内寄生菌,通过抑制吞噬体的成熟从而在感染的巨噬细胞内长期存活。自噬是细胞自发的对胞内寄生菌的一种防御行为,已经被确认可以通过不同机制清除胞内菌。通过自噬,细胞能清除胞内受损的细胞器、蛋白聚集物及进入细胞的病原体。经典的自噬分为巨自噬、微自噬及分子伴侣介导的自噬[18],通常所说的自噬即是巨自噬。自噬是由多种基因共同参与的渐进式的过程,以双层膜包裹的需降解的胞内成分形成的自噬体为标志,通过与溶酶体的融合来降解其内容物。自噬发生时,胞质中的LC3会发生酶解形成LC3Ⅰ,LC3Ⅰ在ATG帮助下与磷脂酰乙醇胺(PE)结合后形成膜型的LC3Ⅱ,LC3Ⅱ会与自噬体膜融合,因此,通过LC3Ⅱ/LC3Ⅰ比值的大小可以评估自噬水平的高低。而自噬流是否通畅,可以观察p62蛋白的表达水平。p62蛋白是细胞接头蛋白,是细胞内多种蛋白复合物的主要成分[19]。当自噬流通畅时,p62蛋白会与LC3形成复合物,p62作为自噬特异性底物与吞噬溶酶体内的其他内容物被一同降解[20]。自噬已经成为治疗结核病的新靶标,其限制MTB生长的作用也被很多研究者所证实[21-22]。

表3 杨梅素作用不同时间对Akt和mTOR蛋白磷酸化水平的影响
杨梅素作为一种天然的黄酮类化合物,具有广泛的药理活性,且毒性较小,具有很好的应用前景。杨梅素具有抗肿瘤、抗氧化、抗微生物、抗神经退化、抗高血压、抗过敏、抗酸、降血糖和抗炎、镇痛等多种药理作用。近年来,大量的研究聚焦在了杨梅素的抗菌、抗炎活性上。杨梅素具有抑制金黄色葡萄球菌、大肠埃希菌、肺炎链球菌生长的作用[23-25]。然而结核病模型中,还未见有关杨梅素的相关报道。目前在杨梅素的作用机制研究方面,Cao等[26]发现杨梅素在较高浓度下可显著降低肝癌细胞HepG2的活力,增加自噬体形成和选择性吞噬过程中起关键作用的蛋白LC3的表达,降低mTOR及其下游信号分子的磷酸化,促使细胞的自噬过程进行。
本实验中首先通过CCK8法检测杨梅素对Raw 264.7细胞的细胞毒性,发现杨梅素在100 μmol/L浓度以下作用24、48、72 h时细胞的存活率均在90%以上,可见杨梅素在100 μmol/L浓度下对细胞的毒性较小,因此本实验选用100 μmol/L作为杨梅素的最大安全使用浓度。通过杨梅素干预MTB感染的小鼠Raw 264.7巨噬细胞,Western blot检测发现杨梅素能明显促进自噬相关蛋白LC3Ⅱ的表达,与模型组(0.52±0.01)相比,杨梅素不同浓度(12.5、25、50、100 μmol/L)处理24 h均能促进LC3Ⅱ的表达(0.59±0.02, 0.65±0.01, 0.71±0.01, 0.83±0.01),差异有统计学意义(t=2.97、P=0.04,t=7.91、P=0.00,t=9.77、P=0.00,t=16.37、P=0.00)。同时,我们发现杨梅素能促进p62蛋白降解,较模型组p62蛋白(0.86±0.02),不同浓度的杨梅素能抑制p62的表达(0.72±0.01,0.85±0.00,0.60±0.02,0.58±0.01);与模型组比较,25 μmol/L杨梅素处理组差异无统计学意义(t=0.81,P=0.46),12.5、50、100 μmol/L 处理组均有统计学意义(t=6.50、P=0.00,t=9.53、P=0.00,t=12.01、P=0.00);从中得出杨梅素在100 μmol/L浓度下LC3Ⅱ的表达最高,同时p62的表达最低,可见杨梅素诱导自噬的最佳浓度为100 μmol/L。自噬是清除胞内MTB的一种重要手段,因此选择在自噬发生后对胞内的MTB数量进行了CFU计数,发现杨梅素在100 μmol/L浓度下作用72 h后,能降低胞内21.02%的MTB,虽然这种降低没能产生数量级上的差异,但考虑到HDT只是一种辅助治疗的手段,杨梅素可联合其他一线抗结核药物一起使用,以此达到降低药物剂量、缩短疗程和减少耐药性产生的目的。笔者也检测了杨梅素作用24 h和48 h后的CFU,发现差异无统计学意义,原因可能是药物在24 h刚启动自噬,而自噬发生后对MTB的降解需要一定的时间,因此在72 h才产生了统计学意义上的降低。通过刃天青法检测杨梅素的体外杀菌作用,发现杨梅素本身在200 μmol/L浓度下对MTB无杀灭作用,因此,杨梅素降低MTB感染的巨噬细胞中的荷菌量不是由于杨梅素本身的杀菌作用引起的,而是通过启动了自噬,从而引起细胞内MTB的CFU下降。
PI3K/Akt/mTOR通路是最经典的自噬通路,因此笔者首先考虑杨梅素诱导自噬的机制很可能是通过抑制了这条通路启动了自噬。为了排除杨梅素本身对细胞PI3K/Akt/mTOR通路的影响,设立了空白+杨梅素组,与空白组相比,p-Akt和p-mTOR水平差异均无统计学意义。在100 μmol/L浓度下,杨梅素作用不同的时间(30、60、180 min),与模型组相比(1.23±0.01、1.52±0.01、0.74±0.02),Akt蛋白的磷酸化水平(0.99±0.01、0.96±0.01、0.43±0.01)均被显著抑制,差异有统计学意义(t=27.60、P=0.00,t=30.06、P=0.00,t=18.60、P=0.00);而模型组p-mTOR蛋白水平仅在MTB感染后180 min(0.57±0.00)明显增加,杨梅素作用180 min 亦能抑制mTOR蛋白的磷酸化(0.46±0.01),差异有统计学意义(t=21.60,P=0.00)。
综上所述,杨梅素通过抑制Akt和mTOR蛋白的磷酸化来抑制PI3K/Akt/mTOR通路,从而诱导MTB感染的巨噬细胞发生自噬来杀灭胞内的MTB。基于本研究的实验结果,认为杨梅素有望成为新的 HDT 候选药,作为辅助用药与临床一线抗结核药物联合用于结核病的防治。本实验尚存在许多不足之处,比如:采用的无毒株、细胞模型相对单一、没有开展整体实验、没有与抗结核药物进行比较等。

