麻黄-甘草药对抑制过敏性哮喘的效应及机制初探
袁为远,魏盼,包凯帆,姚露,王霄彤,王思齐,郑劼,洪敏,江国荣
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中药药效与安全评价重点实验室,江苏 南京 210023;3.南京中医药大学附属苏州市中医医院,江苏 苏州 215003;4.南京中医药大学医学院·整合医学学院,江苏 南京 210023)
过敏性哮喘是一种复杂的慢性炎症性呼吸道疾病,目前约有3亿人患有哮喘,且每年至少有25万人死于这种疾病,严重威胁了公众健康[1]。中药在治疗过敏性疾病中具有良好效果,其中麻黄-甘草药对常用于治疗过敏性疾病。药对,又可称为对药,主要是由2味药组成的配伍相对固定的药物组合。麻黄-甘草药对源自张仲景的《金匮要略》,包括小青龙汤、麻杏石甘汤等经方中均巧施麻黄-甘草药对,在临床上广泛用于风寒感冒、过敏性哮喘等疾病的治疗,且多用于缓解慢性阻塞性肺疾病及哮喘引起的气道重塑[2]。本研究考察了麻黄-甘草药对屋尘螨(HDM)诱导小鼠过敏性哮喘的作用,并对其机制进行初步探讨。
1 材料
1.1 药物
麻黄为麻黄科植物草麻黄EphedrasinicaStaph.的干燥草质茎(安徽广印堂中药股份有限公司,产地:内蒙古,批号:20150302);甘草为豆科植物甘草GlycyrrhizauralensisFisch.的干燥根及根茎(山西万辉制药有限公司,产地:内蒙古,批号:150302),药材经南京中医药大学谷巍教授鉴定。硫酸沙丁胺醇片,购自江苏亚邦爱普森药业有限公司,批号:E181024。
1.2 动物
BALB/c小鼠,雄性,SPF级,体质量18~22 g,购于南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001。小鼠饲养于南京中医药大学实验动物中心,室温:22~25 ℃,湿度:50%~60%,自由饮食饮水。实验步骤及造模方法均经由南京中医药大学实验动物伦理审查委员会批准,伦理审查号:ACU171007。
1.3 试剂
HDM(批号:322781)购自美国Greer Laboratory公司,乙酰甲胆碱(批号:1396364)购自美国Sigma公司;4%中性多聚甲醛通用型组织固定液(批号:1808266)购自biosharp公司;小鼠IgE ELISA Kit(批号:156530014),IL-4 ELISA Kit(批号:167465001),IL-5 ELISA Kit(批号:4277363),IL-13 ELISA Kit(批号:4331312)均购自美国Thermo Fisher Scientific公司;BCA蛋白定量试剂盒(批号:YWB002)购自翼飞雪生物科技公司;E-cadherin抗体(批号:610181)购自美国BD公司;N-cadherin抗体(批号:2018-1-AP),α-SMA抗体(批号:14395-1-AP),Vimentin抗体(批号:10366-1-AP)均购自美国Proteintech公司;ECL发光液(批号:1705102)购自美国Millipore公司;Masson染液(批号:20161031),嗜酸性粒细胞计数液(批号:20170605)购自南京建成科技有限公司;小鼠二步法免疫组化检测试剂盒(批号:K183314A)购自北京中杉金桥生物技术有限公司。
1.4 仪器
无创全身体积描记系统(WBP)-肺功能检测系统(法国EMKA公司,型号:gyd-003);电子天平(瑞典METTLER TOLEDO公司,型号:PL203);Countstar细胞计数仪(上海睿钰生物科技有限公司,型号:IC1000);BioStack Ready酶标仪(美国Bio-Tek公司,型号:SyneRgy 2);冷冻离心机(美国BECKMAN公司,型号:GS-15R);倒置荧光显微镜(德国ZEISS,型号:AxionA1);光学显微镜(江南光电集团股份有限公司,型号:XSP-18B);包埋仪(德国Leica公司,型号:EG1150H);切片机(德国Leica公司,型号:EG1150H);活细胞成像分析系统(德国ZEISS公司,型号:Axio vert A1)。
2 方法
2.1 麻黄-甘草药对提取物的制备
称取麻黄饮片3.0 kg,甘草饮片1.5 kg,按2∶1的比例[3]先加入少量无水乙醇充分浸润,再加入8倍量无水乙醇加热煮沸后回流提取2 h。趁热使用3层纱布过滤,滤渣再用8倍量三蒸水加热回流提取2 h。趁热过滤,合并2次滤液,减压浓缩至稠浸膏。最后,冷冻干燥制成干粉,计算得到1 g干粉相当于6.34 g生药。该提取物下文中简称MG。
2.2 造模及给药方案
SPF级雄性BALB/c小鼠56只,根据体质量分层随机分为4组,每组14只,分别为空白组、模型组、沙丁胺醇(Sal)组、MG组,其中每组各取6只(共24只)用于检测小鼠气道反应性。除空白组外其余3组于第0、7、14天3次腹腔注射0.1 mL的HDM溶液(浓度为0.5 mg/mL)致敏,第21~23天连续3 d滴鼻10 μL的HDM溶液(浓度为2.5 mg/mL)激发,空白对照小鼠给予等体积PBS溶液。MG组为全程给药,按生药量7.02 g/kg灌胃给药,Sal组于第17天开始给药,连续给药7 d,按0.78 mg/kg灌胃给药,给药体积均为0.1 mL/10 g。
2.3 气道高反应性测定
各组小鼠在最后1次激发24 h后测定气道反应性。将小鼠放入体描箱,每次可同时测定2只小鼠,读取呼气间歇(Penh)基础值后,小鼠分别接受乙酰甲胆碱的雾化,乙酰甲胆碱的浓度从低到高依次为0、6.25、12.5、25、50 mg/mL,雾化剂量为每次300 μL,时间为90 s,每个浓度雾化完成之后,观察到小鼠是否存在气促、抓头、烦躁等缺氧表现,然后记录5 min Penh数值,取平均值比较各组小鼠的气道反应性。
2.4 小鼠肺组织病理学及免疫组织化学检测
取未灌洗过的左上叶肺组织,使用4%的中性多聚甲醛溶液固定48 h,石蜡包埋后切成厚度为5 μm的薄片备用。各组切片分别进行HE染色和Masson染色,200倍显微镜下观察小鼠肺部炎症浸润及胶原沉积情况。并且各切片根据免疫组化试剂盒说明书进行操作后,在200倍显微镜下观察E-cadherin、N-cadherin、Vimentin、α-SMA和TGF-β1的表达,使用Mantra图像分析软件对以上各目标蛋白进行光密度(OD)半定量分析。
2.5 嗜酸性粒细胞计数(EOS)和血清IgE测定
小鼠末次HDM滴鼻激发24 h后,眼眶后静脉丛采血,将20 μL全血与380 μL嗜酸性粒细胞计数液混合均匀,显微镜下观察计数。将全血室温静置1 h后,3 500 r/min离心15 min,吸取血清,血清用PBS稀释50倍,按小鼠IgE ELISA试剂盒操作步骤进行测定。
2.6 BALF和肺中细胞因子检测
小鼠BALF液收集:眼眶后静脉丛采血后,将小鼠麻醉处理,打开其胸腔并结扎左肺(结扎的肺部用于病理及细胞因子的检测),将小鼠颈部肌肉向两侧分离并暴露气管,在气管上剪一个小口用于22 G针头进行气管插管,用注射器分2次分别注入0.3 mL 4 ℃ PBS进行灌洗,重复3次,并收集灌洗液。将BALF灌洗液以1 000 r/min,4 ℃离心10 min,吸取上清液移至1.5 mL EP管中,-20 ℃保存用于测定BALF中的细胞因子。
小鼠肺匀浆制备:取未灌洗小鼠肺组织样本称质量,加入4 ℃ PBS溶液量为肺组织样本质量的20倍,肺组织和4 ℃ PBS加入匀浆器中,研磨成5%的肺匀浆,静置10 min后,3 500 r/min,4 ℃离心15 min,吸取上清液储存于-20 ℃冻存待测。
根据ELISA试剂盒说明书的操作方法,分别检测小鼠BALF和肺匀浆中的IL-4、IL-5和IL-13的表达水平,使用BCA试剂盒进行蛋白校正,pg/mg为最终表示单位。
2.7 统计学方法
3 结果
3.1 MG对HDM诱导的哮喘模型小鼠气道反应性的影响
如图1所示,在乙酰甲胆碱6.25、12.5、25、50 mg/mL浓度的雾化下,模型组Penh值相较于空白组显著升高(P<0.05~0.01),MG组小鼠Penh值相比于模型组显著性降低(P<0.05~0.01)。
3.2 MG对HDM诱导的过敏性哮喘模型炎症反应的影响
与空白组比较,HDM诱导的哮喘模型组小鼠全血EOS,血清IgE,BALF和肺Th2型细胞因子IL-4、IL-5和IL-13的表达均明显升高(P<0.05~0.01)。给予Sal或MG后,均能不同程度地降低模型小鼠全血EOS,血清IgE,BALF和肺IL-4、IL-5、IL-13的水平,差异有统计学意义(P<0.05~0.01)。结果见表1~3。
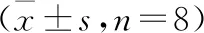
表1 MG对HDM诱导的过敏性哮喘模型EOS及IgE水平的影响
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。

表2 MG对HDM诱导的过敏性哮喘模型BALF中IL-4、IL-5和IL-13水平的影响
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.3 MG对HDM诱导的哮喘模型小鼠肺组织病理变化的影响
HE结果显示,模型组小鼠肺组织支气管周围有明显的炎性细胞浸润与黏液的分泌且伴随着支气管壁的增厚;相比于模型组,Sal组及MG组支气管周围的黏液分泌及炎性细胞显著减少。Masson染色结果显示,与空白组比较,模型组小鼠肺部气道细胞外沉积显著增加,Sal组及MG组均能有效抑制哮喘小鼠气道细胞外基质的沉积。见图2。

表3 MG对HDM诱导的过敏性哮喘模型肺IL-4、IL-5和IL-13水平的影响
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01。
3.4 MG对HDM诱导的哮喘模型小鼠支气管上皮异常间质转化以及气道重塑的影响
结果见图3和表4。与空白组比较,模型组支气管上皮的E-cadherin分布紊乱且表达明显减少(P<0.01),N-cadherin和Vimentin表达明显增加(P<0.01);在给予Sal和MG后,E-Cadherin的表达均有增加的趋势,N-cadherin的表达明显减少(P<0.01),Sal亦可明显下调Vimentin的表达(P<0.01),MG对Vimentin的表达也有下调趋势。此外,本文还考察了MG对支气管平滑肌的影响,相对于空白组,α-SMA的表达明显增加(P<0.01),Sal及MG组α-SMA表达均明显降低(P<0.05)。
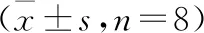
表4 MG对HDM诱导的过敏性哮喘模型肺组织气道重塑相关蛋白表达的影响
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.5 MG对HDM诱导的哮喘模型小鼠TGF-β1的影响
结果见表5。与空白组比较,模型组小鼠BALF与肺TGF-β1水平显著升高(P<0.05~0.01),而血清TGF-β1无明显变化。肺局部的TGF-β1呈现高浓度,在给予Sal及MG之后,肺局部TGF-β1的表达有不同程度的降低(P<0.05~0.01),而对于BALF的TGF-β1,各给药组TGF-β1水平均呈现下降趋势。免疫组化结果如图4和表6所示,相比于空白组,模型组TGF-β1的表达明显增加,在给予Sal及MG之后,TGF-β1的表达均有不同程度的降低(P<0.01)。

表5 MG对HDM诱导的过敏性哮喘模型BALF、肺和血清TGF-β1表达的影响
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
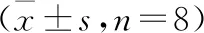

组别TGFβ1空白组0.045±0.008模型组0.083±0.005##Sal组0.038±0.009**MG组0.051±0.004**
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
4 讨论
过敏性哮喘是一种以气道高反应性和Th2型细胞因子分泌增多为特征的慢性呼吸道炎症性疾病[4]。临床上用于治疗哮喘的药物如糖皮质激素、β2受体激动剂等[5]虽然能缓解哮喘症状,但仍无法解决其反复发作的问题[6]。中医药防治过敏性疾病的有效性及其减少反复发作、减轻发作程度方面的特点与优势已被长期的临床实践所证实[7-8]。
课题组前期研究发现MG能够显著抑制由异硫氰酸荧光素诱导的Th2型变应性接触性皮炎的症状[9]。本研究利用HDM诱导的小鼠哮喘模型来考察MG对过敏性哮喘的作用,结果表明,在HDM诱导的过敏性哮喘模型中,伴随着EOS增多,血清IgE异常,Th2型细胞因子IL-4、IL-5和IL-13分泌增多以及气道高反应性等特征。给予MG干预之后,可显著抑制EOS、肺组织炎症浸润以及Th2型细胞因子的分泌,改善小鼠气道高反应性,提示MG对过敏性哮喘的症状具有良好治疗作用。
气道重塑因发病机制复杂与诱导因素繁多而成为哮喘难以根治的主要因素[10]。气道重塑的病理构成主要是上皮功能与结构的改变[11],且气道上皮受损和修复机制与上皮间质转化(EMT)的激活密不可分[12]。EMT的过程是指在外界因素诱导后上皮细胞的极性与粘附性丢失,表现为上皮细胞标志性蛋白如E-cadherin等的表达下调,而间质细胞标志性蛋白如N-cadherin、Vimentin、α-SMA等的表达上调,最终导致上皮屏障的完整性缺失[13]。本研究表明,给予MG后能够显著下调N-cadherin和α-SMA的表达,且能一定程度恢复E-cadherin的表达。提示MG能够抑制EMT的进程,这可能是其缓解哮喘发生的作用机制之一。
TGF-β1目前被认为是诱导EMT发生的主要因素之一[14]。本研究发现,HDM诱导的过敏性哮喘模型肺组织支气管局部TGF-β1呈现高表达,这也可能是导致支气管上皮异常间质转化的诱因之一。MG能够有效抑制肺TGF-β1的表达,而对BLAF中TGF-β1未见明显影响,提示MG能够通过降低肺部TGF-β1的表达从而缓解哮喘气道重塑的发生与发展。

