耐甲氧西林金黄色葡萄球菌耐药性及SCCmec基因分型研究
胡庆花,朱德全,刘卫东,刘向峰
[1.山东第一医科大学(山东省医学科学院) 研究生处,山东 泰安 271000;2.临沂市 人民医院 微生物检验科,山东 临沂 276000;3.临沂市人民医院 药学部,山东 临沂 276000]
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)是一类常见的多重耐药菌,由于葡萄球菌染色体mec 基因盒(staphyloccoccal cassette chromosome mec,SCCmec)携带的mecA耐药基因及其同系物编码产生的青霉素结合蛋白(penicillin-binding protein,PBP)导致其呈多重耐药性。目前,国际上已经明确了8 个与MRSA 流行病学相关的SCCmec基因分型及26 个亚型,医院获得性MRSA 常携带Ⅰ、Ⅱ及Ⅲ型SCCmec基因,社区获得性MRSA 多携带SCCmecⅣ、Ⅴ型SCCmec基因[1]。由于不同地区MRSA 的SCCmec 分型差异较大,因此该实验对MRSA 进行耐药性及SCCmec基因分型研究,以了解该地区MRSA 的流行病学特点,对指导临床合理治疗MRSA 感染具有重要意义。
1 资料与方法
1.1 菌株
选 取2018年2月—2018年10月临沂市人民医院门诊及住院患者的各类送检标本,从中分离得到MRSA 菌株47 株,剔除同一患者相同部位重复分离的菌株。MRSA 标准菌株采用ATCC29213 和ATCC433000。
1.2 仪器及材料
VITEK-2 Compact 全自动微生物分析仪及配套鉴定卡和药敏卡(法国生物梅里埃公司),药敏纸片(英国Oxoid 公司),聚合酶链反应扩增仪、全自动凝胶成像仪(美国Bio Rad 公司),DYY-6C 型电泳仪(北京六一生物科技有限公司),金黄色葡萄球菌基因组DNA 提取试剂盒、2×Power Taq PCR Master Mix、DL2000 DNA Marker 及核酸凝胶染色剂-GelRed(北京百泰克生物技术有限公司),Multiplex PCR Kit(德国QIAGEN 公司),溶葡萄球菌酶等其他生物试剂(上海生工生物工程股份有限公司)。
1.3 方法
1.3.1 MRSA 细菌表型鉴定及药敏试验 采用VITEK-2 Compact 全自动微生物分析仪对分离菌株进行细菌鉴定及药敏试验。根据2017年美国临床和实验室标准协会相关标准推荐的头孢西丁纸片扩散法,抑菌圈直径≤21 mm 判断为MRSA[2]。
1.3.2 DNA 提取 将收集的待测菌株接种于哥伦比亚血平板上,置于37℃生化培养箱中培养18~24 h。用取菌环挑取适量单个菌落接种于5 ml LB 培养液中,置于37℃恒温摇床过夜进行增菌培养。取1.5 ml细菌培养液于2 ml 离心管中,10 000 r/min 离心30 s,弃上清,收集菌体,尽可能吸净上清。严格按照细菌DNA 提取试剂盒说明书进行操作。提取后的DNA 使用超微量核酸蛋白测定仪检测浓度和纯度,后将提取的DNA 置于-20℃冰箱中保存。
1.3.3 引物设计 各型别基因引物根据GenBanlk中己发布的各型基因序列及参考文献[3]自行设计mecA、SCCmec基因,均委托上海铂尚生物技术公司合成[3]。见表1。
1.3.4 MRSAmecA基因检测 采用PCR 进行mecA基因检测,反应体系为25μl,其中DNA 模板2μl,2×Taq PCR Master Mix 12.5μl,mecA 正反向引物各1μl,其余用ddH2O 补足25μl。反应条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30 个循环,72℃继续延伸10 min。将PCR产物放置于4℃保存。取5μl PCR 产物在1%琼脂糖凝胶电泳30 min,后将凝胶置于紫外凝胶成像仪下拍照并记录结果。
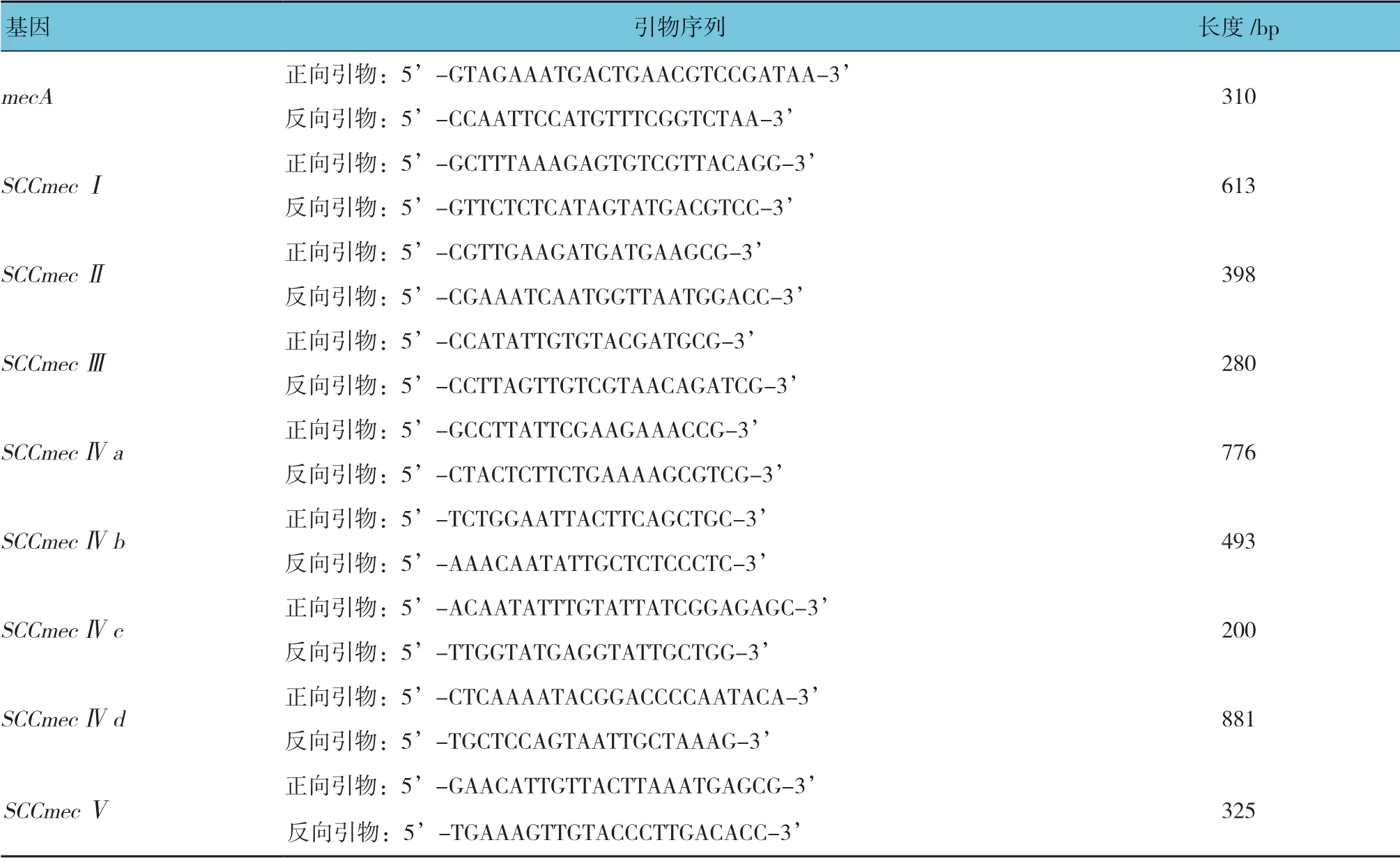
表1 mecA 基因及SCCmec 基因各分型PCR 扩增引物序列
1.3.5 MRSASCCmec基因检测 采用多重PCR 进行SCCmec基因分型检测,反应体系为25μl,其中DNA 模板2μl,2×QIAGEN Multiplex PCR Master Mix 12.5μl,引物混合物5μl,其余用ddH2O 补足25μl。反应条件:95℃预变性15 min,94℃变性30 s,63℃退火90 s,72℃延伸90 s,共10 个循环;94℃变性30 s,55℃退火90 s,72℃延伸90 s,共25 个循环,72℃继续延伸10 min。循环结束后将PCR 产物于4℃环境下保存。取5μl PCR 产物在1.3%琼脂糖凝胶电泳30 min,后将凝胶置于紫外凝胶成像仪下拍照并记录结果。
1.4 统计学方法
数据分析采用Whonet 5.6 软件和SPSS 20.0 统计软件。计数资料以率(%)表示,比较用校正χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 mecA 基因检测结果
凝胶电泳成像显示,MRSA 分离菌株可见310 bp条带,均为mecA基因阳性菌株,MRSA 分离菌株mecA基因携带率为100%。见图1。
2.2 SCCmec 基因检测结果
凝胶电泳成像显示:SCCmecⅡ型9 株,检出率为19.15%;SCCmecⅣa 型35 株,检出率为74.47%;未分型菌株3 株,占6.38%。见图2。
2.3 不同SCCmec 分型MRSA 对抗菌药的耐药率比较

图1 mecA 基因PCR 扩增产物电泳图
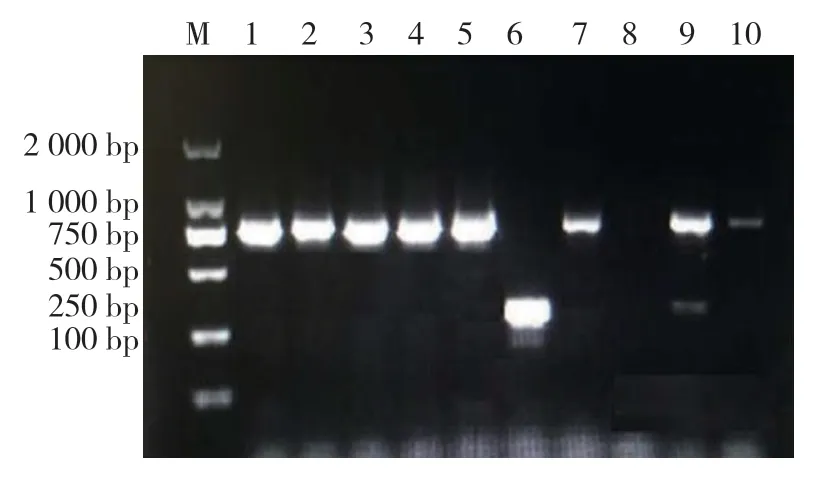
图2 SCCmec 基因PCR 扩增产物电泳图
MRSA 分离菌株对青霉素、苯唑西林及头孢西丁等β-内酰胺类抗菌药物耐药,对奎奴普汀/达福普汀、利奈唑胺、万古霉素、替加环素、呋喃妥因、利福平及庆大霉素均表现为敏感,敏感率均为100%;不同SCCmec分型MRSA 对环丙沙星、左氧氟沙星及莫西沙星的耐药率比较,差异有统计学意义(P<0.05),SCCmecⅡ型高于SCCmecⅣa 型。不同SCCmec分型MRSA 对红霉素、克林霉素耐药率比较,经校正χ2检验,差异无统计学意义(P>0.05),SCCmecⅣa 型高于SCCmecⅡ型,红霉素、克林霉素耐药严重。见表2。
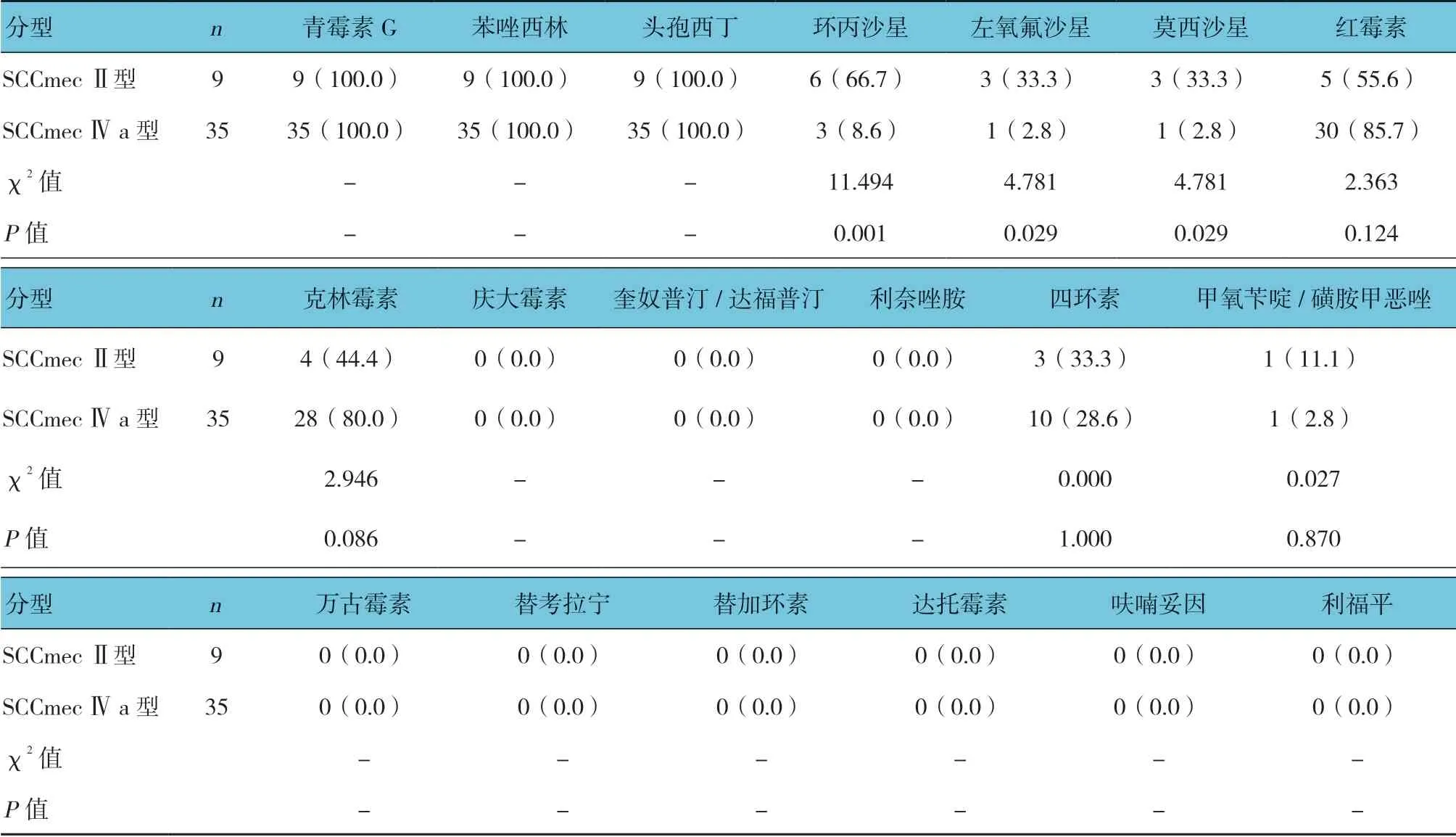
表2 不同SCCmec 分型MRSA 对抗菌药的耐药率比较 株(%)
3 讨论
MRSA 指携带mecA或mecC基因或对苯唑西林(最低抑菌浓度≥4μg/ml)、头孢西丁耐药的金黄色葡萄球菌,可引起人类多种组织和脏器的感染,病死率高[4]。自1961年JEVONS 发现第一株MRSA 后,MRSA 已成为医院和社区感染的常见致病菌[5]。
有研究表明,SCCmec 是区分医院获得性MRSA和社区获得性MRSA 的重要指标之一[6]。医院获得性MRSA 常携带Ⅰ、Ⅱ和Ⅲ型SCCmec基因,I 型SCCmec携带耐药基因较少,仅对β-内酰胺抗生素耐药;Ⅱ、Ⅲ型携带多种耐药基因,表现多重耐药。SCCmecⅣ、Ⅴ型多见于社区获得性MRSA 中,由于其基因盒较短,除mecA基因外几乎不携带其他耐药基因,因此仅对β-内酰胺抗生素耐药[7]。该研究还发现,MRSA 分离菌株以SCCmecⅣa 型为主,未发现SCCmecⅠ、Ⅲ及Ⅴ型菌株,这与杨琴等[8]2018年报道的深圳住院患儿MRSA 的感染以SCCmec Ⅳ型社区获得性MRSA 感染为主一致。但区别于CHENG[9]和吴宇等[10]对9 所医院309 株MRSA 分离菌株进行基因分型的检测结果:中国院内流行的MRSA 菌株以SCCmecⅢ型为主,其次为Ⅱ型,SCCmecⅠ~Ⅴ型占绝对优势。本研究结果显示,MRSA 分离菌株对青霉素、苯唑西林和头孢西丁等β-内酰胺类抗菌药物全部耐药,对奎奴普汀/达福普汀、利奈唑胺、万古霉素、替加环素、呋喃妥因、利福平和庆大霉素等均表现为敏感,SCCmecⅡ型MRSA 分离株对左氧氟沙星、环丙沙星及莫西沙星的耐药率高于SCCmecⅣa型,而SCCmecⅣa 型对红霉素、克林霉素耐药率高于SCCmecⅡ型。近年来,越来越多的研究发现Ⅳ和Ⅴ型MRSA 菌株正在取代传统的医院获得性MRSA 菌株,成为医院内感染的重要来源[11-12]。对于SCCmecⅣ和Ⅴ型MRSA 菌株院内传播的原因尚不清楚,部分研究猜测,其传播可能与社区获得性MRSA菌株的高感染率和遗传适应性有关[13-15]。但还需要进一步研究,以便更好地了解该类型菌株在院内传播的机制。
综上所述,本研究仅对临沂市人民医院某一时间段内47 株MRSA 分离菌株进行研究,具有一定的局限性,可能只反映当前医院MRSA 的流行趋势,无法推广到不同地区、不同医疗机构,后续研究可扩大样本量,更进一步对本地区MRSA 的流行进行分析。本研究结果可初步表明,本地区可能存在SCCmecⅣ和Ⅴ型MRSA 菌株医院传播的高风险,因此医院应提高病原学的相关诊断水平,及时监测到院内感染的新型MRSASCCmec基因分型,对临床预防和治疗MRSA感染提供参考依据,同时对有效控制MRSA 菌株的流行具有重要的意义。

