血清microRNA-122a、microRNA-124a及microRNA-125b对脓毒症休克并发肝损伤早期诊断及预后评估的临床价值*
桑珍珍,高杰,贾春梅,李勇
(沧州市中心医院 急诊科,河北 沧州 061001)
脓毒症是由感染引起机体炎症反应失控导致的危及生命的器官功能障碍[1]。急性肝损伤可发生在脓毒症的任何阶段,脓毒症休克时肝脏微循环处于低灌注状态,容易出现肝组织和细胞的损伤、缺血和坏死[2]。有研究报道,microRNA 在调控炎症及肝功能方面发挥重要作用,但其对脓毒症相关肝损伤的诊断效能及预后价值尚缺乏相关研究[3-4]。本研究通过检测脓毒症休克患者血清microRNA-122a(miR-122a)、microRNA-124a(miR-124a) 及microRNA-125b(miR-125b)的相对表达量,分析其对脓毒症休克合并肝损伤早期诊断及预后评估的临床价值。
1 资料与方法
1.1 一般资料
选取2016年12月—2019年2月沧州市中心医院急诊重症监护室(EICU)收治的254 例脓毒症休克患者作为研究对象。患者年龄18~80 岁,病例资料完整。根据是否发生肝损伤将患者分为肝损伤组和无肝损伤组,分别有86 和168 例。肝损伤组再按肝损伤严重程度分为轻、中、重度肝损伤组,分别有20、25 和41 例。肝损伤组治疗28 d 后根据生存情况分为存活组和死亡组,分别有26 和60 例。选取同期本院健康体检者40 例作为对照组。患者均符合脓毒症与脓毒性休克国际处理指南(2016 版)的诊断标准[1]:脓毒症为感染后序贯器官衰竭估计(SOFA)评分≥2 分;脓毒性休克指脓毒症患者经充分液体复苏仍存在持续性低血压,需要血管活性药物维持平均动脉压(mean arterial pressure,MAP)≥65 mmHg,血乳酸(Lac)水平>2 mmol/L。肝损伤组患者同时符合脓毒症相关肝损伤诊断标准[5]。排除标准:①既往有肝脏肿瘤、慢性肝脏疾病、梗阻性黄疸及慢性肝功能障碍急性发作入住EICU;②中毒或药物性肝损伤等非脓毒症原因引起的肝损伤;③年龄<18 岁或>80 岁;④病例资料完整性不能满足研究要求。本研究符合伦理学标准,并经医院伦理委员会批准,检查和治疗均获得患者家属的知情同意。
1.2 脓毒症相关肝损伤诊断标准
血清谷丙转氨酶(ALT)或直接胆红素升高至正常值上限(normal upper limit,ULN)2 倍以上;或血清谷草转氨酶(AST)、碱性磷酸酶(ALP)和总胆红素(TBIL)同时升高,且其中有≥1 项升高至ULN 的2 倍以上。ALT 升高定义为>80 u/L,TBIL 升高定义为>34.1μmol/L。轻度组:1<ALT/ALTULN<3或1<TBIL/TBILULN<2;中度组:3<ALT/ALTULN<5 或2<TBIL/TBILULN<3;重度组:ALT/ALTULN>5 或TBIL/TBILULN>3[5]。
1.3 观察指标
记录患者入EICU 当日的一般资料,包括年龄、性别、感染部位、心率(HR)、MAP、中心静脉压(central venous pressure,CVP)、去甲肾上腺素(NE)用量、Lac、氧合指数、血常规、生化指标、机械通气、急性生理学和慢性健康状况评估Ⅱ(APACHE Ⅱ)评分及SOFA 评分等,记录患者治疗28 d 后的预后。
1.4 标本采集与检测
患者入院当天(治疗前)采集患者肘静脉血5 ml,3 000 r/min 离心10 min,取血浆于-80 ℃保存,待 测miR-122a、miR-124a 及miR-125b 相 对表达量。血清miRNA 提取及检测:在miRBase 上查找目的基因序列,由美国Invitrogen 公司设计合成引物,提取血清miRNAs,合成cDNA。以U6 作为内参,在9700 型基因扩增仪中扩增miRNAs。RT-PCR 反应条件:95℃预变性10 min,95℃变性10 s,60℃退火60 s,共40 个循环。采用2-ΔΔCt法计算miR-122a、miR-124a 及miR-125b 的相对表达量。
1.5 统计学方法
数据分析采用SPSS 23.0 统计软件,计量资料以均数±标准差(±s)或中位数和四分位数间距 M(P25,P75)表示,比较用t检验、方差分析、Mann-WhitneyU检验或H检验;计数资料以构成比或率(%)表示,比较用χ2检验。绘制受试者工作特征(receiver operating characteristic curve,ROC)曲线,采用二元Logistic 回归法分析影响脓毒症休克患者预后的危险因素,P<0.05 为差异有统计学意义。
2 结果
2.1 各组临床资料比较
肝损伤组与无肝损伤组降钙素原(PCT)、APACHE Ⅱ评分、SOFA 评分及治疗28 d 后病死率比较,差异有统计学意义(P<0.05),肝损伤组高于无肝损伤组。见表1。
轻、中、重度肝损伤组治疗前的APACHE Ⅱ评分、SOFA 评分、治疗28 d 后病死率及PCT 水平比较,差异有统计学意义(P<0.05),重度肝损伤组高于轻、中度肝损伤组。见表2。
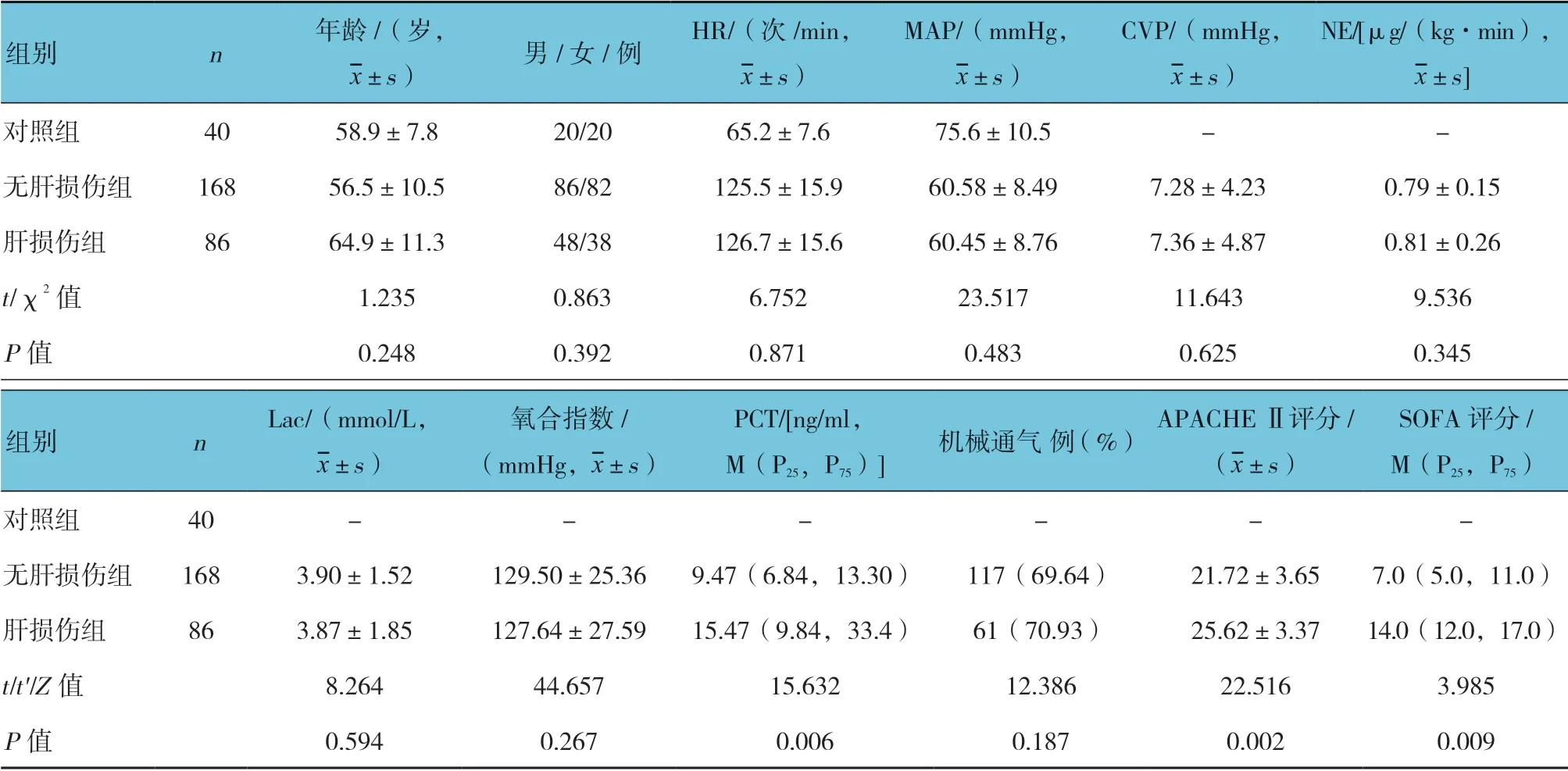
表1 各组临床资料比较
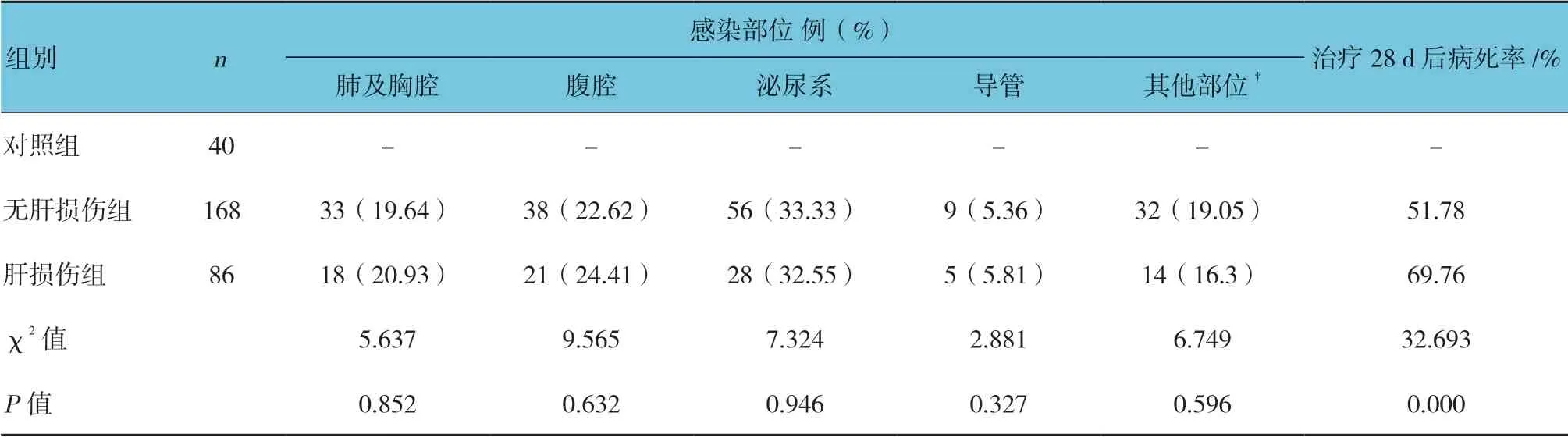
续表1
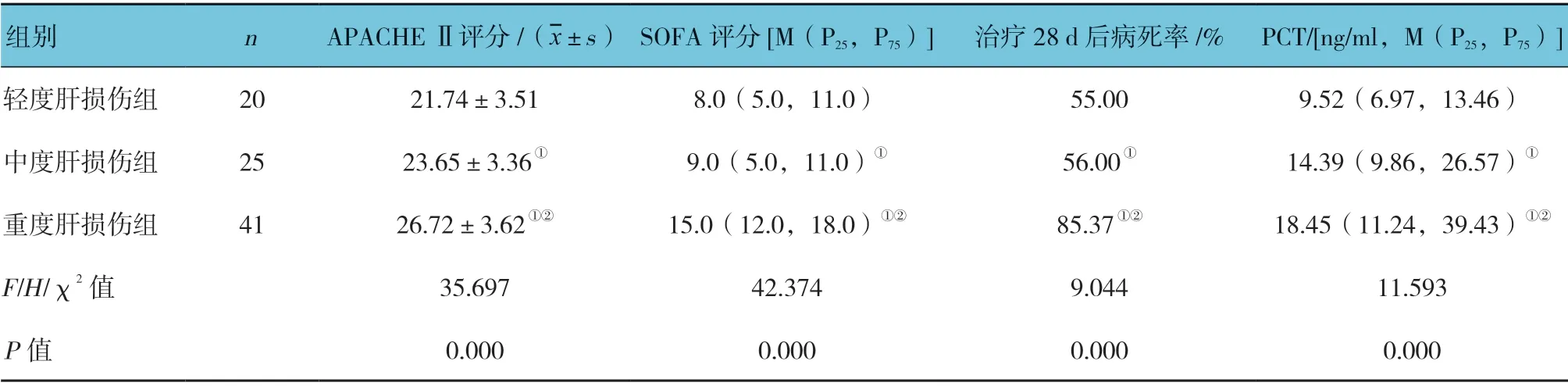
表2 不同程度肝损伤组临床资料比较
2.2 各组血清miR-122a、miR-124a、miR-125b 相对表达量比较
肝损伤组、无肝损伤组和对照组血清miR-122a、miR-124a 及miR-125b 相对表达量比较,差异有统计学意义(P<0.05),肝损伤组、无肝损伤组高于对照组(P<0.05)。见表3。
各组血清miR-122a、miR-124a 及miR-125b 相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05),重度肝损伤组高于轻、中度肝损伤组(P<0.05)。见表4。
血清miR-122a、miR-124a 及miR-125b 诊断脓毒症休克合并肝损伤的AUC 分别为:0.796(95% CI:0.728,0.854)、0.771(95% CI:0.701,0.832)和0.784(95% CI:0.715,0.840)。当miR-122a 表达量最佳临界值为2.80 时,其诊断脓毒症休克合并肝损伤的敏感性为71.76%(95% CI:67.24%,76.50%),特异性为75.29%(95% CI:71.36%,79.48%)。当miR-124a 表达量最佳临界值为2.56 时,其诊断脓毒症休克合并肝损伤的敏感性为63.53%(95% CI:60.13%,67.52%),特异性为81.18%(95% CI:78.96%,85.47%);当miR-125b 表达量最佳临界值为2.59 时,其诊断脓毒症休克合并肝损伤的敏感性为72.90%(95% CI:69.58%,78.65%),特异性为78.80%(95% CI:72.66%,83.73%)。见图1。
表3 各组血清miR-122a、miR-124a、miR-125b 相对表达量比较 (±s)
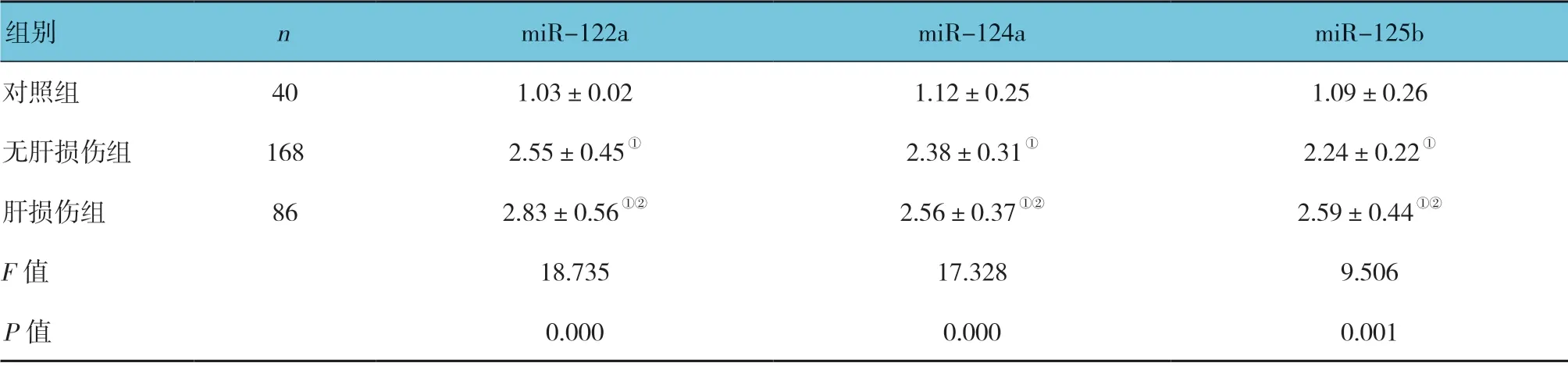
表3 各组血清miR-122a、miR-124a、miR-125b 相对表达量比较 (±s)
注:①与对照组比较,P <0.05;②与无肝损伤组比较,P <0.05。
组别 n miR-122a miR-124a miR-125b对照组 40 1.03±0.02 1.12±0.25 1.09±0.26无肝损伤组 168 2.55±0.45① 2.38±0.31① 2.24±0.22①肝损伤组 86 2.83±0.56①② 2.56±0.37①② 2.59±0.44①②F 值 18.735 17.328 9.506 P 值 0.000 0.000 0.001
表4 各组入院即刻血清miR-122a、miR-124a 及miR-125b 相对表达量比较 (±s)
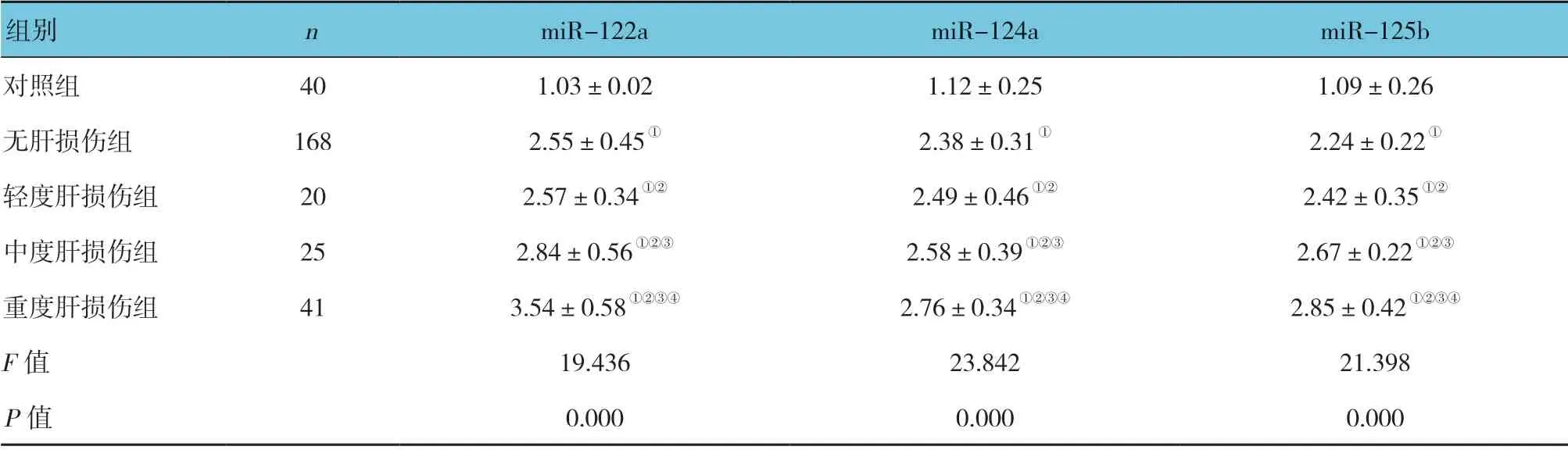
表4 各组入院即刻血清miR-122a、miR-124a 及miR-125b 相对表达量比较 (±s)
注:①与对照组比较,P <0.05;②与无肝损伤组比较,P <0.05;③与轻度肝损伤组比较,P <0.05;④与中度肝损伤组比较,P <0.05。
组别 n miR-122a miR-124a miR-125b对照组 40 1.03±0.02 1.12±0.25 1.09±0.26无肝损伤组 168 2.55±0.45① 2.38±0.31① 2.24±0.22①轻度肝损伤组 20 2.57±0.34①② 2.49±0.46①② 2.42±0.35①②中度肝损伤组 25 2.84±0.56①②③ 2.58±0.39①②③ 2.67±0.22①②③重度肝损伤组 41 3.54±0.58①②③④ 2.76±0.34①②③④ 2.85±0.42①②③④F 值 19.436 23.842 21.398 P 值 0.000 0.000 0.000
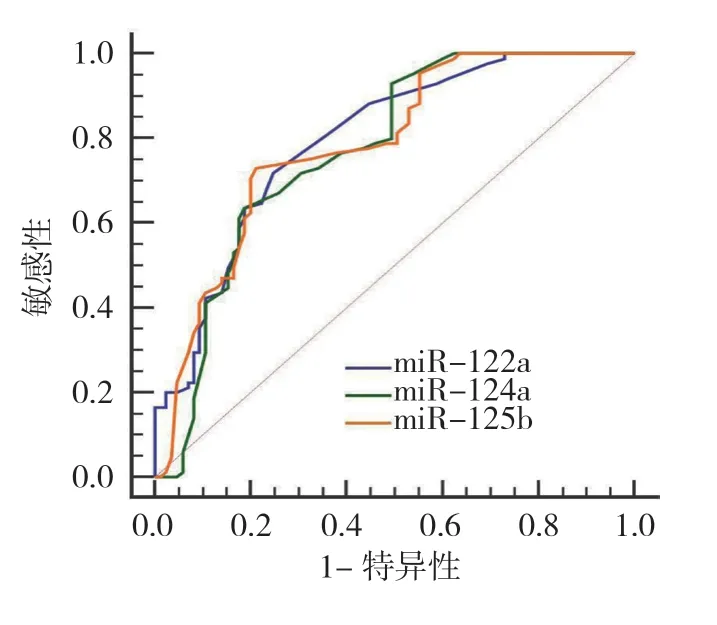
图1 血清miR-122a、miR-124a 及miR-125b 诊断脓毒症休克合并肝损伤的ROC 曲线
2.3 死亡组与存活组临床资料比较
死亡组与存活组治疗28 d 后APACHE Ⅱ评分、SOFA 评分、Lac、PCT、肝损伤严重程度,血清miR-122a、miR-124a 及miR-125b 相对表达量比较,差异有统计学意义(P<0.05),死亡组高于存活组。见 表5。
2.4 脓毒症休克合并肝损伤预后危险因素的Logistic 回归分析
以肝损伤严重程度、APACHE Ⅱ评分、SOFA 评分、PCT、Lac、miR-122a、miR-124a 及miR-125b 作 为 自变量,脓毒症休克合并肝损伤患者入院28 d 后是否死亡作为因变量(0 为否,1 为是)行二元Logistic 回归分析。肝损伤严重程度、APACHE Ⅱ评分、SOFA 评分和miR-122a 是影响脓毒症休克合并肝损伤患者预后的危险因素(P<0.05)。见表6。
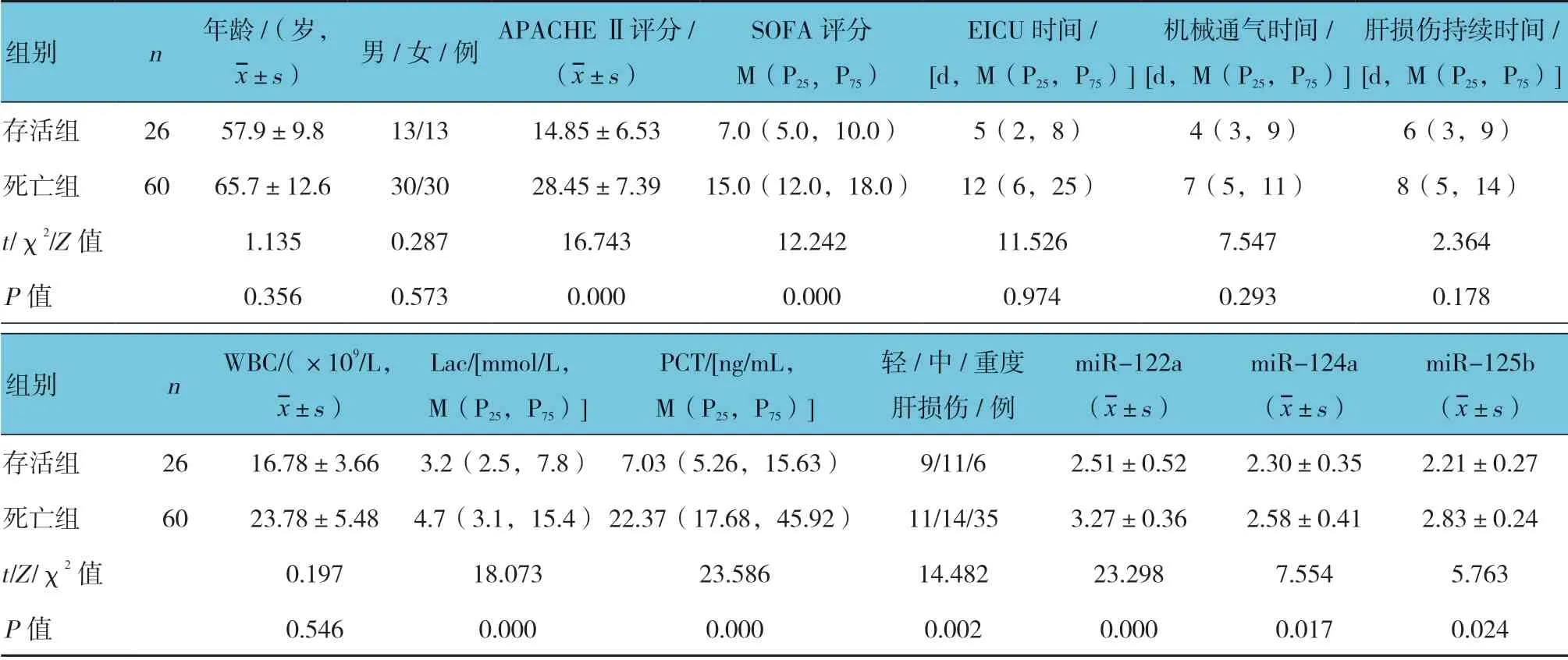
表5 死亡组与存活组临床资料比较
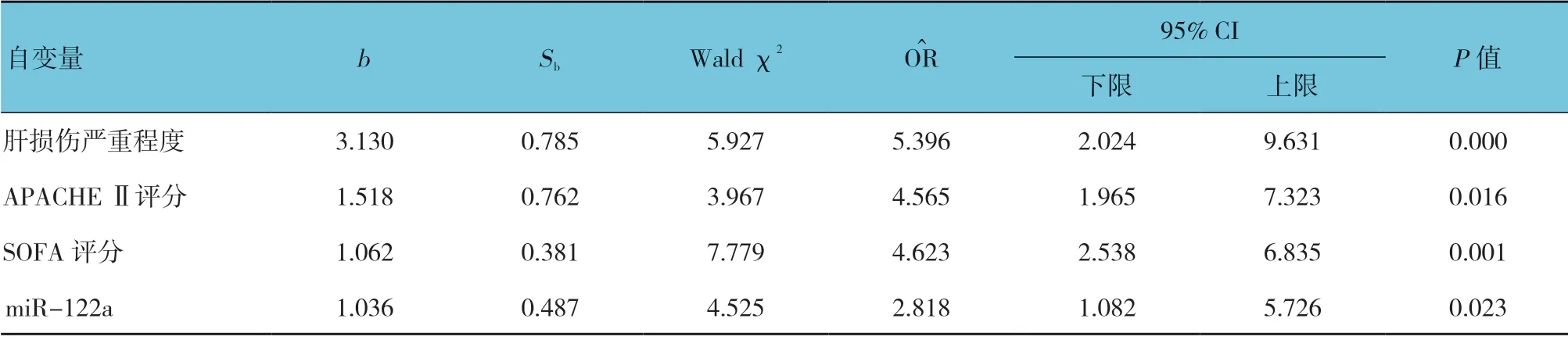
表6 毒症休克合并肝损伤预后危险因素的Logistic 回归分析参数
3 讨论
脓毒症最新定义为感染的宿主反应失调引起的致命性器官功能障碍[1]。脓毒性休克为脓毒症的一个亚组,具有较高的病死率,是ICU 患者主要死亡原因之一[6]。脓毒症肝损伤的机制众多,按发病机制不同可分为缺血缺氧性损伤、肝细胞性肝损伤和胆汁淤积性损伤[7]。脓毒症休克引起的肝损伤主要为缺血缺氧性损伤,脓毒症休克时肝脏微循环也处于低灌注状态,肝窦内皮细胞功能的紊乱,中性粒细胞浸润,肝组织细胞缺血和坏死[8]。
有研究报道,miR-122a 能抑制抗凋亡基Bcl-xL、Bcl-2表达,导致大量淋巴细胞凋亡,免疫功能抑制,脓毒症后期感染难以控制[9]。有研究报道,在急性呼吸窘迫损伤综合征患者中,血清miR-122a 相对表达量的升高与病死率和急性肝损伤有关[10]。本研究显示,肝损伤组血清miR-122a 相对表达量显著高于无肝损伤组,并随肝损伤程度加重呈递增趋势;死亡组患者血清miR-122a 相对表达量显著高于存活组,表明血清miR-122a 可用于脓毒症休克合并肝损伤的早期诊断、严重程度和预后评估。
有研究报道,miR-124 参与炎症、自身免疫性及肝脏疾病的发生、发展[11]。有研究报道,miR-124a 通过靶向作用于白细胞介素-11,抑制肝细胞增殖,促进肝细胞凋亡,为肝癌的诊断和临床治疗提供新的靶点[12]。miR-124-3p 在大鼠肝撞击损伤模型中作为Beclin1 和LC3 表达的负调控因子,调节肝细胞自噬,减轻肝脏损伤[13]。miR-125 参与炎症反应、免疫反应和缺血再灌注损伤、肝脏损伤等生理和病理过程[14-15]。在异烟肼诱导的肝损伤过程中,DNA 甲基化可能调控miR-125b 的表达,影响STAT-3 的表达,参与肝损伤过程[16]。在脂多糖诱导内皮细胞损伤的体外模型中,miR-125b 表达上调时可抑制TRAF6 介导的NF-κB激活,减弱细胞间黏附分子-1 和血管细胞黏附分子-1的表达;在脓毒症小鼠模型中,减少心肌巨噬细胞和中性粒细胞的聚集,降低血清肿瘤坏死因子-α 和白细胞介素-1β 等炎症因子,减轻脓毒症引起的心功能障碍,提高生存率[17]。本研究显示,肝损伤组血清miR-124a、miR-125b 相对表达量高于对照组,随着miR-125b 相对表达量的升高,肝损伤程度逐渐加重,病死率逐渐升高,血清miR-125b 相对表达量对脓毒症休克合并肝损伤的早期诊断具有临床价值。
综上所述,通过ROC 曲线分析发现miR-122a、miR-124a 及miR-125b 对脓毒症休克合并肝损伤有早期诊断价值,提示可作为脓毒症休克合并肝损伤的新型生物标志物。通过二元Logistic 回归分析发现miR-122a 是影响脓毒症休克患者预后的独立危险因素。本研究尚有许多不足之处:miRNAs 表达量的测量应如何标准化以考虑个体或群体间的差异尚不清楚,需要在细胞、组织及动物水平作进一步深入研究。

