纳尔逊海湾病毒μNS蛋白与σNS蛋白的表达分析
董晗,郑国峰,张军,李永刚
(1.中国医科大学附属第四医院 呼吸内科,辽宁 沈阳 110005;2.锦州医科大学 病原微生物教研室,辽宁 锦州 121000)
纳尔逊海湾病毒(nelson bay virus,NBV)是呼肠孤病毒科中的一种双链核糖核酸(dsRNA)病毒,包含10 个分节段dsRNA。根据RNA 的大小,将其分为大(L1~L3)、中(M1~M3)及小(S1~S4)3 组。μNS 蛋白由M3 基因组区段编码,σNS 蛋白由S3 基因组区段编码,这2 种蛋白在病毒增殖过程中发挥重要作用。本研究利用免疫荧光及共聚焦的方法研究NBV 病毒μNS 和σNS 蛋白的表达及两者的相互作用,深入研究病毒增殖机制及感染机制。
1 材料与方法
1.1 材料
BSR 细胞购于美国ATCC 细胞 库,DMEM 培养基、opti-MEM 培养基、山羊抗兔-488、山羊抗鼠-594、 转染试剂Lipofectmine 2000、HRP 羊 抗兔抗体、HRP 羊抗鼠抗体、Alexa594 羊抗鼠抗体及Alexa488 羊抗兔抗体均购于美国Invitrogen 公司,PMSF 购于北京索莱宝生物科技有限公司,μNS 多克隆抗体(兔制备)由锦州医科大学病原微生物教研室自制[1],pCAG-M3、pCAG-S3 及NBV 病毒[本研究采用的毒株是2007年从印度尼西亚巴厘岛返回日本的呼吸道感染患者身上分离出的NBV 病毒株,该病毒株被命名 为Miyazaki-Bali/2007(MB)[2-3]],σNS 多克隆抗体(鼠制备)由日本大阪大学微生物病研究所病毒免疫研究室小林刚教授惠赠。
1.2 方法
1.2.1 细胞培养及病毒感染 将BSR 细胞培养于含8%胎牛血清的高糖DMEM 培养基中,细胞达到所需数量时,将BSR 细胞以3×106个/板的密度接种在6 cm 细胞培养板上做质粒转染。将BSR 细胞培养于含8%胎牛血清的高糖DMEM 培养基中,细胞达到所需数量时,接种于带有细胞爬片的24 孔板内,次日用NBV 病毒感染,24 h 后进行免疫荧光检测。
1.2.2 质粒转染 将10μg pCAG-M3 及pCAG-S3 分别转染或共同转染至细胞。质粒与200μl Opti-MEM培养基混合5 min,将25μl 转染试剂与200μl Opti-MEM 培养基混合5 min,再将稀释好的质粒及转染试剂混合,室温孵育20 min 后,添加到细胞培养基中。细胞在37℃下条件温育4~6 h,更换血清培养基,继续37℃温育24~48 h 后做免疫荧光检测。
1.2.3 免疫荧光 将感染病毒24 h 后的细胞用PBS-4%多聚甲醛固定20 min,用PBS 洗净后分别或共同与μNS 及σNS 多克隆抗体在37℃条件下孵育1 h。用PBS 冲洗3 次后,将细胞分别或共同与Alexa 594羊抗鼠抗体及Alexa 488 羊抗兔抗体在37℃条件下孵育1 h,然后PBS 洗3 次。采用荧光显微镜观察并获取图像。分别或共同转染pCAG-M3 及pCAG-S3 质粒BSR 细胞的免疫荧光实验方法同上,所用抗体同上。通过免疫荧光方法在共聚焦显微镜下观察μNS和σNS 蛋白在NBV 感染细胞和质粒转染细胞中的定位。为确定μNS 和σNS 是否在病毒包涵体样结构中共定位,将NBV 病毒以0.1 PFU/细胞的感染复数感染BSR 细胞,孵育24 h,免疫荧光后用共聚焦显微镜观察。先后用μNS 多克隆抗体、Alexa488 的羊抗兔抗体对μNS 蛋白进行免疫染色。先后用σNS 多克隆抗体、Alexa594 的羊抗鼠抗体对σNS 蛋白进行免疫染色,未感染细胞作为对照。为证明当在没有其他NBV 蛋白表达的情况下,μNS 可以形成病毒包涵体样结构,用pCAG-M3 质粒(含有来自NBV 的M3基因表达载体)转染BSR 细胞,通过免疫荧光方法在24 h 共聚焦显微镜下观察μNS 在细胞中的分布。将pCAG-M3 及pCAG-S3 质粒共转染至BSR 细胞,细胞孵育24 h 后用共聚焦显微镜观察。先后用μNS 多克隆抗体和Alexa488 羊抗兔抗体对μNS 蛋白进行免疫染色。先后用σNS 多克隆抗体和Alexa594 羊抗小鼠抗体对σNS 蛋白进行免疫染色。未转染质粒的细胞用作对照。
1.2.4 免疫印迹检测细胞μNS 的表达 用PBS 将细胞从培养皿上吹下,以1 000 r/min 离心3 min,弃上清,加入500μl NP-40 细胞裂解液、5μl PMSF 于4℃摇动1 h 裂解细胞,5 000 r/min 离心5 min,取上清液。取20μl 上清液加入10μl 2×样本液106℃加热10 min,静置为室温后取实验组及对照组各20μl蛋白样品于聚丙烯酰胺凝胶上行SDS-PAGE,结束后20V 电转印至PVDF。使用5%脱脂牛奶封闭液中室温封闭1 h,稀释μNS 或σNS 多克隆抗体,4℃孵育过夜。PBS 洗膜4 次,加入稀释HRP 羊抗兔抗体或HRP 羊抗鼠抗体,37℃孵育1 h,洗膜。加入电化学发光液曝光显色。为进一步证明NBV 病毒感染细胞中μNS 及σNS 蛋白的表达,将NBV 病毒感染细胞的裂解物进行免疫印迹分析,一抗使用μNS 和σNS 多克隆抗体,二抗使用HRP 羊抗兔抗体和HRP 羊抗鼠抗体。转染pCAG-S3 质粒细胞的免疫印迹分析使用兔制备的μNS 多克隆抗体作为一抗,二抗使用HRP羊抗兔抗体。转染pCAG-M3 质粒细胞的免疫印迹分析实验使用兔制备的μNS 多克隆抗体作为一抗,二抗是HRP 羊抗兔抗体。
2 结果
2.1 感染细胞中确认μNS and σNS 的蛋白表达
μNS 和σNS 蛋白都以类似的点状致密结构呈现,这种小的点状致密结构即为包涵体样结构,且这2 种蛋白在细胞质中,尤其是在病毒包涵体样结构中共定位(见图1)。在未感染的细胞中未观察到μNS和σNS 蛋白。免疫印迹结果可见感染细胞裂解物75 kD 大小处有蛋白表达即为μNS 蛋白,感染细胞裂解物34 kD 处有蛋白表达即为σNS 蛋白,未感染的细胞作阴性对照(见图2)。
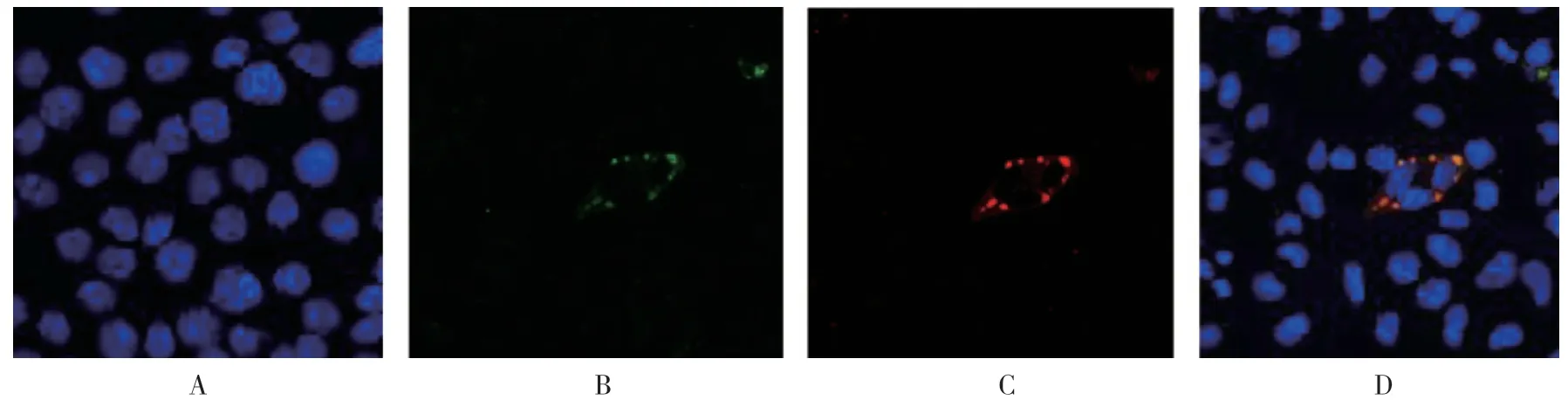
图1 μNS 和σNS 蛋白在NBV 感染BSR 细胞中的定位 (×400)
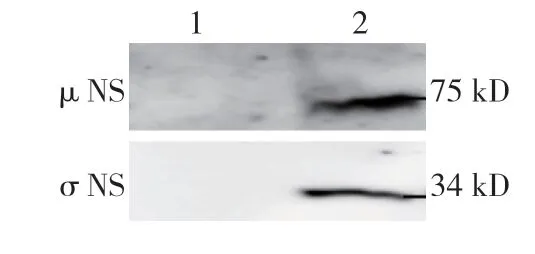
图2 μNS 和σNS 蛋白在NBV 感染BSR 细胞中的表达
2.2 单独转染pCAG-M3 或pCAG-S3 质粒细胞中μNS 和σNS 蛋白的表达
细胞质中观察到小点状结构,即病毒包涵体样结构。用pCAG-S3 质粒(含有来自NBV 的S3 基因表达载体)转染BSR 细胞时,观察到σNS 蛋白在整个细胞质中表现出弥散分布,没有形成点状结构。未转染细胞为阴性对照。见图3。
免疫印迹结果可见质粒转染细胞裂解物75 kD 大小处有蛋白表达即为μNS 蛋白,未转染细胞用作对照。免疫印迹结果可见质粒转染细胞裂解物34 kD 处有蛋白表达即为σNS 蛋白,未转染细胞用作对照。见图4。
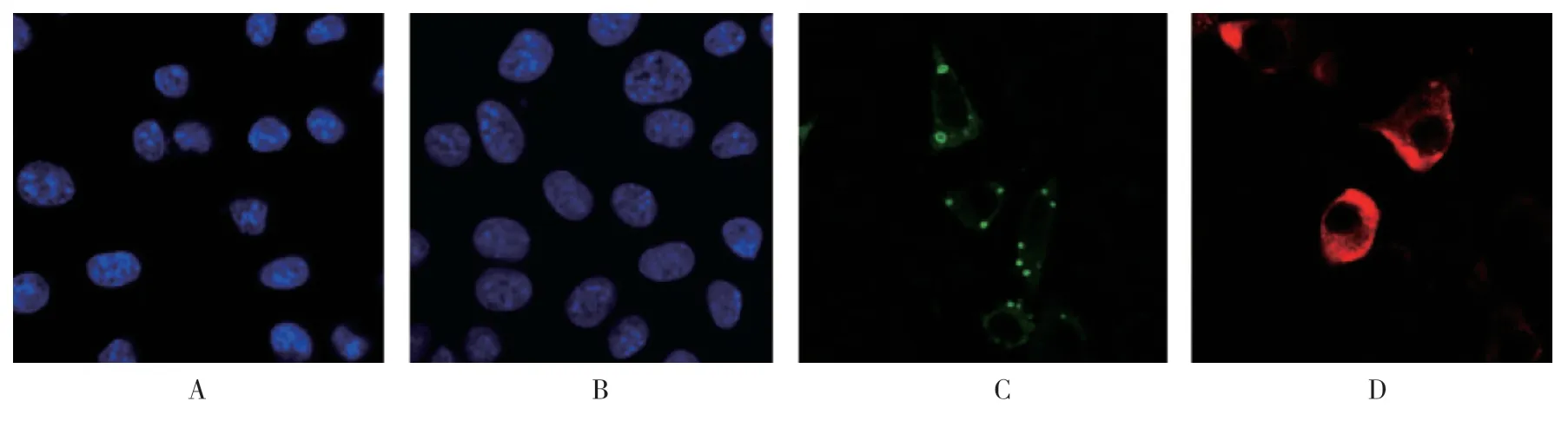
图3 单独转染细胞中NBV μNS 和σNS 蛋白的定位 (×400)

图4 单独转染质粒的细胞中μNS 和σNS 蛋白的表达
2.3 μNS 和σNS 蛋白共定位于pCAG-M3 和pCAG-S3 质粒共转染的BSR 细胞
在μNS 和σNS 2 个质粒共转染24 h 后的BSR细胞中,观察到与NBV 病毒感染的BSR 细胞相同现象:μNS 和σNS 蛋白在细胞质中,特别是在病毒包涵体样结构中共定位,可知σNS 蛋白通过与μNS蛋白的相互作用和μNS 蛋白在细胞中共定位。见 图5。
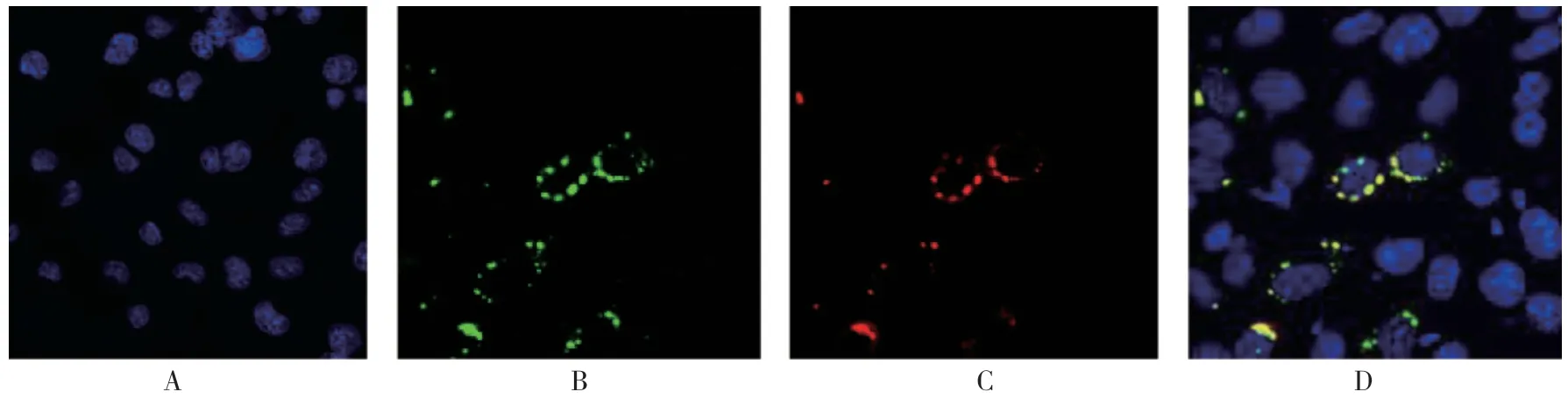
图5 μNS 和σNS 蛋白在共转染pCAG-M3 及pCAG-S3 细胞的细胞质中共定位 (×400)
3 讨论
NBV 是融合性正呼肠孤病毒家族中的一员,在呼肠孤病毒的培养过程中,根据病毒在感染细胞时是否具有诱导细胞融合的能力,将呼肠孤病毒分为细胞融合病毒与非融合病毒。禽类呼肠孤病毒(avian reovirus,ARV)、狒狒呼肠孤病毒、爬行类呼肠孤病毒、Broome 呼肠孤病毒及NBV 属于融合病毒。典型的哺乳动物呼肠孤病毒(mammalian reoviruses,MRV)属于非融合病毒[4-6]。正常情况下,非融合病毒MRV 十分常见,可引起人类无症状感染。融合性病毒感染虽可引起严重的动物疾病。在2006年之前,还未有过该病毒引起人类疾病的报道。然而2006年,NBV 病毒先后在马来西亚、香港等地的急性呼吸道感染患者体内被分离出来[7]。由此可知,NBV 已经进化成一种可以引起人畜共患病的病原体。
NBV 病毒感染细胞早期,细胞质中可观察到一种小型相密包涵体结构[8],随着感染的进展逐渐变得更大且向细胞核移动。有研究称这种小型的相密包涵体结构为inclusion body,笔者将其译为包涵体样结构。有文献证明,包涵体样结构是由dsRNA、多种蛋白质和完全组装的颗粒组成[9]。μNS 是呼肠孤病毒一种主要的非结构蛋白,由M3 基因组区段编码,蛋白质大小为75 kD。针对MRV 和ARV 的研究表明,非结构蛋白μNS 在细胞中独自表达,即可以在胞质内形成包涵体样结构,显微镜下观察该包涵体样结构与某些呼肠孤病毒株感染细胞期间形成的结构极为相 似[10-11]。其他MRV 和ARV 的研究结果还表明,μNS在质粒转染和病毒感染的细胞中都可形成包涵体样结构。当通过RNA 干扰敲除μNS 表达时,包涵体样结构的形成和病毒增殖被严重抑制;当以野生型μNS通过质粒转染方式在该细胞内表达时,病毒又得以继续增殖[12-13]。这些结果有力的表明,包涵体样结构的形成是MRV 成功增殖的重要且必要的条件。第2 种主要的呼肠孤病毒非结构蛋白σNS 也与包涵体样结构的形成有关[14]。σNS 是由S3 基因组区段编码的含有366 个残基、大小为41 kD 的蛋白质。σNS 蛋白对包括呼肠孤病毒mRNA 在内的单链RNA 具有很强的亲和力。有研究在从感染的细胞中分离呼肠孤病毒时,用核糖核酸酶A 处理后发现有大的(40~60 S)复合物解离[15],这暗示σNS 和RNA 在感染期间形成大的核蛋白复合物。在相关的MRV 研究中,已从病毒感染细胞后形成的单链RNA 复合物中分离出σNS、μNS 蛋白和结构蛋白σ3,表明这些蛋白质参与制备用于负链合成的病毒转录物,并将其包装到子代病毒的核心中。由于σNS 在感染过程中在包涵体样结构内定位,所以被认为可招募其他病毒蛋白并且参与dsRNA 的合成[16]。还有研究表明,其他呼肠孤病毒σNS 和μNS 蛋白有重塑内质网,构建新细胞器的功能[17]。本研究发现,μNS 与σNS 可以相互作用,且这种相互作用是造成病毒感染细胞中包涵体样结构中σNS 存在的直接原因。关于MRV、ARV 的研究都已说明μNS、σNS 蛋白在病毒增殖过程中的重要作用,但这2 种蛋白在可引起人类疾病的NBV 中的表达情况至今还未见报道。
本研究中笔者观察到,尽管σNS 在感染期间与包涵体样结构中的μNS 共定位,但当在没有μNS 表达的情况下,其在整个细胞中弥散分布。当与μNS共表达时,σNS 被重新分布并与μNS 在包涵体样结构中共定位。因此,σNS 对于功能性病毒包涵体样结构的形成是必需的,但是在不存在μNS 蛋白的情况下不能建立包涵体样结构。μNS 和σNS 在没有其他病毒蛋白的情况下相关联,表明这种关联可能介导σNS 定位于病毒感染细胞的包涵体样结构。与MRV和ARV的μNS和σNS蛋白相同,笔者的结果还表明,NBV 的μNS 蛋白在转染细胞中可独立表达,且在无任何其他病毒蛋白表达时即具有形成包涵体样结构的能力。上述结果说明,μNS 是NBV 病毒感染期间包涵体样结构形成的关键因素,且该蛋白质是包涵体形成所需的最小病毒成分。因此可知,μNS 在NBV 病毒增殖的早期阶段,通过形成病毒复制位点及募集病毒复制所必需蛋白的方式起重要作用。
综上所述,μNS 蛋白可在μNS 转染和NBV 病毒感染细胞中形成包涵体,σNS 蛋白可与μNS 蛋白相互作用。上述结果揭示σNS 蛋白可通过与μNS蛋白关联的方式被招募到包涵体样结构中,这对于病毒的复制和装配都非常重要,对呼肠孤病毒感染机制的研究、抗呼肠孤病毒药物的研发具有重要意义。

