腹腔镜巨脾切除加断流术治疗肝硬化门静脉高压症
刘成远 李俊江 穆 速 王 坤 韩祥松 崔广宾
(河南省商丘市第一人民医院胃肠肝胆三科,商丘 476100)
肝硬化门静脉高压症致脾肿大、脾功能亢进、门腔静脉交通支扩张,特别是食管下段、胃底形成的中重度静脉曲张,内科治疗效果不佳,往往需外科手术治疗。手术包括门体分流术和断流术,通常采用开腹手术。随着微创外科的发展,腹腔镜应用于脾切除、断流术逐渐从禁忌到相对禁忌。对于巨脾应用腹腔镜切除,欧洲内镜外科协会认为是禁忌证[1],国内外巨脾采用腹腔镜手术报道例数及手术经验较少。我院从2012年开始开展腹腔镜脾断流术,随着腹腔镜技术的发展和手术经验的积累,腹腔镜巨脾切除加贲门周围血管离断术逐渐应用。本研究回顾性分析我院2015年8月~2018年8月因巨脾、脾功能亢进合并食管胃底静脉中重度曲张行巨脾切除联合贲门周围血管离断61例资料,其中腹腔镜29例,开腹32例,探讨肝硬化巨脾患者通过腹腔镜实施断流术的可行性及疗效。
1 临床资料与方法
1.1 一般资料
纳入标准:明确诊断脾功能亢进合并食管胃底静脉中重度曲张,且具有严格手术适应证[2],脾最大径>22 cm或下缘超过脐水平线或腹正中线,CT证实无门静脉系统血栓形成。
排除标准:有中上腹部手术史;肝性脑病;Child C级;严重心肺功能异常、凝血功能障碍等不能耐受手术或气腹。
61例均完善腹部超声、增强CT和胃镜检查。术前肝功能Child-Pugh分级,A级36例,B级25例。术前向患者及家属充分介绍腹腔镜与开放手术各自可能的优缺点,由患者及家属选择手术方式,行腹腔镜手术29例,开腹手术32例。2组性别、年龄、脾长径、血常规、肝功能分级、上消化道出血史、食管胃底静脉曲张程度(胃镜判断)等差异均无显著性(P>0.05),见表1。
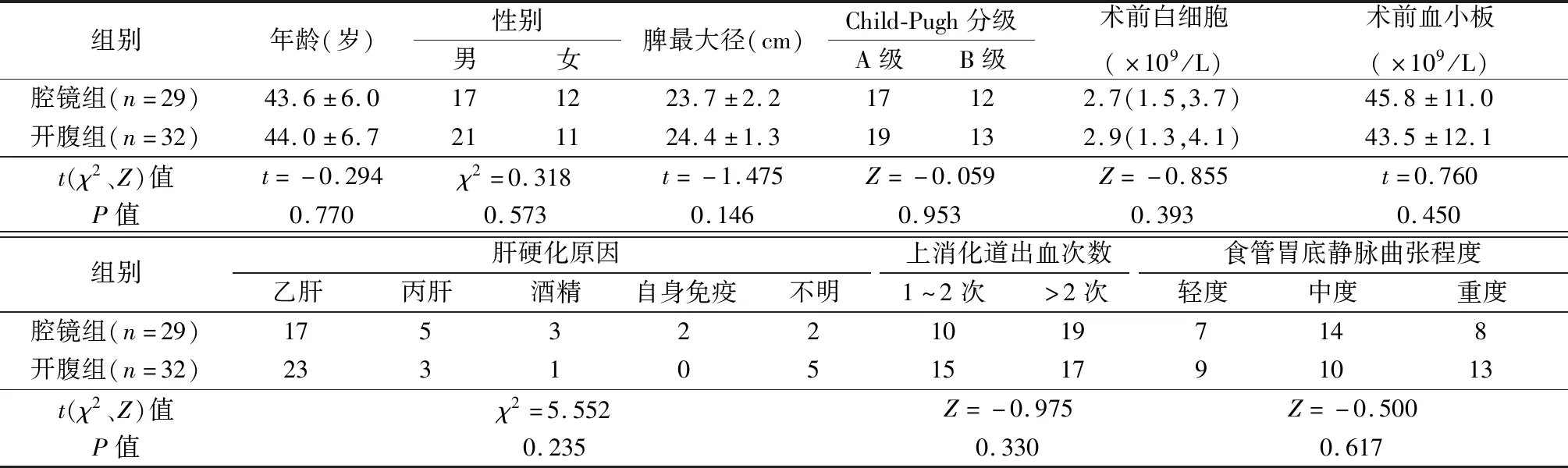
表1 2组一般资料比较
1.2 手术方法
2组均由同一手术组完成。全麻,仰卧分腿位,左侧垫高。常规备自体血回输机。
腹腔镜组:脐上缘(超过脐应偏右,术前叩诊或超声定位画出脾标识)10 mm切口建立气腹,气腹压13~15 mm Hg(1 mm Hg=0.133 kPa)。右倾位,直视下分别于剑突下、左腋前线脾下2 cm、左锁骨中线脾下2 cm分别置入5 mm、5 mm、12 mm trocar,对于难分离者可于右锁骨中线肋缘下直视置入5 mm trocar。切脾:探查腹腔后用超声刀小心分离脾结肠韧带、脾胃韧带、脾肾韧带、脾膈韧带(注意胰尾)直至脾呈游离状态(图1~5)。其中13例于胰腺上缘找到脾动脉,丝线双重结扎或Hem-o-lok夹闭后用超声刀断脾蒂;16例用二级脾蒂分离法(图6)或腔内切割闭合器断脾蒂(图7)。脾切除后置入标本袋中推至盆腔。处理贲门周围血管:用超声刀打开肝胃韧带,沿胃小弯游离结扎离断胃冠状静脉胃支和食管支,挑起胃,游离胃后及胃左动脉(图8),左侧牵拉抬高胃体,离断左膈下静脉,继续向上游离食管约6~8 cm(图9),确保离断高位及异高位食管支。在一次性标本取物袋中粉碎脾,延长左腋前线或正中切口3~5 cm,取出标本。反复冲洗腹腔,确保术区无出血,于脾窝放置1根引流管。

图1 处理脾下极及血管 图2 处理脾结肠韧带 图3 处理胃脾韧带和胃短血管 图4 双重结扎脾动脉 图5 处理脾肾及脾膈韧带 图6 二级脾蒂分离法处理脾蒂血管 图7 应用腔内切割闭合器处理脾蒂 图8 处理胃左动静脉及胃后血管 图9 游离食管下端约6~8 cm
开腹组:左肋缘下斜切口或“L”形切口约20 cm,细致分离脾周围韧带及粘连,一级或二级法缝扎脾血管处理脾蒂,取出脾脏后行贲门周围血管离断术,放引流。
出院后1、3、6个月门诊或电话随访,此后每半年随访一次。随访内容主要包括上消化道造影或胃镜检查食管胃底静脉曲张程度,以及腹部血管彩超检查是否形成门静脉血栓。
1.3 观察指标
比较2组手术时间,术中出血量(包括吸引器的血量和敷料内血量)、术后排气时间、术后引流管拔除时间(连续2天引流淡黄色积液<50 ml)、术后3天和1周血常规以及术后住院时间(拔管后腹部无不适2~3天可出院),记录术后并发症包括发热(体温>38.5 ℃需要用药干预者)、切口感染、肺部感染、腹腔出血(腹腔引流管一次引流出血性引流液>500 ml或者连续3 h>200 ml/h)、胰漏[3](术后≥3 d任意引流液淀粉酶浓度>血清淀粉酶上限3倍)、门静脉血栓(血管彩超确认)。
1.4 统计学方法
2 结果
2.1 2组手术情况比较
2组手术时间、术后1周血白细胞和血小板计数差异无显著性(P>0.05),但腹腔镜组术中出血量、术后排气时间、拔除引流管时间、术后住院时间均优于开腹组,差异有显著性(P<0.05),见表2。
2.2 并发症及随访情况
腹腔镜组术后发热、切口感染、肺部感染、腹腔出血、胰漏发生率均低于开腹组,但差异无显著性(P>0.05),2组均无再次上消化道出血。腹腔镜组术后1周、2周、3个月门静脉系统血栓形成发生率均低于开腹组,差异有显著性(P<0.05),见表3。术后发热、切口感染、肺部感染、腹腔出血均对症治疗治愈;胰漏均经充分引流治愈,其中开腹组1例1个月拔引流管,其余5例术后7~14天拔管。术后门静脉血栓均给予抗凝,3个月内未进一步发展。
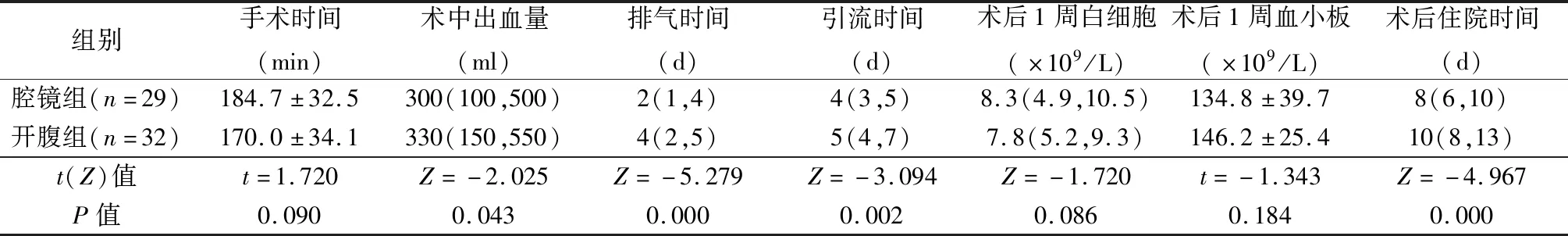
表2 2组手术情况比较
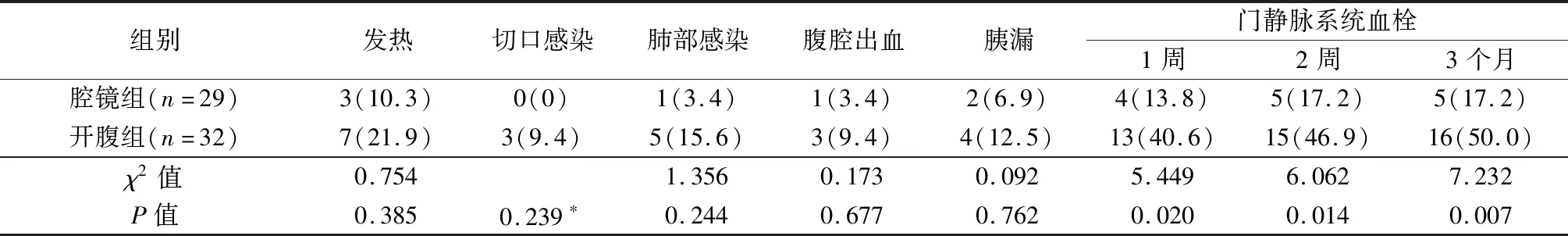
表3 2组并发症比较[n(%)]
*Fisher精确检验
3 讨论
肝硬化门静脉高压症首选术式是脾切除联合贲门周围血管离断术[4]。腹腔镜脾切除术大多局限于血液性脾功能亢进、良性肿瘤和肝硬化导致的小脾脏。对于肝硬化门脉高压的巨脾腹腔镜手术风险较大,对患者的一般条件、手术器械以及医生的腹腔镜经验均有较高的要求,巨脾的腹腔镜手术视野和术中大出血的处理对手术医生的心理更是一种挑战。张豫峰等[5]报道从2003年开始对肝硬化门静脉高压行腹腔镜巨脾切除,认为如果患者一般情况好,有良好的腔镜技术配合超声刀和切割闭合器等,此手术是可行的。
本研究对比腹腔镜与开腹脾切除联合贲门周围血管离断术,结果显示腹腔镜组术中出血、术后排气时间、引流时间、术后住院时间均优于开腹组,而手术时间没有明显增加,提示腹腔镜具有优越性,主要归因于腹腔镜脾切除炎症反应轻,相对微创,游离细致,术后得以快速康复[6]。腹腔镜组术后发热、腹腔出血、胰漏发生率低,说明腹腔镜巨脾切除是安全的。2组差异无显著性可能与例数少有关。腹腔镜组术后切口感染发生率较低,可能与腹腔镜手术切口小,术中操作细致,标本取出不与皮肤接触,术后疼痛轻,机体免疫力恢复快等有关。腹腔镜组术后1周、2周、3个月门脉系统血栓形成率较开腹组低。Zhang等[7]报道开腹脾切除术后门脉系统血栓发生率为47.8%,与本研究基本相符。
腹腔镜巨脾切除加断流术的关键是预防和处理术中大出血,我们的体会是:①术前应积极准备,备血,改善营养、肝功能、凝血功能。李巍等[8]认为术前行脾动脉CTA检查有助于减少术中出血。有条件的医院应常规备自体血回输机[9]。②对于脾周韧带的处理,建议先游离脾结肠韧带,这样助手可以协助暴露脾脏,而后依次处理脾胃韧带、脾肾韧带和脾膈韧带,最后游离脾膈韧带有利于脾门的显露和减少大出血风险,即先处理脾上下极后处理脾蒂法[10]。游离脾周韧带应采用超声刀或LigaSure[11],可以避免不必要的出血。③早期开展此术式不建议应用丝线或Hem-o-lok夹处理脾蒂血管,可应用腔内切割闭合器,以降低出血概率和节约手术时间。但应充分游离胰尾,切勿损伤。有成熟的腹腔镜经验后可采用脾蒂优先处理法[12]。④建议先结扎脾动脉,不结扎脾静脉,这样可以减少脾的体积和提高手术安全性,但对于脾动脉周围粘连难以找到或游离者不可勉强,可应用腔内切割闭合器,有经验者可应用二级脾蒂分别游离法断脾蒂。⑤应充分游离血管,不可盲目操作,对于出血也不能盲目钳夹,大出血时可用纱布填塞后积极开腹。早期开展此术式开腹率较高,但随着器械操作熟练和手术技巧提高,开腹率会下降。本研究无中转开腹。⑥对于贲门周围血管应彻底全面离断,否则术后短期内会再次出血,特别是冠状静脉发出的异高位食管支,术中暴露困难,易被忽视,因此在游离食管时应距贲门6~8 cm甚至更高。⑦对于标本的取出,我们曾尝试旋切器等器械均不理想,目前采用整体标本放入自制的腔镜袋中,剪至3~5段,自体血回输机吸出脾脏残存血,延长左腋前线或正中切口3~5 cm取出标本。
综上,对于肝硬化门脉高压致巨脾、脾功能亢进、门腔静脉交通支扩张的外科治疗,腹腔镜下巨脾切除加断流术是可行的,且较开腹具有创伤小、并发症发生率低、炎症反应轻、患者恢复快的优势。

