剑突下与双侧胸入路电视胸腔镜胸腺扩大切除治疗重症肌无力的比较
邱志宏 陈 艰 陈立如 林 庆 吴 昊 孙黄涛 周 鑫 柳阳春 徐 全
(江西省人民医院胸外科,南昌 330006)
重症肌无力(myasthenia gravis, MG)是一种累及神经肌肉接头的免疫性疾病,以骨骼肌易疲劳、肌力下降为典型表现,由于胸腺被认为是MG发病的重要靶器官,胸腺切除是治疗此类患者的有效方法之一。20世纪90年代,电视胸腔镜手术(video-assisted thoracoscopic surgery,VATS)开始用于胸腺扩大切除,手术疗效和微创优势已得到证实[1~4]。Jaretzki等[5]报道颈部脂肪组织和纵隔胸腺组织异位灶的发生率为98.0%,需要“最大限度”胸腺切除以确保切除所有胸腺组织,并强烈主张对MG患者切除所有这些异位胸腺及脂肪。右侧入路VATS在切除左侧前纵隔脂肪,胸腺左上极及左侧心膈角脂肪等方面有诸多限制,双侧胸入路VATS虽然可以做到相对彻底胸腺扩大切除[6~9],但需要更多的手术位点,手术创伤相对较大。近年来,剑突下入路电视胸腔镜胸腺扩大切除成为治疗MG的一种新的微创手术方法[10, 11],此入路可充分显露前纵隔、双侧膈神经、无名静脉及左、右胸腺上极等手术区域,提供更好的双侧胸膜腔视野,获得与类似正中开胸的手术效果。本研究回顾性分析比较我院2013年11月~2016年12月剑突下与双侧胸入路胸腺扩大切除治疗MG的疗效,探讨2种入路治疗MG的应用价值,报道如下。
1 临床资料与方法
1.1 一般资料
本研究65例,男30例,女35例。年龄11~73岁,(43.9±16.9)岁。病程15 d~20 年(中位数12个月)。剑突下入路组眼肌型14例,轻度全身型19例,中度全身型9例,急性进展型1例,晚期重症型1例;12例合并其他临床症状,包括胸闷4例,胸痛3例,干咳5例。双侧胸入路组眼肌型12例,轻度全身型6例,中度全身型2例,急性暴发型1例;6例合并其他临床症状,包括胸闷4例,胸痛2例。术前向患者讲明2种术式的优缺点,按患者意愿选择术式。2组患者一般资料比较差异无显著性(P>0.05),有可比性(表1)。
病例选择标准:①术前根据MG临床症状、肌疲劳试验、新斯的明试验,临床诊断MG;②胸部CT诊断胸腺增生,或没有明显外侵与转移的胸腺瘤;③术前综合评估患者手术耐受性,均无明显手术禁忌证。剔除标准:①术前接受放、化疗的胸腺瘤;②胸腺瘤切除术后复发者;③胸腺瘤瘤体直径>8 cm,侵蚀性胸腺瘤预计需要切除大血管并人工血管成形;④病例资料不完整。
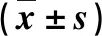
表1 2组一般资料比较
*数据偏态分布,用中位数(最小值~最大值)表示,采用Mann-WhitneyU检验
1.2 方法
1.2.1 术前准备 术前准备包括药物或血浆置换,全部患者均服用溴吡斯的明,必要时联合激素,控制肌无力症状,使患者达到部分缓解,获得围术期安全。成年人溴吡斯的明60~90 mg/q6~8 h;强的松,眼肌型5 mg/q8 h,危重型 30 mg/qd(顿服)。小儿半量。5例Osserman分期Ⅱb及Ⅲ型以上MG患者(剑突下入路组4例,双侧胸入路组1例)需血浆置换,分期降期后再行手术治疗。
1.2.2 手术方法
1.2.2.1 剑突下入路 单腔气管插管全身麻醉。取“人”字体位,两腿分开。主刀站立于患者两腿之间,助手站立于患者右侧。剑突下正中2 cm直切口,该切口作为胸腔镜镜孔,剑突可以切除或不切除。术者用卵圆钳游离胸骨后及剑突左、右侧软组织间隙,形成胸骨后“前纵隔隧道”。左、右肋弓下缘各做一0.5 cm切口,此切口作为操作孔,在手指引导下放置直径0.5 cm螺纹trocar。剑突下切口内放置直径2 cm trocar,置入胸腔镜,连接CO2气腹机,压力设定为10~12 mm Hg。右侧肋弓下缘trocar内放置抓钳,左侧放置超声刀。术者用超声刀切开左、右纵隔胸膜,清除右侧心包膈脂肪,旁开膈神经0.5 cm向上分离胸腺右叶。超声刀切断胸腺动脉、胸腺静脉, 分离胸腺上极。相同方法清除左侧心包膈脂肪,分离左叶胸腺,完整大块切除胸腺与纵隔脂肪。通过剑突下的切口将标本袋放至右侧胸腔,取出胸腺及脂肪组织,经肋弓下缘的切口放置左、右胸腔引流管(图1)。

图1 A.剑突下入路手术切口;B.术中显露胸腺左、右上极及无名静脉;C.术中显露右膈神经;D.术中显露左膈神经
1.2.2.2 双侧胸入路 双腔气管插管、单肺通气,全身麻醉。取平卧位,胸部垫高。先行左侧胸腔镜手术,左侧垫高30°。取腋中线第7肋间为观察孔;腋前线第4肋间为主操作孔;左、右锁骨中线第5肋间为副操作孔。进镜后观察胸膜腔是否有粘连,左侧肺萎陷,向右侧再摇床15°,完全暴露前上纵隔。从胸腺左下极开始分离,超声刀分离,沿左侧膈神经以内,再分离胸腺左上极,将上极向下牵拉暴露胸腺背侧,超声刀切断胸腺静脉,将胸腺左侧先完全游离,再清扫左侧肋膈角脂肪。第7肋间切口留置胸管。改右侧,再取平卧位,右侧垫高35°,右侧肺萎陷,向左侧再摇床15°,相同方法清除右侧胸腺及脂肪组织,完整大块切除胸腺及周边脂肪。扩大操作孔取出胸腺,第7肋间切口置入胸腔引流管。
1.2.3 术后处理 原则上术后继续服溴吡斯的明、强的松,药物用量减半,否则容易出现胆碱能危象。眼肌型患者服药量及服药时间与术前相同。危重患者依据术后临床症状,如唾液、痰液、自主呼吸状况,调整溴吡斯的明用量与时间,采用小剂量、多次给药(溴吡斯的明60 mg/q4~6 h),同时皮下注射阿托品0.5 mg/次,强的松30 mg/d(顿服);术后呼吸机辅助呼吸,部分患者再血浆置换。
1.3 观察指标
手术时间(从切皮开始到关闭各切口)、术中出血量[血纱布质量-干纱布质量(1 g≈1 ml)+吸引器瓶中液体总量-术中冲洗量]、术后延迟拔管(将气管插管呼吸机辅助时间> 24 h定义为延迟拔管)、术后并发症、中转开胸、术后住院时间、胸腔引流管引流时间(胸腔引流管拔除标准为引流量<50 ml/d)、引流量、术后疼痛评分[采用视觉模拟评分(Visual Analogue Scale, VAS)。0分:无疼痛;1~3分:有轻微的疼痛,尚能忍受;4~6分:疼痛影响睡眠;7~10分:疼痛逐渐强烈,难以忍耐,影响食欲与睡眠]。
1.4 随访
通过门诊定期复查和电话随访。术后半年内每个月随访1次,半年后每3个月随访1次,以后每年随访2次。术后第12个月进行疗效评价,采用美国重症肌无力基金会(Myasthenia Gravis Foundation of America, MGFA)对MG进行疗效评定[12]:①有效,包括完全稳定缓解(complete stable remission,CSR)、药物缓解、微小症状改变、改善;②无效,包括无变化、恶化、复发、死亡。除CSR外,其余结果全部为非完全缓解(non-complete stable remission,NCSR)。
1.5 统计学处理

2 结果
所有患者均完成全胸腺切除,1例(剑突下入路组)体型肥胖因胸腺与周围组织致密粘连,无名静脉被包绕,分离困难,出于手术安全和肿瘤治疗原则考虑,中转行胸骨上段“J”型切开完成手术。2组术后各有1例发生MG危象(2例术前均属于危重型,术前预计可能诱发MG危象,经床旁多次血浆置换,术后呼吸机辅助呼吸72 h,拔出气管插管后发生MG危象,给予气管切开并再次呼吸机治疗),无严重并发症及围术期死亡。2组患者术中出血量、中转开胸、术后延迟拔管、术后引流量、引流管留置时间、术后住院时间及术后并发症差异无统计学意义(P>0.05)。剑突下入路组手术时间明显短于双侧胸入路组 (P=0.017),术后3个时点疼痛VAS评分显著低于双侧胸入路组(P<0.05),见表2。
失访5例(剑突下入路组3例,双侧胸入路组2例),60例随访16~58个月,平均27个月,1例术后14个月因肝癌死亡(剑突下入路组)。术后2组疗效比较差异无显著性,见表3。
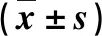
表2 2组患者术中、术后情况比较
*Fisher精确检验

表3 2组患者术后疗效比较
3 讨论
自1939年第1例胸腺切除治疗被报道以来[13],胸腺切除术治疗MG已成为一种公认有效的治疗方法[14,15],手术方式由正中开胸发展到现在的微创技术。目前,微创手术方式有单侧(左、右侧)、双侧胸腔镜,机器人辅助胸腔镜及剑突下入路胸腔镜等一些组合方式,并且多项研究证实微创技术是治疗MG的有效方法[16,17]。Zielinski等[18]报道56.9%的扩大胸腺切除术患者的颈部和纵隔脂肪中发现胸腺组织,这种病灶也可能位于膈神经和喉返神经以及颈部和纵隔的偏远区域附近,并强烈支持去除胸腺组织异位病灶的重要性,提出手术治疗MG术后复发的主要原因是未能彻底切除异位胸腺组织。因此,考虑到异位胸腺组织广泛分布于前纵隔,大多数胸外科医生建议在胸腺切除术中尽可能多地切除纵隔脂肪组织,以避免留下异位胸腺组织。
虽然,传统上“全胸腺切除术”被认为是手术的目标,但不清楚所有切除技术是否能实现这一目标[12]。胸腔镜胸腺切除近20余年的发展,迄今为止,尚无统一的标准术式。目前,以右胸入路手术最多,然而,很难暴露对侧和去除所有纵隔脂肪组织[10]。双侧胸入路提供足够的前纵隔暴露,清扫异位胸腺组织具有独特优势,同期进行双侧胸腔镜手术可以基本彻底切除所有胸腺及周围脂肪组织,达到传统意义的“全胸腺切除”[7,19],但需要更多的切口,可能增加手术创伤和术后疼痛[20]。我们将横向入路改为剑突下纵向入路,这种手术方式最早由Akamine等[2]1999年报道。Hsu等[21]2002年报道经剑突下胸腔镜扩大胸腺切除治疗MG,提出剑突下入路方式能够提供更好的双侧胸膜腔视野,安全有效地进行前纵隔脂肪清扫。Zielinsk等[11]报道剑突下入路对侵犯心包、肺叶的胸腺瘤可以有效切除,术后疼痛更轻,切口更加美观。Zhao等[22]报道剑突下入路胸腔镜对治疗选择性Ⅲ期胸腺瘤安全、可行。
2组完全缓解率和有效率均无明显统计学差异,证明剑突下入路在清扫异位胸腺组织可以达到较为理想的手术效果。剑突下入路组手术时间较双侧胸入路组更短,术后疼痛更轻,与国内外报道结果相似[23]。剑突下入路组1例体型肥胖,因胸腺与周围组织致密粘连,无名静脉被胸腺包绕,分离困难,出于手术安全和肿瘤治疗原则的考虑,中转行胸骨上段“J”型切开完成手术,提示对过度肥胖体型患者应慎重选择此手术入路。术后2组各有1例发生肌无力危象,2例术前均属于危重型,术前预计可能诱发肌无力危象,经床旁多次血浆置换,术后呼吸机辅助呼吸72 h,均在拔出气管插管后发生MG危象,给予气管切开并再次呼吸机治疗。2例均属于危重型,术后呼吸机的治疗时间过短可能是诱发MG危象的原因,目前尚不能证实2种手术方式能否降低肌无力危象发生率。
我们体会到剑突下入路术式的优势:①平卧位,单腔气管插管,操作简便。②结合人工气胸,能获得与正中开胸相类似的手术视野,操作空间开阔,可以完整切除胸腺及其周围脂肪组织;清晰显露双侧膈神经,避免损伤;充分显露和彻底切除胸腺上极;分离胸腺、显露无名静脉、超声刀处理胸腺静脉更加安全(图 1)。③不经过肋间,避免压榨和挫伤肋间神经,术后疼痛明显减轻,无胸壁感觉异常。④术后切口更加美观,对于年轻患者有更好的选择方式。因此,剑突下入路胸腔镜手术在胸腺切除中具有减少手术创伤的同时追求最大限度胸腺切除范围。当然,该术式也存在一些劣势:①对过度肥胖及巨大肿瘤(直径>8 cm)的患者应慎重选择此手术入路,因为即使使用正压CO2来扩展空间,前纵隔的空间也是有限的。②前纵隔手术空间相对较小,手术器械容易相互干扰,对助手要求较高,需要与主刀医师配合默契。③对于心功能较差的病人,避免使用该术式,因为清除左侧心包隔脂肪时心脏受压可能导致心率减慢,甚至心脏骤停[24]。④多数胸外科医师以往主要采用经侧胸入路方法行胸腺扩大切除术,突然改变手术径路确实需要一个适应和提高的过程。所以胸外科医生必须通过一定的学习、训练,以达到熟练掌握的程度,并且详细应对意外情况的处理预案,必要时果断扩大手术切口或开放手术。
综上所述,剑突下入路胸腔镜扩大胸腺切除治疗MG安全、有效,可以减轻术后疼痛,缩短手术时间,提供满意的美容效果,值得临床推广。本研究也存在一些局限性,首先,这是一个单中心回顾性研究,难以避免中心特点效应;其次,该项技术开展时间相对较短,病例数偏少,研究存在选择偏倚。

