骨肉瘤特异生物诊断探针制备
王华 梁骥 王法佳 周磊 马艳 张宇飞 傅桂莲
(1北华大学附属医院,吉林 吉林 132000;2广西桂林医学院;北华大学 3研究生院;4检验学院)
细胞表面具有丰富与复杂的细胞表位,表位源于细胞内染色体基因的表达。肿瘤细胞往往是某些基因发生了结构改变(丢失、插入、变异……),这些改变会赋予肿瘤膜蛋白质或其他物质的改变从而使细胞表位更复杂,这也导致了肿瘤细胞与正常细胞表位的差异。因此依据这种差异,人们试想过很多的办法,例如利用抗原抗体的方式进行诊断或者治疗。由于抗体制备与生产的某些严苛的限定因素,始终没有更好地实现这一想法。而小寡核苷酸DNA或者RNA具有更多的特点:可以自发卷曲成三维空间结构,可以进行体外化学修饰(连接生物素、氨基、羧基、荧光物质……),而不改变与配体的结合能力,小寡核苷酸的制备、储存、运输及应用比抗体特别是单克隆抗体显示更多的优势〔1~4〕。蛋白质-核酸可以互相作为配基的理论基础已被引入细胞膜表面配基的研究。指数富集配体的系统进化(SELEX)技术〔5~7〕的出现为肿瘤标志物的筛选及特异诊断探针研制带来了新的契机。SELEX技术的基本原理是利用分子生物学技术人工合成单链随机寡核苷酸文库(SSDNAs),DNAs或者RNAs,由于单链寡核苷酸片段能够形成三维空间结构〔8~10〕,理论上可以同各种靶分子结合。一个高通量(1 015~1 018)的寡核苷酸库包容了所有可能的立体结构,因此有可能从中筛到任何种类的靶分子高亲和力配基。利用这一原理,将SSDNAs与靶细胞相互作用〔11~14〕,保留与靶标结合的寡核苷酸配基,并以此为模板利用聚合酶链反应(PCR)体外扩增筛选获得的配基。经过几轮或数十轮反复结合、扩增、筛选过程,最终使高亲和力的寡核苷酸配基即Aptamer得到富集。目前国内外尚无对骨肉瘤生物探针的研制文献报告。本研究以人骨肉瘤细胞(U-2 OS)为靶细胞,体外合成随机序列的DNAs作为被选文库,应用细胞-SELEX技术去筛选与U-2 OS高度特异性结合的细胞适配体单链DNA(ssDNAs),为骨肉瘤特异诊断建立适配体库。
1 材料与方法
1.1实验材料 建构76 nt的ssDNA文库:5′-ATC CAG AGT GAC GCA GCA 40(N) TGG ACA CGG TGG CTT AGT-3′及5′-异硫氰酸荧光素(FITC)-ATC CAG AGT GAC GCA GCA 40(N) TGG ACA CGG TGG CTT AGT-BIO-3′,两端为固定序列引物,中间40个碱基为随机序列,以上均由上海生工生物工程股份有限公司合成。人骨肉瘤U2-OS细胞(阳性细胞株),购于武汉博士德生物工程有限公司。SGC7901胃癌细胞由上海徐汇区中心医院馈赠。
1.2主要试剂 酵母tRNA(Fluka Analytical,cat.no 83853,USA)。胎牛血清(FBS,Invitrogen,USA)。链霉亲和素琼脂糖(GE Healthcare Life Scicence USA)。RPMI1640培养基、 McCoys′5A 培养基、青霉素、硫酸链霉素(武汉博士德生物工程公司)。胰蛋白酶(北京鼎国生物技术公司,中国)。 UNIQ-10柱寡聚核苷酸纯化试剂盒(上海生工生物工程公司,中国)。 2×Taq PCR Master Mix(KT201-01)、载体pGEM-T、DH5α感受态细胞、琼脂糖凝胶DNA回收试剂盒(北京天根生化科技公司,中国)。
1.3主要仪器 凝胶成像分析系统(USA)。 荧光分光光度计(美国安捷伦)。WD-9403C型紫外分析仪(北京市六一仪器厂,中国)。756PG型紫外可见分光光度计(上海光谱仪器公司,中国)。SIGMA低温高速离心机(美国SIGMA公司)。TGL-18G 台式高速冷冻离心机(太仓市医疗器械厂,中国)。TDZ5-WS低速多管架自动平衡离心机(长沙湘仪离心机仪器公司中国)。CO2培养箱(美国),IX50-S8F2倒置式生物显微镜(OLYMPUS日本),JY600C电泳仪(北京君意东方电泳设备公司,中国)。Eppendorf Hamburg22331型 PCR仪(德国)。JY-96G PCR仪(北京君意东方电泳设备公司,中国)。LNG-L98 真空浓缩干胶系统(太仓市科教器材厂,中国)。亲和层析空柱管(长春宝泰克公司,中国)。
1.4细胞培养PCR扩增及筛选 ①应用McCoys′5A培养液对人骨肉瘤U-2 OS细胞培养传代。试验前24 h在10 mm×10 mm培养皿中培养细胞达5×106。②DNA寡核苷酸文库用结合缓冲液制备成工作液500 μl放入EP管中,超级旋转恒温水浴中加热95℃ 5 min后置于冰上备用。③24 h前准备的目标细胞洗涤后将冰上预冷的DNA寡核苷酸文库加入细胞培养盘中摇匀(第一轮终浓度10 nmol/L,第二轮开始增加至100 nmol/L)、37℃振荡40 min、洗涤后用细胞铲收获细胞、95℃加热、离心,收集上清,-20℃保存或者进入下一步试验。④PCR扩增上清液中的ssDNA,制备高纯度双链DNA(dsDNA)。在这一过程中,首先对PCR扩增条件进行优化,选择最佳循环次数与模板浓度。对于大量制备的dsDNA再应用酚-氯仿进行纯化。⑤应用链霉亲和素琼脂糖碱变性亲和层析将dsDNA分离成单链,收获正链DNAs作为下轮筛选的文库。⑥荧光监测特异寡核苷酸筛选过程。在第6、9、11、12和13轮筛选时进行荧光监测富集筛选的寡核苷酸。监测前24 h,3×106U-2 OS细胞(60 mm×15 mm培养皿)用10% FBS的McCoy′5A培养液培养。应用漂洗缓冲液漂洗细胞后,加入预冷的溶解在600 μl结合缓冲液中的ssDNA (1 000 nmol/L终浓度),37℃,50 r/min 振摇40 min 。漂洗细胞后,应用300 μl结合缓冲液浸润细胞、用细胞铲收获细胞并将其转移到1.5 ml离心管内。加热离心管95℃ 10 min,4℃ 12 000 r/min离心5 min,收获上清液。其中部分上清液用于制备下一轮筛选的ssDNA文库,部分上清液应用FITC-标记的上游引物和生物素(Biotin)-标记的下游引物进行PCR扩增。扩增产物经过链霉亲和素琼脂糖碱变性亲和层析分离获得FITC-正链DNA并进行荧光测定。当对照与阳性样品荧光信号显示明显差异,而阳性样品荧光信号之间无明显漂移时终止筛选过程。⑦对最后一轮筛选的寡核苷酸文库进行克隆测序。pGM-T作为克隆载体,依据试剂盒克隆程序将最后筛选的寡核苷酸文库进行克隆,选择阳性克隆质粒再进行插入序列扩增,选择76 bp插入序列的克隆质粒进行测序并保存,同时依据克隆序列的一级结构进行同源序列分组。
2 结 果
2.1PCR优化 6、8或10个循环及10%、15%或者20%模板浓度为获得无非特异扩增产物条带比较理想的参数。酚-氯仿法纯化dsDNA显示了较高纯度。15%模板浓度,10个循环结果最佳,见图1及图2。11~13轮荧光曲线接近重叠提示筛选富集的寡核苷酸趋于稳定,因此结束筛选。见图3。
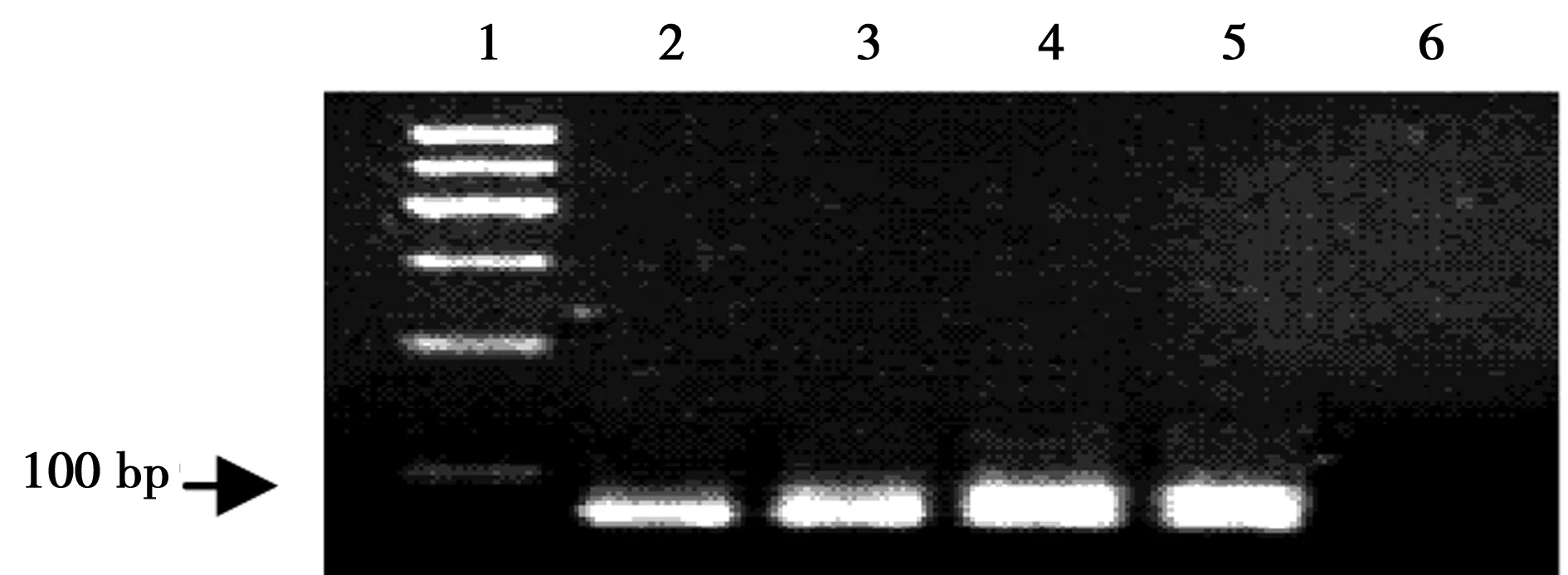
1:100 bp标准;2~5:6,8,10和12个循环;6:空白图1 应用15%模板浓度进行PCR最佳循环次数的筛选
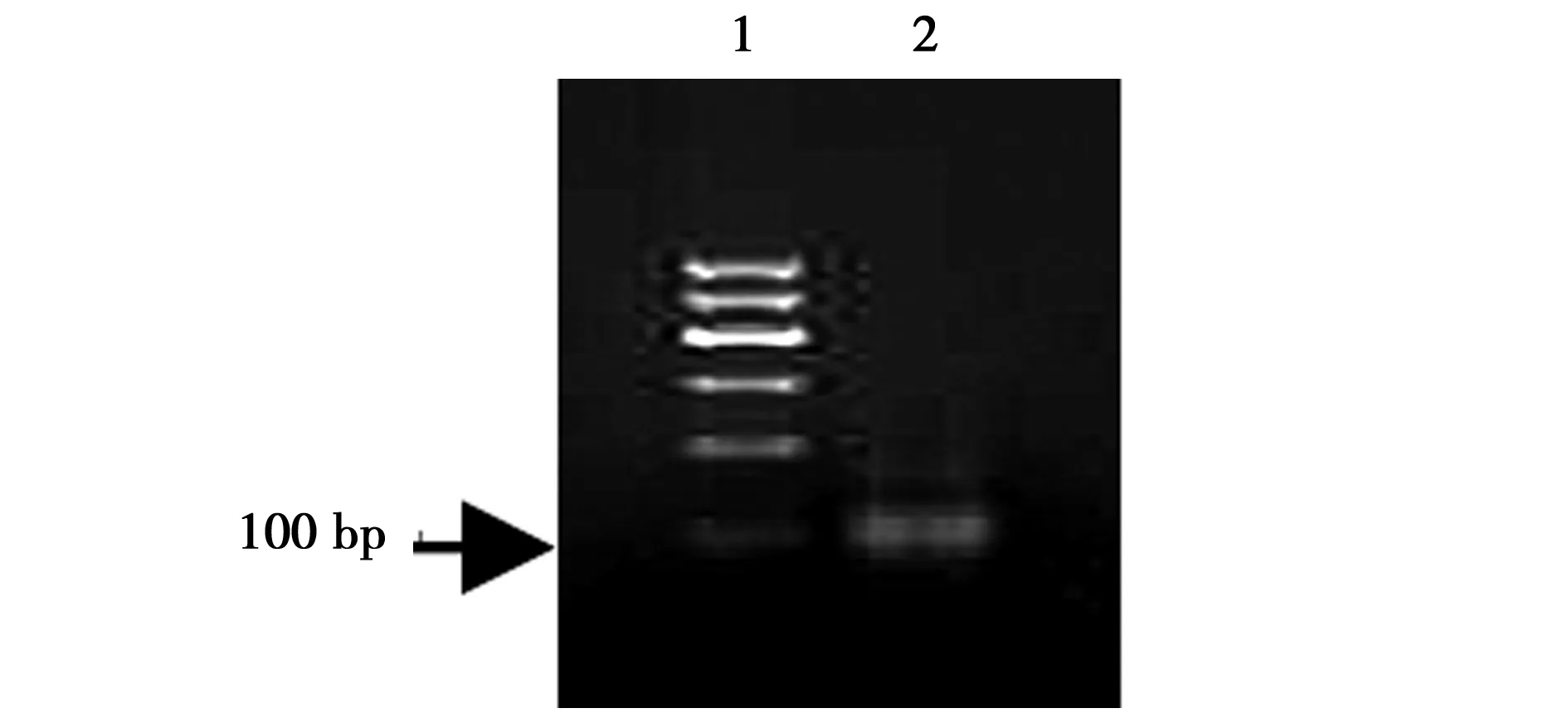
1:100 bp标准;2:纯化后的dsDNA琼脂糖凝胶电泳图2 应用酚-氯仿纯化dsDNA的结果
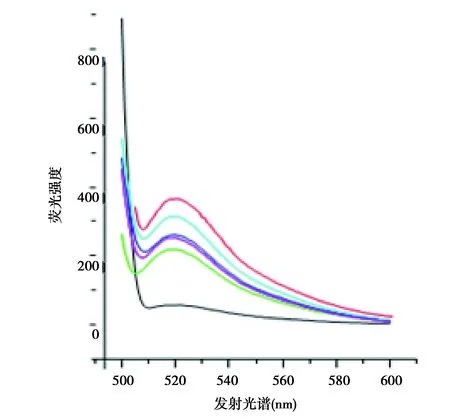
黑色光谱曲线:胃癌细胞的阴性对照;红色:第3轮筛选;蓝色:第6轮筛选;绿色:第9轮筛选;粉色:第11轮筛选;紫色:第13轮筛选图3 荧光光谱用于检测寡核苷酸ssDNA与骨肉瘤细胞结合的筛选过程
2.2克隆与测序 对最后一轮筛选的寡核苷酸文库进行克隆。对克隆质粒再进行扩增,保留正确插入序列的质粒进行测序,质粒1~8含有76 bp寡核苷酸序列可以用于测序,见图4。
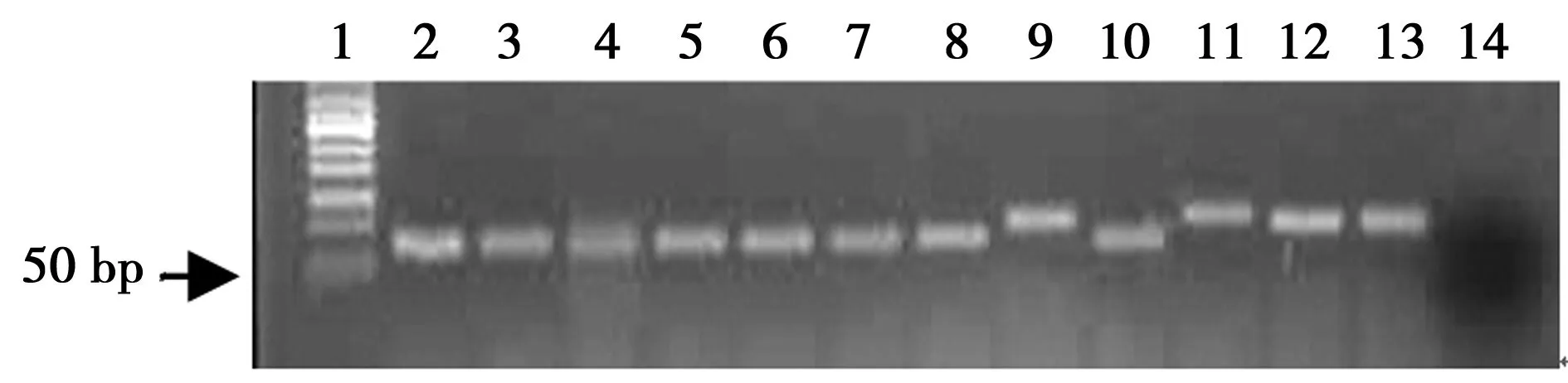
1:50bp DNA标准;2~13:克隆质粒PCR扩增结果;14:空白对照图4 质粒插入序列检测
2.3一级结构分析并建立同源保守序列库 例如包括含有GGTGGGGG,GGCGTTATTTG,TT(T/G)TTGG同源序列的适配体SEQ ID NO 9,11,13,67和68;包括含有AAC (A/G)CCCC,CTT(G/C)TT,CCCTGC同源序列的适配体SEQ ID NO14,21,33和37等。
3 讨 论
骨肉瘤是临床常见的青少年及老年人群的恶性肿瘤,男性发病率高;某些病例存在家族倾向。现在发现至少有一个基因与其相关,而且这个基因也与家族性视网膜母细胞瘤相关,但是导致疾病的发生原因至今不清楚。由于肺部的转移导致该病高死亡率。临床确诊主要综合病理学、血清学及影像学检查结果,因此建立一种准确、简便、无创伤的诊断方法具有重要的临床意义。SELEX技术主要应用高丰度空间结构的DNA或者RNA作为备选文库,与靶物质通过反复结合、解离和PCR扩增富集,最终获得与靶物质高度亲和的寡核苷酸(DNA或者RNA)。靶物质可以是金属离子、有机染料、氨基酸、抗体、肽、蛋白质、核酸,甚至整个细胞、病毒及细菌等。细胞是一种多表位的靶物质,蛋白质是细胞膜表面复杂表位的主要成分。分化与未分化、癌细胞与正常细胞膜的表位差异为应用整个细胞作为靶标进行特异寡核苷酸的筛选提供了结构基础。
特异探针筛选过程中,ssDNA文库与靶细胞的浓度比对于SELEX 筛选至关重要。在前几轮筛选过程中,二者的投入量多确保U-2 OS细胞有效捕捉核苷酸适配体。后几轮的筛选,由于特异适配体已经富集,因此减少了细胞的数量,由5×106减少到3×105。第6轮开始减少结合的反应时间,由40 min减少到25 min进一步减少非特异结合。
在SELEX技术中,PCR是重要的实验步骤。因为每一轮从细胞-ssDNA复合物中分离开来的ssDNA都要制备成dsDNAs。为了获得没有非特异条带的PCR产物-dsDNAs,每一轮的PCR都进行了循环次数及模板浓度的摸索。本文应用经典氯仿-酚法对扩增制备的dsDNAs进一步纯化去除引物,taq酶等,有效获得了大量纯化的dsDNAs。
在制备大量dsDNAs时,将Biotin标记的反向引物引入PCR扩增,因为生物素与链霉亲和素具有极强的亲和力,因此当dsDNAs流经链霉亲和素琼脂糖层析介质时,Biotin标记的负链寡核苷酸DNA被牢固吸附,而正链DNAs被洗脱和收获作为下轮筛选的文库。这是一种优越于其他方式制备次级文库的方法。应用荧光分光光度计监测筛选进程是因为其对比流式细胞仪的使用更简便易行。
将第13轮筛选的寡核苷酸适配体经过PCR扩增、纯化后,应用常规分子克隆技术将适配体连接到pGM-T质粒上,转化到DH5a中。再经历阳性转化菌落的培养、提取质粒、PCR扩增,选择理想的克隆质粒进行测序、同源序列编组并保存。
核酸适配体与靶物质结合所呈现的高识别性和结合性及所具有的易合成、储存、化学修饰及可以反复变性与复性等优点远远超过抗体制备与应用范畴。因此,核酸适配体已经在疾病的诊断、治疗与药物的开发等领域颇受关注。本研究以人骨肉瘤U-2 OS细胞为靶细胞,应用细胞-SELEX技术成功获得了用于骨肉瘤诊断的特异性核酸适配体库,这也为骨肉瘤未来的导向治疗搭建了可行性平台。
——一道江苏高考题的奥秘解读和拓展

