胍基乙酸对锦江黄牛瘤胃体外发酵参数的影响
辛均平, 李美发, 王江北, 丁鹏举, 王世辉, 柏 峻, 赵二龙, 瞿明仁, 许兰娇
(江西农业大学江西省动物营养重点实验室/饲料工程研究中心,江西南昌330045)
目前胍基乙酸作为一种优质的饲料添加剂和食品补充剂被广泛应用于动物生产和人类保健。胍基乙酸能够在酶的作用下内源性的合成肌酸。肌酸是一种含氮氨基酸, 被认为是一种能量缓冲剂,主要作用是在肌酸激酶(CK)的作用下形成磷酸化肌酸(PCr),参与三磷酸腺苷(ATP)循环。 当ATP 供能不足的瞬间, 磷酸肌酸通过肌酸激酶以非常快的速度将磷酸基团转移到二磷酸腺苷中(ADP)重新转化为三磷酸腺苷(R P B 等,2016)。额外添加胍基乙酸, 使机体内产生大量的磷酸基团转移物质(磷酸肌酸),从而为肌肉、大脑、性腺等组织等高效工作提供动力, 促进能量源源不断地向肌肉组织中分配(Wyss 等,2000)。 胍基乙酸在猪和禽类中的研究报道较多(张俊玲等,2016;王亚琼等,2016;祁永旺等,2011),均有显著提高生长性能,改善肉质等效果,但在反刍动物中的研究鲜见报道。 本试验旨在探究胍基乙酸对反刍动物瘤胃发酵功能的影响, 并为以后研究和生产应用提供依据和参考。
1 材料与方法
1.1 试验材料
1.1.1 胍基乙酸 胍基乙酸由北京君德同创农牧科技股份有限公司提供,纯度≥99%。
1.1.2 发酵底物 发酵底物由稻草、麦麸、豆粕等组成,将饲料原料充分研磨过1 mm 筛,底物按照精粗2:8 进行混匀配置。 发酵底物干物质按照烘箱干燥法进行测定。
1.1.3 体外瘤胃发酵技术与瘤胃缓冲液 体外瘤胃发酵技术参照Menke 等(1979)方法进行。 瘤胃缓冲液的配制: 组分见表1。 按顺序依次添加400 mL 水、0.1 mL A 液、200 mL B 液、200 mL C液、1 mL D 液、40 mL E 液, 混合均匀后通入CO2直至溶液为无色透明,调整溶液pH 为6.80,使用前39 ℃预热。

表1 人工唾液组成成分
1.1.4 瘤胃液采集 试验选取3 只健康、2 岁左右、体重为(200 ~250)kg、安装瘤胃瘘管的锦江黄牛。在试验前一周饲喂相同日粮,日粮组成及营养水平见表2。 于晨饲前2 h 通过瘘管进行瘤胃液的采集,每头采集0.5 L 瘤胃液,装入保暖瓶中混合均匀,迅速返回实验室用四层纱布过滤。

表2 日粮组成及营养水平
1.1.5 体外发酵液的配置 将人工唾液和瘤胃液采取2∶1 的比例充分混合,持续通入CO2,整个过程在39 ℃水浴锅中进行。
1.2 试验设计 准确称量500 mg 发酵底物于150 mL 发酵瓶中, 各组分别加入0%、0.1%、0.2%、0.3%、0.4%的胍基乙酸,每组5 个重复。 迅速往发酵瓶中加入60 mL 体外发酵液并通入CO2,将其置于恒温(39 ℃)摇床发酵24 h。
1.3 指标测定 发酵24 h 后将发酵瓶置于冰水浴中,终止发酵,使用便携式pH 计立即测定pH。将发酵液用四层纱布过滤, 分装离心管用于测定氨态氮(NH3-N)、挥发性脂肪酸(VFA)、微生物蛋白(MCP)。 纱布中的残渣进行回收用于测定干物质消化率。
1.3.1 氨态氮(NH3-N) 的测定 参考冯宗慈等(1993)利用比色法测定氨态氮(NH3-N)。
1.3.2 挥发性脂肪酸(VFA)的测定 以2-乙基丁酸为内标采用气相色谱法测定, 取2 mL 瘤胃发酵液5000 g 离心10 min, 取上清液1 mL 置于2 mL 离心管中,加入0.2 mL 25%偏磷酸溶液,混匀置于4 ℃冰箱过夜。 第2 天取出后10000 g 离心10 min,取上清液置于测样瓶中,采用安捷伦7890B 型号气相色谱仪测定发酵液中总挥发性脂肪酸( TVFA) 和各种挥发性脂肪酸含量。 测定条件:检测室温度220 ℃,柱温180 ℃,气化室温度200 ℃,高纯氮气作为载气,压力90 kPa,总流量为37.2 mL/min,空气流量400 mL/min,氢气流量40 mL/min,吹扫流量3 mL /min,分流比50∶1,线速度为23.4 cm/s。
1.3.3 干物质消化率的测定
干物质消化率/%=(1- M2/M1)×100。
式中:样品重量为M1,g;体外消化后残渣重量为M2,g。
1.3.4 微生物蛋白(MCP)的测定 MCP 采用考马斯亮蓝法(Zinn 等,1986),应用752 紫外可见分光光度计测定。
1.4 数据统计与分析 试验数据经Excel 2003初步整理后, 利用SPSS 17.0 软件进行单因素方差分析( one-wayANOVA),当差异显著时,采用Duncan 氏法进行多重比较,结果以“平均值±标准误”表示,P ≤0.05 为差异显著。 回归分析采取多元回归分析。
2 结果
2.1 胍基乙酸添加量对发酵液pH、NH3-N、MCP、干物质消化率的影响 由表3 可知,随着胍基乙酸添加量的增加, 产气量显著提高 (P <0.05),其中0.4%添加组提高了40.82%。胍基乙酸添加组pH 显著低于空白对照组(P <0.05),其中0.2%添加组显著低于其他组(P <0.05)。 氨态氮(NH3-N) 浓度随着添加剂量的增加先降低后升高, 其中添加0.1%、0.2%两组显著低于空白对照组(P <0.05)。瘤胃微生物蛋白含量随着胍基乙酸添加量的增加而增加,其中0.4%添加组显著提高了1.41%(P <0.05)。 干物质消化率(IVDMD)随着胍基乙酸添加量的增加具有增加的趋势, 其中0.4%添加组显著提高了11.24%(P <0.05)。
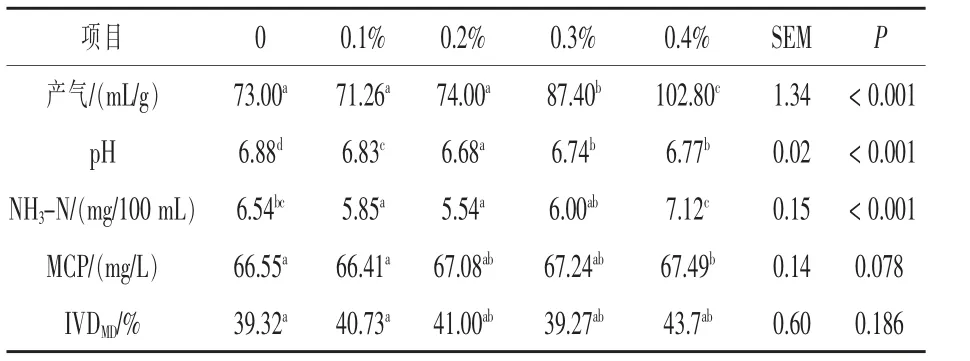
表3 胍基乙酸添加量对发酵液pH、氨态氮、MCP、干物质消化率的影响
2.2 胍基乙酸添加量对发酵液挥发性脂肪酸浓度的影响 由表4 可知, 胍基乙酸添加组的挥发性脂肪酸总量呈上升趋势,0.4%添加组显著高于空白对照组(P <0.05),提高了6.58%。 乙酸、丙酸、丁酸含量均是胍基乙酸添加组有上升趋势,并且0.4%添加组显著高于空白对照组 (P <0.05),其中丙酸提高了9.08%。 乙酸/丙酸各组无显著差异(P >0.05),但0.4%添加组的乙酸/丙酸最低,比空白对照组降低了4.34%。
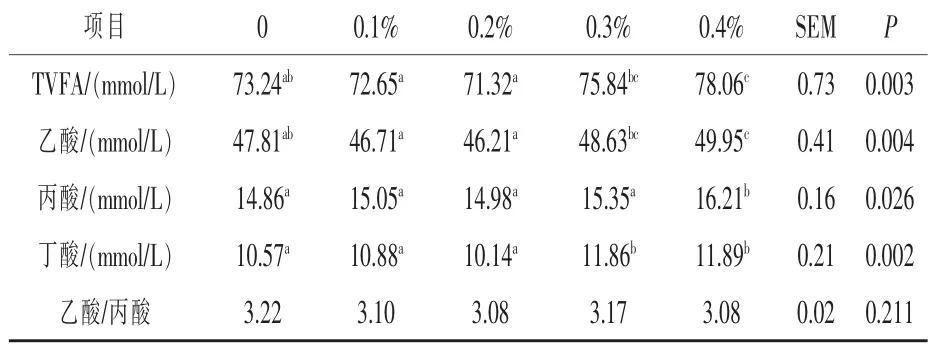
表4 胍基乙酸添加量对发酵液挥发性脂肪酸的影响
3 讨论
3.1 胍基乙酸添加量对发酵液pH、产气量和干物质消化率的影响 瘤胃pH 是衡量整个发酵过程是否处于正常环境的指标,瘤胃正常pH 为5.5~7.5 (Calsamiglia 等,2002), 本试验各组发酵液pH 均在正常范围内,且胍基乙酸组显著低于空白对照组。 体外发酵产气的气体主要包括CO2、H2、CH4。 气体是由饲料通过微生物发酵后产生的,Menke 等(1979)通过试验证实,饲料样品在体外发酵24 h 后的产气量与瘤胃内有机物的消化率呈显著的正相关。 本试验产气量随添加量的增加有上升的趋势,与干物质降解率的趋势相吻合。其中0.4%添加量的产气量和干物质降解率均为最高。说明胍基乙酸的添加能够促进瘤胃体外发酵。3.2 胍基乙酸添加对发酵液NH3-N、微生物蛋白(MCP)的影响 NH3-N 是瘤胃中的非蛋白氮化合物分解的终产物,也是瘤胃微生物合成MCP的主要原料。 瘤胃内最佳NH3-N 含量为0.35 ~29.00 mg/dL(Owens 等,1983)。 本试验结果表明,NH3-N 浓度为5.54 ~7.12 mg/100 mL, 均处于正常范围内。 微生物蛋白质(MCP)是反刍家畜小肠可消化蛋白质的一个重要组成部分, 也是评定饲料可发酵养分利用效率的重要指标,MCP 合成效率的高低主要取决于瘤胃中碳源和氮源比例是否适宜,本试验结果表明,胍基乙酸组MCP 浓度随添加量的增加呈显著上升趋势,其中MCP 浓度最高组所对应的NH3-N 浓度也为最高值,说明添加胍基乙酸能够提高MCP 的合成,促进非蛋白氮的分解。
3.3 胍基乙酸添加对发酵液挥发性脂肪酸的影响 TVFA 是反刍动物的主要能量来源, 其具备贮存能量和维持瘤胃正常环境等功能。 丙酸是反刍动物体内糖异生的主要前体物质, 且丙酸发酵时可以利用氢气,使甲烷产量减少,能量转化效率提高(Guilloteau 等,1986)。 乙酸/丙酸值可反映瘤胃发酵类型,其值越小,丙酸比例越高,饲料能量利用率也相应越高。 本试验结果表明, 胍基乙酸添加组丙酸含量有上升的趋势且乙酸/丙酸有下降的趋势, 其中0.4%添加组的丙酸含量最高、乙酸/丙酸值最低,说明胍基乙酸的添加显著改善了瘤胃发酵类型。
4 结论
胍基乙酸添加可以改善瘤胃内环境, 促进底物的降解,提高NH3-N 和MCP 浓度,影响瘤胃发酵模式,并且与胍基乙酸添加量的增加呈正相关。

