8例系统性红斑狼疮并发胸导管出口梗阻临床特征
张令令,张国华,高兰,罗俊丽,安然,沈文彬,王玉华
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种系统性自身免疫性疾病,以产生针对细胞核成分的自身抗体和多器官受累而出现多种临床表现为特征,该病的基本病理改变是血管炎。淋巴管系统是与血管系统并行的体内运输系统,且二者在起源及组织结构上具有部分的同源性,SLE的这种自身免疫炎症是否会累及淋巴管,目前尚无相关文献报道。因此,本研究回顾性分析过去10年中,首都医科大学附属北京世纪坛医院住院患者中8例SLE并发胸导管出口梗阻患者的临床特征及治疗经验。
1 对象与方法
1.1 研究对象
2010年1月至2020年1月,首都医科大学附属北京世纪坛医院住院患者中SLE并发胸导管出口梗阻的患者。SLE诊断符合2012年国际狼疮研究临床协助组或2019年欧洲抗风湿病联盟/美国风湿病协会的SLE分类标准。经直接淋巴管造影或胸导管核磁成像证实存在胸导管出口梗阻(图1)。

图 1 直接淋巴管造影典型图Fig 1 Typical figure for direct lymphangiography颈段胸导管末端结构明显紊乱,存在胸导管出口梗阻;虚线圈:胸导管出口梗阻
1.2 临床及实验室数据收集
通过回顾性收集上述患者的一般资料,包括SLE病程、胸导管出口梗阻症状(反复胸腹腔积液)病程、临床表现、系统性红斑狼疮疾病活动评分(systemic lupus erythematosus disease activity score, SLEDAI),影像学资料,治疗及转归等资料。同时,详细记录入选病例的实验室检查指标,包括血常规、红细胞沉降率(erythrocyte sedimentation rate,ESR)和C反应蛋白(C-reactive protein,CRP)水平,胸腹水常规、生化、乳糜试验、补体(C3、C4)水平,抗核抗体(anti-nuclear antibody,ANA)、抗双链DNA抗体(anti-dsDNA antibody)、抗ENA抗体谱(包括抗SSA、抗SSB、抗Sm、抗RNP、抗Ro52及抗rRNP抗体等)及药物治疗方案等。其中,SLEDAI评分、实验室检查和临床特征的评估均在患者入院后一周内完成并详细记录。乳糜性胸腹腔积液定义为:胸腹腔积液乳糜试验阳性,或甘油三酯水平>1.24 mmol/L,或者直接淋巴管造影或淋巴管核素显像证实造影剂进入胸腹腔[1]。
2 结果
2.1 入选病例基本情况
根据研究目的及纳入标准,从2010年1月至2019年1月,本院住院患者中共有8例SLE并发胸导管出口梗阻患者,均为女性,平均住院年龄为(38.8±10.7)岁。SLE发病年龄23~55岁,平均(36.0±10.4)岁;SLE中位病程为19(1, 96)个月。出现胸导管出口梗阻的年龄为24~58岁,平均(37±11)岁,有胸导管出口梗阻症状如胸腹水病程为5~56个月,平均(18.6±16.2)个月(表1)。
2.2 SLE并发胸导管出口梗阻的临床特点
8例并发胸导管出口梗阻的SLE患者中,3例(3/8)患者先诊断SLE,经免疫抑制剂和糖皮质激素治疗后仍出现胸腹腔积液,后经直接淋巴管造影证实存在胸导管出口梗阻,如病例2,SLE诊断约4年后出现乳糜胸。5例(5/8)患者以反复大量胸腹腔积液为SLE首发表现,如病例4,患者反复乳糜腹、低蛋白血症4年余,当地医院曾诊断结缔组织病,激素服用1月后停药,后本院查ANA均质斑点型1∶1 000,rRnp、nRnp/Sm、SSA、SSB、Ro52均为阳性,补体C4下降,有口干、眼干、关节炎、口腔溃疡等症状,诊断为SLE。
SLE临床表现:6例患者表现为大量胸腔积液导致的胸闷、憋气;2例表现为腹腔积液导致的腹胀;3例脱发、关节炎、口腔溃疡;3例有白细胞减少(<3.5×109/L);3例补体C3/4水平降低;8例患者ANA均阳性。ENA谱中8例SSA/Ro52均为阳性,其中3例rRnp阳性,3例nRnp/Sm阳性。8例患者尿蛋白均阴性,SLEDAI评分2~8分,平均(4.9±2.1)分(表1)。
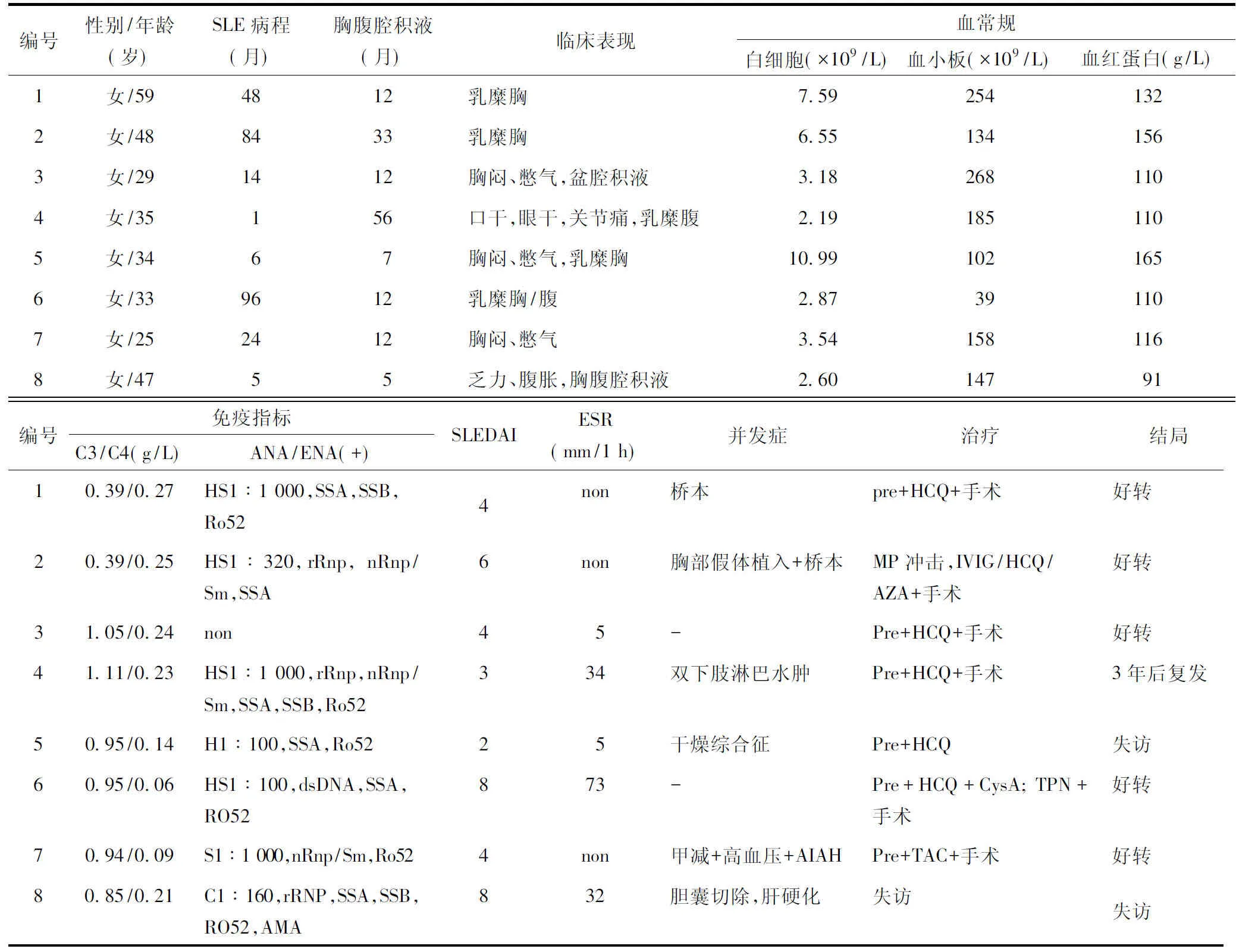
表1 8例系统性红斑狼疮并发胸导管出口梗阻患者的临床特点及治疗结局Table 1 Characteristics, treatment, and outcome in 8 patients of SLE complicated with thoracic duct outlet obstruction
胸导管出口梗阻:4例患者为乳糜性胸腹腔积液。8例患者均行直接淋巴管造影,其中2例为右位胸导管,2例有胸导管变异即胸导管颈段分为两支,由不同位置汇入静脉。其中7例行胸导管超声检查,4例提示胸导管管壁增厚(表2)。

表2 8例系统性红斑狼疮并发胸导管出口梗阻患者的实验室及影像学检查特征Table 2 Laboratory data and imaging examination in 8 patients of SLE complicated with thoracic duct outlet obstruction
2.3 治疗及预后
除1例自动出院外,其余7例患者均接受糖皮质激素联合免疫抑制剂(环磷酰胺、硫唑嘌呤、环孢素A、他克莫司等)及羟氯喹的治疗,其中5例(病例1、2、3、5、7)有反复大量胸腔积液,考虑狼疮病情活动,给予大剂量激素冲击后胸腔积液较治疗前稍有好转,但仍间断胸闷憋气。6例在抗风湿治疗的同时行胸导管出口松解术,术后胸腹腔积液明显减少,随访2年效果良好。1例(病例4)体检发现胸腔积液,胸导管核磁提示右位胸导管(图2),经直接淋巴管造影证实为胸导管发育异常并出口梗阻,胸导管出口松解术后乳糜性胸腔积液明显好转,随访3年后该患者出现双下肢淋巴水肿。病例5尽管也存在胸导管发育异常即右位胸导管,但患者入院1年前曾患干燥综合征,应用泼尼松3个月后自行停药出现胸腔积液,后因感染较重未行胸导管出口松解术,该患者失访。
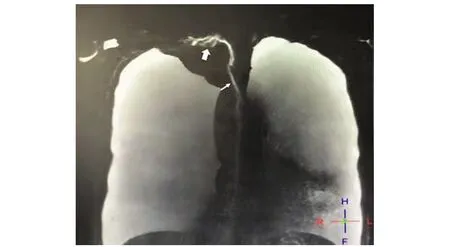
图 2 胸导管核磁重建图Fig 2 Reconstruction imaging for thoracic duct magnetic resonance imaging(MRI) 病例4右位胸导管,胸导管显示欠佳,仅见颈段及部分上段显示,胸导管向右侧静脉角区引流,出口引流不畅;左侧锁骨下干、左颈干未见显影;白色粗箭头:胸导管出口处;白色细箭头:胸导管中上段(胸段)
3 讨论
SLE临床表现多样,病程迁延反复,常有皮肤、肾脏、血液系统等多系统受累表现,而导致这种表现的基本病理基础是血管炎。淋巴管系统是免疫系统重要的组成部分,它是与血管系统并行的体内运输系统,在淋巴液回流、淋巴细胞输送等方面发挥重要作用[2]。有血管的地方就有淋巴管伴行,淋巴管和血管管壁构成类似,均由内皮细胞、平滑肌细胞及结缔组织组成。作为免疫系统重要组成的淋巴管系统是否参与SLE的致病过程,目前尚无相关文献报道。本文通过对8例系统性红斑狼疮并发胸导管出口梗阻患者进行临床特征分析,对SLE并发淋巴管系统病变的可能致病机制进行初步探讨。
胸导管是淋巴管系统进入静脉的终末结构,收集全身约75%的淋巴液,经胸导管引流入血的淋巴液约100 mL/h,胸导管出口梗阻是导致淋巴回流障碍性疾病的重要病因,常见原因有先天性发育畸形,淋巴液产生过多,回流压力增高,外伤和手术等,临床表现为乳糜性胸腹腔积液或者淋巴水肿[3]。本研究7例行胸导管超声检查的患者中有4例(4/7)提示胸导管管壁增厚、管腔狭窄,推测胸导管管壁增厚可能是慢性炎症性改变所致;除淋巴管管壁和管腔改变外,淋巴管与周围组织也可能存在炎症状态,如病例3,胸导管出口松解术中可看到胸导管与周围形成大量致密纤维组织粘连,导致乳糜液回流入血受阻;尽管本研究中8例患者入院时炎症指标不高,SLEDAI评分2~8分,提示SLE疾病轻中度活动,内科保守治疗远期效果欠佳需要手术干预,但其中5例(5/8)患者病程中反复大量胸腔积液,曾给予大剂量激素冲击或者较强的免疫抑制剂治疗后胸腔积液较治疗前一度好转,提示抗炎抗免疫治疗对SLE并发淋巴回流障碍是有效的,只是慢性反复炎症反应会导致胸导管不可逆的损伤如胸导管管壁增厚,管腔狭窄。据报道,SLE并发乳糜性胸腹腔积液与SLE病情相关[1],进一步提示SLE可能累及淋巴管道。根据患者对药物常规治疗的反应,初步推测炎症反应可能是SLE并发淋巴管病变的主要原因。
胸导管发育异常是胸导管出口梗阻的重要原因之一。本研究中有2例患者通过直接淋巴管造影证实胸导管发育异常即右位胸导管。其中病例4,体检发现胸腔积液,后诊断为乳糜胸,曾考虑结缔组织病给予泼尼松50 mg治疗,但效果欠佳,经直接淋巴管造影证实为胸导管发育异常并出口梗阻,胸导管出口松解术后乳糜性胸腔积液明显好转,但3年后该患者又出现乳糜腹及双下肢淋巴水肿。针对这种现象推测患者胸导管先天性发育异常,日常情况下通过代偿机制维持淋巴管的正常生理功能,但系统性炎症反应导致这种平衡被打破,出现相应的临床症状。炎症的反复刺激进一步破坏原有的组织结构,因此即使给予了较强的抗炎抗免疫药物治疗,病情也得不到缓解。此结论只是源于本次个案分析,SLE并发胸导管出口梗阻与淋巴管发育异常孰因孰果,需要更多的临床数据分析。
SLE并发淋巴管受累的发病机制尚无文献报道,近年来有关于结缔组织病与淋巴回流的研究进展。在类风湿关节炎中,急性炎症期淋巴管增生和淋巴结体积变大,有利于淋巴液回流和炎症物质的输送;在慢性炎症迁延期,成熟的淋巴管数量明显减少,淋巴回流功能下降甚至缺失,从而导致关节周围组织淋巴回流障碍,进一步加剧炎症反应,如此形成恶性循环,这可能是导致关节肿胀畸形的主要原因之一[4-6]。研究者发现急性关节炎患者关节滑液中VEGF-C表达升高,促进淋巴管新生,用VEGFR-3中和性抗体特异性抑制淋巴管生成,减少淋巴回流,会加重肿瘤坏死因子转基因(tumor necrosis factor-transgenic,TNF-Tg)小鼠关节炎症损伤[7-8];体外实验发现肿瘤坏死因子(TNF-α)可刺激淋巴管内皮细胞产生诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),从而抑制淋巴管平滑肌细胞的收缩和淋巴回流[9]。在TNF-Tg关节炎动物模型和类风湿关节炎患者中均发现,应用TNF-α抑制剂可以促进淋巴管的新生[5]。可见淋巴管的新生和淋巴回流在关节炎中发挥重要作用。在系统性硬化症患者病变皮肤中淋巴管数量明显减少,指端淋巴管数量与指端溃疡病变程度成反比[10]。除数量的变化外,研究者发现皮肤淋巴管也出现微血管病变(microangiopathy),主要表现为:毛细淋巴管网断裂,淋巴管壁渗漏和淋巴液返流[11]。在原发性干燥综合征中,患者外周血中VEGF-C表达明显升高,唇腺组织淋巴管生成明显增多,具体功能和分子机制有待进一步研究[12]。有关SLE淋巴管病变的报道较少,早在1979年有通过胸导管穿刺引流淋巴液以改善SLE肾炎和皮肤病变的个案报道[13]。SLE并发乳糜胸腹腔积液或蛋白丢失性肠病,与SLE病情活动有关,给予大剂量激素和免疫抑制剂后上述症状得到明显改善[1,14]。以上研究显示结缔组织病病情进展与淋巴回流功能紧密相关。
SLE并发淋巴管受累的发病机制目前还不清楚。根据淋巴管在其他结缔组织病中的报道,推测在SLE炎症环境中,是否有促进淋巴管新生的炎症因子增多?血管炎导致血管通透性增加,淋巴液生产过多,淋巴管回流压力增高,从而造成胸导管出口相对狭窄?SLE产生多种自身抗体和免疫复合物沉积,当存在抗平滑肌抗体时可导致假性肠梗阻或输尿管扩张[15],而淋巴液回流的动力主要来源于淋巴管平滑肌收缩,SLE是否产生抗淋巴管平滑肌细胞抗体,导致功能障碍?淋巴管局部反复炎症刺激,与周围组织慢性炎症机化导致淋巴液回流障碍?淋巴管一般与静脉伴行,当发生颈静脉血栓时是否影响淋巴液回流入血?以上假设需要进一步验证。
综上,SLE在疾病过程中可以出现胸导管出口梗阻,也可以胸导管出口梗阻为SLE的首发症状。如SLE患者并发乳糜胸或者出现激素和免疫抑制剂治疗效果欠佳的胸腔积液时应警惕是否存在胸导管受累。育龄期女性出现乳糜胸或者难治性多浆膜腔积液应警惕是否并发SLE。尽管SLE并发胸导管出口梗阻具体病因及发病机制目前还不清楚,但通过患者对基础病治疗的反应,推测炎症反应可能是其中重要诱因,需要在今后的临床工作中进一步探讨。
——淋巴管系统

