抗生素磺胺对附着藻类在苦草叶片上定植及演替的影响
朱利明,陈小雨,肖文胜,尹昱苏,徐后涛,郑小燕,张玮,*,王丽卿,#
1. 上海海洋大学农业部鱼类营养与环境生态研究中心,上海 201306 2. 上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海 201306 3. 上海海洋大学水产科学国家级实验教学示范中心,上海 201306 4. 上海水生环境工程有限公司,上海 201306
磺胺类抗生素(SAs)是一种价格低廉,具有广谱性抗菌特点的抗生素;该类抗生素已作为人类用药、兽药和饲料添加剂在世界各国使用数十年[1]。目前,其在欧盟的使用量仅次于四环素类抗生素[2-3]。中国是抗生素的生产和消费大国,据统计,2013年中国抗生素生产量为24.8万t,国内消耗16.2万t,其中SAs占抗生素生产总量的5%[4]。由于这些抗生素不能完全被生物体代谢,它们通常以母体以及代谢产物的形式被排放到环境中[5]。此外,废水处理过程中对其清除不彻底,也导致其被持续释放到水环境中,因此在水环境中经常检测到SAs的存在[5]。在上海地区,自然水体、饲养场废水收集池以及灌溉水渠中都有检测到SAs,其中,自然水体中SAs浓度为219~323 ng·L-1,养殖水体和灌溉水体中SAs浓度为198~323 μg·L-1[6-8]。另有研究发现,地下水中也检测到SAs的存在,浓度甚至高达410 ng·L-1[9-10]。尽管水环境中SAs的平均浓度较低(ng·L-1或μg·L-1水平),但因其持续排放,成为水体中的一类新型的“持久性”污染物;SAs可对水生生物群落结构及其稳定性产生严重影响,并通过食物链的传递,影响高级生物,甚至人类健康[11-12]。
附着藻类是浅水湖泊生态系统的重要初级生产者,在维持水生态系统的稳定性、物质转移和能量传递以及水质净化等方面起着重要的作用[13]。已有研究表明,氮磷营养盐的变化会引起藻类群落结构的演替[14-17],氨氮浓度可对附着藻类在沉水植物叶片上的定植规律产生影响[18-19]。目前,关于抗生素对藻类影响的研究主要集中在对纯种藻株的毒理作用,例如,四环素类金霉素等会显著影响铜绿微囊藻、蛋白核小球藻和斜生栅藻的生物膜通透性及细胞色素的积累等[20-22];高浓度氯霉素、氟苯尼考对小球藻的生长可产生阻碍作用[23]。另外,关于纯种藻类对抗生素的去除研究也有少量报道,如小球藻、四尾栅藻等可以通过脱羧化、去甲基化的方式进行生物转化或生物催化从而降解环丙沙星、左氧氟沙星等抗生素[24-29]。但关于抗生素暴露条件下藻类群落水平的变化规律尚鲜有研究。
SAs的作用机理是抑制叶酸的生物合成途径,因此,SAs很可能对除细菌外的其他生物也有不同程度的副作用,如微藻、浮游动物、鱼类和大型植物等[3,11,30]。苦草(Vallisnerianatans(Lour.) Hara)是一种完全浸没的多年生生根植物,在我国淡水中广泛分布,其在释放氧气、为水生动物提供食物和住所以及通过毒素的积累或分解来维持水生生态系统的健康方面具有重要作用[31]。已有研究发现,苦草及其叶片附着微生物在去除水体抗生素磺胺(SN)方面具有显著的作用[32]。但是关于SN等对附着藻类群落结构、定植速率以及演替规律的影响研究极少。因此,本研究探讨了不同浓度的SN暴露对附着藻类在沉水植物苦草叶片表面定植及演替规律的影响,以便进一步研究其对沉水植物生长的影响,为后期应用“沉水植物-附着生物复合系统”来治理抗生素污染水体提供新的思路。
1 材料与方法(Materials and methods)
1.1 实验试剂
磺胺(sulfonamide)纯度≥99.8%,购于国药集团药业有限公司,其物化性质如表1所示。
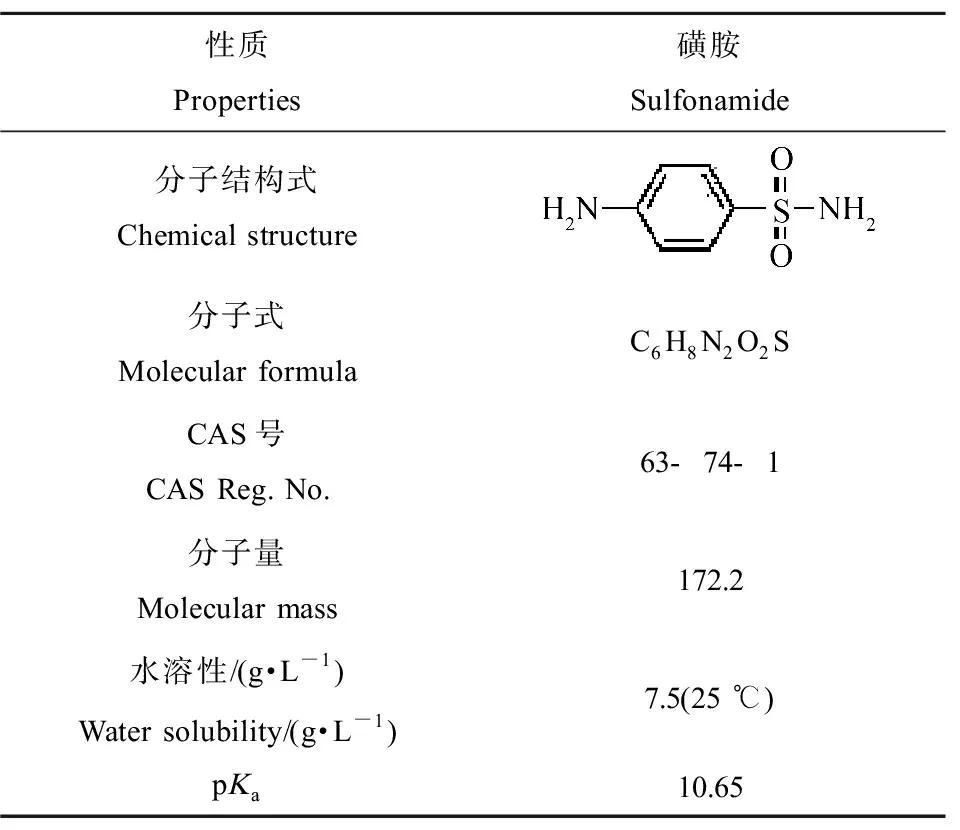
表1 磺胺(SN)的物化性质Table 1 Physico-chemical properties of sulfonamide (SN)
1.2 实验材料
于上海海洋大学临港校区明湖中采集苦草(水质基本状况如表2所示),将叶片表面清洗干净,将清洗好的苦草移载于塑料箱(40 cm×60 cm×50 cm)进行预培养15 d。选取长势相近、株长约20 cm的苦草,再次将其表面附着藻类轻轻刷去清除,移栽到7 L的玻璃标本瓶中,以透明玻璃珠作为固定基质(直径为6 mm);每个标本瓶中种植5株苦草,再次进行预培养7 d。2次预培养的营养液均是以曝气自来水为溶剂配制的10% Hoagland营养液[33]。接种的附着藻类来源于上海海洋大学校园水系沉水植物和水底石块,采集到的沉水植物和石块用软毛刷刷洗表面,将刷洗液定容,一部分留属种鉴定所用,另一部分分别等量接种到各处理组中。经鉴定所采集的附着藻类隶属于5门45属,其中蓝藻门主要有颤藻属、色球藻属,硅藻门主要有菱形藻属、舟形藻属、针杆藻属和脆杆藻属,绿藻门主要有丝藻属、小球藻属。其他门的种类较少。
表2 上海海洋大学校园水系水质状况Table 2 Water quality of campus water system of Shanghai Ocean University
1.3 实验设计
已有的毒理学研究表明,藻类对高浓度抗生素具有较好的耐受性,通常设置10~200 mg·L-1浓度进行实验[26-27]。因此,为了更好地探讨SN对附着藻类在苦草叶片上定植及演替的影响,设计1个对照组(0 mg·L-1)和3个SN处理组(10、30和50 mg·L-1)共4个不同SN浓度水平,每组4个重复,实验在室内环境中进行,室内温度为(32±1) ℃。苦草经过2次预培养后,更换标本瓶中营养液为含不同SN浓度的营养液,然后再将取自于沉水植物上的附着藻类样品等量均匀地加入每个玻璃标本瓶,每瓶约100 mL,4 d后采集附着藻类。每次每瓶取苦草叶片面积约为40 cm2,用蒸馏水及软毛刷反复刷洗苦草叶片,得到附着藻类样品,加入15‰鲁哥氏碘液和4%福尔马林溶液固定,并定容到50 mL备用。为保证各处理组SN浓度稳定,采样后更换培养液,以后每隔4 d采样一次并更换一次培养液。
1.4 附着藻类的鉴定及计数
将浓缩后的样品摇匀,取0.1 mL于帕默尔计数框内,在400倍光学显微镜下进行种类鉴定,具体处理和鉴定方法参照文献[34]。藻类相对丰度Pi=Ni/N×100,式中:Ni为第i物种的个体数,N为总个体数;以相对丰度>1%的物种为优势类群[35]。
1.5 数据处理
运用EXCEL 2007进行数据预处理,用origin 9.0作图。采用R 3.2.5中的vegan包进行主坐标分析(PCoA),比较3个实验组与1个对照组间藻类群落结构相似性及差异性。热度图采用EXCEL 2007绘制,并分析附着藻类群落结构随磺胺浓度的变化。采用Past3生物数据分析软件计算附着藻类群落α多样性指数,数据间的显著性差异采用单因素方差分析,用SPSS19.0软件完成,在进行方差分析前,对数据进行了方差齐性和正态分布的检验,若方差齐性,选择LSD检验,反之使用Dunnett’s检验(P<0.05)。所有数据以Mean±SD表示。
2 结果(Results)
2.1 不同浓度的SN对附着藻类定植速率的影响
通过热图分析不同浓度的SN处理条件下,各处理组中附着藻类定植速率的差异(图1)。4 d后在0 mg·L-1处理组中首先成为优势类群的是绿藻门(丝藻属、小球藻属)和蓝藻门(颤藻属、鞘丝藻属和色球藻属),此后硅藻门的菱形藻属和舟形藻属也成为优势类群,但是相对丰度较低。10 mg·L-1处理组中4 d后成为优势类群的有丝藻属、颤藻属和舟形藻属;菱形藻属在第8天成为优势类群,脆杆藻属在第12天成为优势类群,针杆藻属和小环藻属在第16天成为优势类群。30 mg·L-1处理组中4 d后率先成为优势类群的主要有丝藻属、颤藻属和菱形藻属,相对于对照组和10 mg·L-1处理组相对丰度较少,其他一些硅藻在12 d内陆续成为优势类群。在50 mg·L-1处理组中也发现了类似30 mg·L-1处理组的规律。
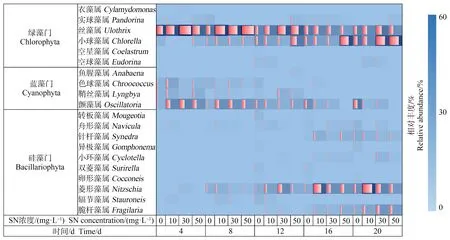
图1 不同浓度SN处理组中主要附着藻类类群的定植及演替过程注:红色方块的宽窄表示相对丰度的大小。Fig. 1 Process of colonization and succession of epiphytic algae in each treatment group with different SN concentrationNote: The width of the red square indicates the relative abundance.
2.2 不同浓度的SN对附着藻类种群演替的影响
在0 mg·L-1处理组的附着藻类种群的整个演替过程中发现,随着时间的推移成为优势类群的藻类依次为:4 d(丝藻属、颤藻属和小球藻属)、8 d(菱形藻属和舟形藻属)、12 d后(卵形藻属)。其中,丝藻属的相对丰度随着时间逐渐下降,12 d后趋于稳定。颤藻属、菱形藻属和小球藻属的相对丰度随时间逐步上升。舟形藻属和卵形藻属的相对丰度较低(图2(a))。结合图1分析可知,20 d后基本形成了以硅藻门(针杆藻属、脆杆藻属和菱形藻属)和蓝绿藻门(颤藻属、丝藻属和小球藻属)共存的稳定群落。
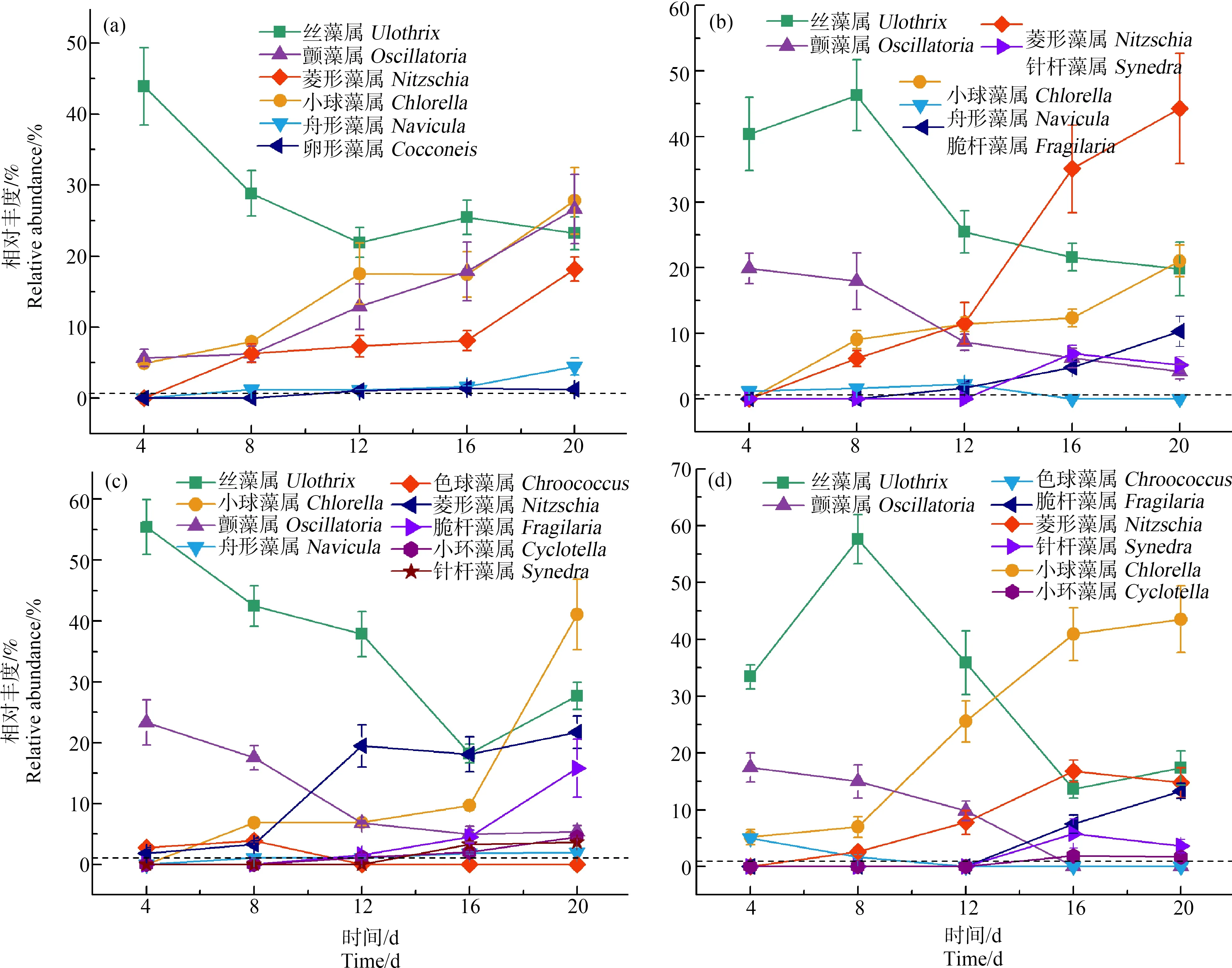
图2 不同SN处理组中附着藻类相对丰度的变化注:虚线以上为优势属;(a) 0 mg·L-1,(b) 10 mg·L-1,(c) 30 mg·L-1,(d) 50 mg·L-1。Fig. 2 Relative abundance of epiphytic algae in different SN treatment groupsNote: Above the dotted line is the dominant genus; (a) 0 mg·L-1; (b) 10 mg·L-1; (c) 30 mg·L-1; (d) 50 mg·L-1.
4 d后,10 mg·L-1处理组中丝藻属和颤藻属首先定植成为优势类群(图2(b))。第8天菱形藻属、舟形藻属以及小球藻属成为优势类群;16 d后脆杆藻属和针杆藻属定植成为优势类群,但舟形藻属逐渐消失。其中,丝藻属的相对丰度逐渐下降,且相对丰度与对照组接近;颤藻属的相对丰度也呈下降趋势,总体丰度低于对照组;硅藻门的藻类(菱形藻属、脆杆藻属和针杆藻属)定植速率较慢,但其相对丰度随时间呈上升趋势,其中菱形藻属相对丰度远高于对照组和其他2个SN处理组。从30 mg·L-1处理组中附着藻类种群演替过程可以看出(图2(c)),第4天成为优势类群的有颤藻属、丝藻属、色球藻属和菱形藻属,但只有颤藻属和丝藻属的相对丰度较大;8 d后小球藻属成为优势种群;12 d后色球藻属由于不能很好地适应较高的SN浓度,逐渐消失。从相对丰度角度分析(图2(c)),丝藻属和颤藻属逐渐下降;菱形藻属和小球藻属随时间呈上升趋势,表明其对SN具有较强的耐受性。50 mg·L-1处理组(图2(d))附着藻类在4 d后最先成为优势类群的是丝藻属、颤藻属、色球藻属和小球藻属;第8天时,色球藻属消失,对比30 mg·L-1处理组色球藻属变化规律(图2(c))可知,更高的SN浓度使其更快的消亡;16 d后,脆杆藻属、针杆藻属和小环藻属成为优势类群,其中小环藻属相对丰度较低。由图2(d)可知,丝藻属、颤藻属以及色球藻属的相对丰度随时间逐渐下降;小球藻属、菱形藻属、脆杆藻属和针杆藻随时间呈上升趋势。
综合比较4个处理组中苦草表面附着藻类20 d的定植规律发现,最先定植的是蓝藻门的颤藻属,绿藻门的丝藻属。硅藻门的藻类一般在8 d后才会逐渐成为优势类群。针杆藻属、脆杆藻属、菱形藻属、小球藻属和丝藻属对SN具有一定的耐受能力,SN对色球藻属、颤藻属和舟形藻属的影响较大。
2.3 不同浓度的SN对附着藻类群落结构的影响
运用PCoA分别对不同处理组各采样时间点进行附着藻类群落β多样性的比较分析(图3),发现在4 d时,处理组A(对照组)与处理组D(50 mg·L-1SN)间表现出显著差异(P<0.05),8 d时,处理组A(对照组)与处理组B(10 mg·L-1SN)、处理组C(30 mg·L-1SN)间具有显著差异(P<0.05),其余组间群落结构差异不显著(P>0.05)。12 d时,处理组C(30 mg·L-1SN)与处理组D(50 mg·L-1SN)之间附着藻类群落结构差异性显著(P<0.05),其他处理组之间均不存在显著性差异(P>0.05)。第16天和第20天时,各处理组之间均无显著性差异(P>0.05),群落结构较为相似。如图4所示,实验结束后,D处理组(50 mg·L-1SN)的α多样性指数显著小于对照组和其他SN处理组(P<0.05)。
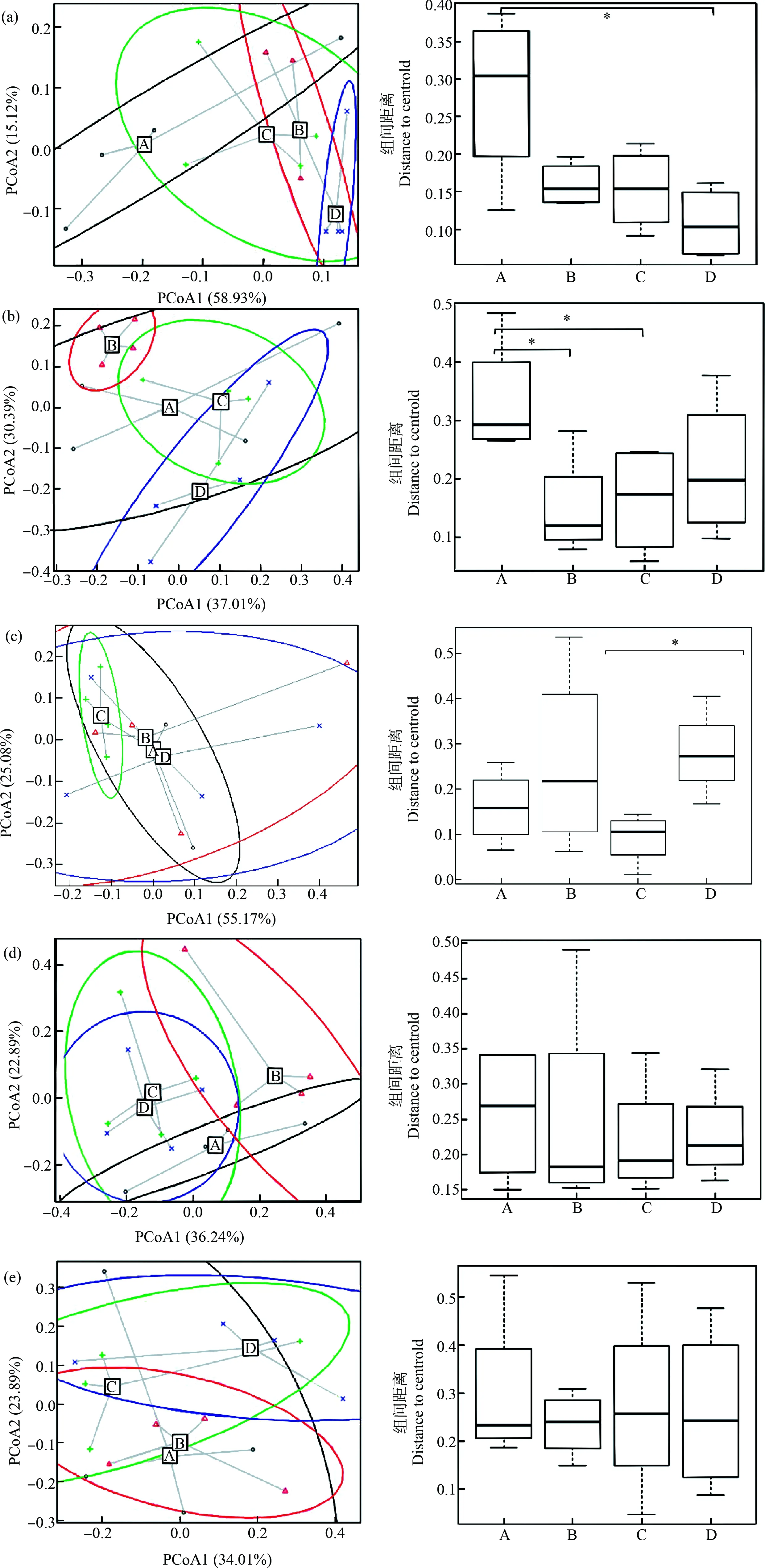
图3 藻类群落的主坐标分析(PcoA)注:A. 0 mg·L-1,B. 10 mg·L-1,C. 30 mg·L-1,D. 50 mg·L-1;(a) 4 d,(b) 8 d,(c) 12 d,(d) 16 d,(e) 20 d;*P<0.05。Fig. 3 The principal co-ordinates analysis (PcoA) of algae communityNote: A. 0 mg·L-1, B. 10 mg·L-1, C. 30 mg·L-1, D. 50 mg·L-1; (a) 4 d, (b) 8 d, (c) 12 d, (d) 16 d, (e) 20 d; *P<0.05.
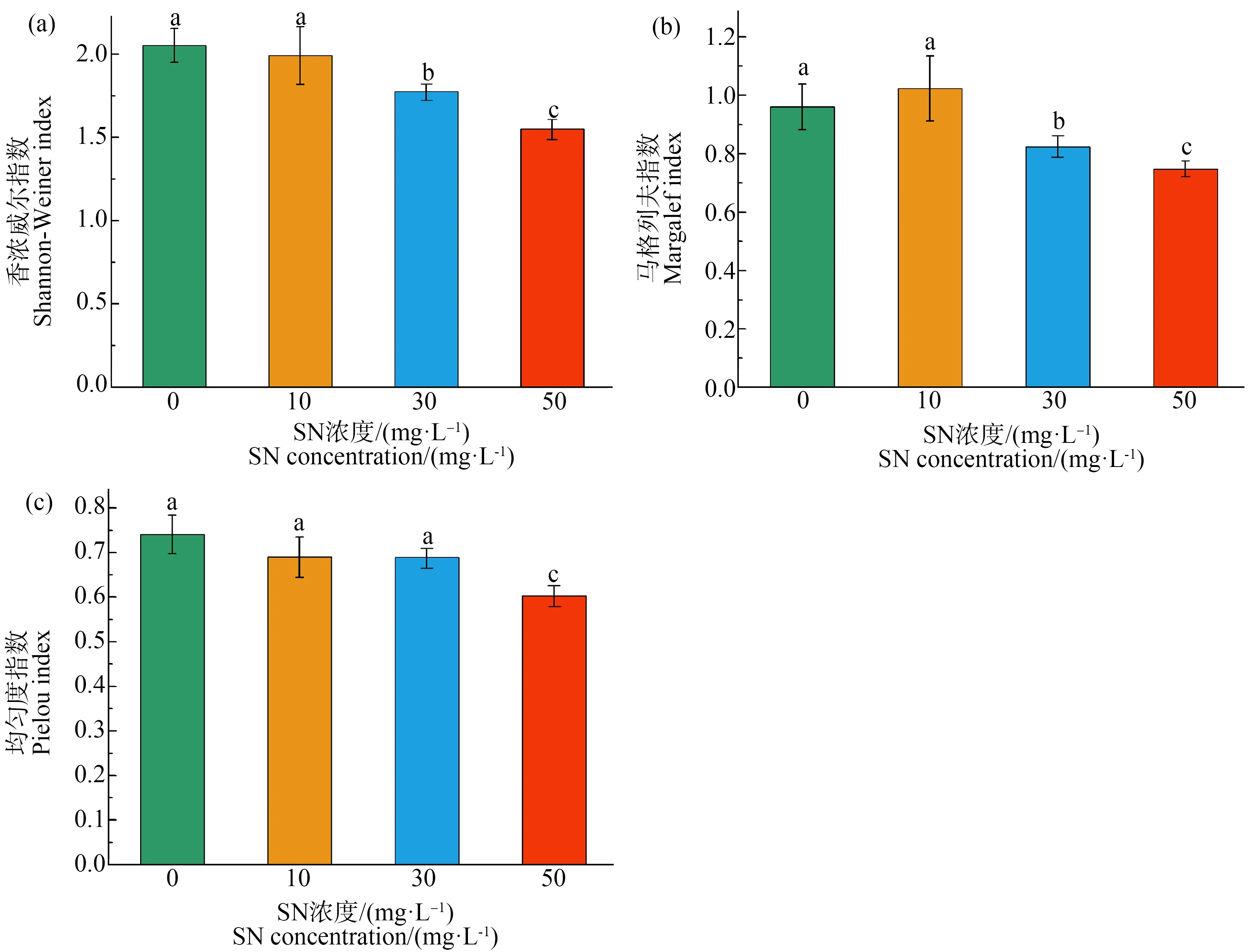
图4 SN暴露20 d时苦草叶片附着藻类群落α多样性指数的变化注:所有数据以Mean±SD表示,n=4;不同的字母表示2组之间具有显著性差异(P<0.05)。Fig. 4 Changes of α diversity index of epiphytic algae communities in V. natans leaves after SN exposure for 20 dNote: Data are shown as the mean±SD (n=4); different letters represent significant difference at the P<0.05 level.
3 讨论(Discussion)
3.1 SN对附着藻类定植速率的影响
本研究发现,在不同浓度SN胁迫下,苦草表面附着藻类的定植速率受到了不同程度的影响。总体来说,各处理组中丝藻属和颤藻属相比其他藻类更容易定植到苦草叶片表面;在第4天时只有3种硅藻定植,且只在对照组和10 mg·L-1处理组出现,较高SN浓度(30 mg·L-1和50 mg·L-1)条件下并未发现;硅藻的定植种类在第12天后逐渐增加(图1)。已有研究发现,夏季高温环境更利于蓝藻和绿藻成为优势种[36-37],这与本研究环境相似。硅藻作为一种指示生物,其种群数量可以反映环境的污染程度[38],本研究中高浓度的SN对其造成了一定影响。已有研究表明,包括尖针杆藻(Synedraacus)、曲壳藻(Achnanthessp.)在内的6种硅藻的生物量与水温度负相关,适合在低温下生活[39]。也有研究表明,菱形藻属的最适温度多处于10~30 ℃之间,较高或较低的温度都会对其生长产生负面影响[40]。附着藻类的生长及发展受周围诸多环境因子的影响,不同季节附着藻类的种类有差异[41];不同光照强度下,附着藻类的生物量也会不同[42]。本实验温度维持在(32±1) ℃,较高的实验温度可能并不适合硅藻的定植。此外,本实验中苦草叶片上定植的附着藻类为人工添加,并且SN浓度远高于环境浓度,因此定植速率可能与现实环境有一定的差异。
3.2 SN对附着藻类演替规律的影响
本研究的各处理组中,附着藻类的演替规律也有所不同(图1和图2)。SN处理组中丝藻属、颤藻属和色球藻属的相对丰度随时间呈现下降的趋势,且蓝藻门的颤藻属和色球藻属受SN的影响较大;高浓度的SN(30 mg·L-1和50 mg·L-1)促进了小球藻属的定植生长;较低浓度的SN(10 mg·L-1)刺激了菱形藻属的定植和生长,高浓度SN(30 mg·L-1和50 mg·L-1)抑制了其定植生长(图2)。7种氟喹诺酮类抗生素对5种水生生物的毒性研究表明,蓝细菌(铜绿微囊藻(Microcystisaeruginosa))是最敏感的生物,其次是浮萍(Lemnaminor)和绿藻[43]。另有研究表明,四环素类抗生素能够抑制铜绿微囊藻和绿藻的蛋白质合成,并且可能通过抑制叶绿体酶的活性,对植物生长产生抑制作用[20,44-45]。大多数抗生素对以铜绿微囊藻为代表的蓝藻的毒性要大于绿藻、隐藻等其他种群[43],常通过影响藻类细胞成分、改变细胞膜的通透性、影响基因表达、阻碍光合作用进程、诱导产生活性氧自由基、引发氧化胁迫和破坏抗氧化酶系统等方式来影响蓝藻[46-48]。在本研究中,蓝藻门的颤藻属和色球藻属的相对丰度受SN的影响最大(图2)。小球藻相对于水华束丝藻(Aphanizomenonflosaquae)、颤藻、水华微囊藻(Microcystisflos-aquae),对羟基苯甲酸的耐受性更强[49];另外还有学者发现,绿藻对于抗生素的耐受性较高,其中小球藻(Chlorellasp.)和微绿球藻(Nannochloropsis)对氯霉素、四环素、卡那霉素和氨苄青霉素都不敏感[50]。Xiong等[51]的研究也表明,小球藻对恩诺沙星具有一定的耐受性,且其对恩诺沙星去除率最高可达26%。藻类在受到胁迫时会释放藻类胞外聚合物(extracellular polymeric substance, EPS),其主要成分为蛋白质和多糖,可以起到保护细胞,使其凝聚为团体以抵御捕食等作用[52]。在本研究中,绿藻门的小球藻属对SN具有很强的耐受性,且高浓度的SN(30 mg·L-1和50 mg·L-1)促进了其定植生长(图2(c)和图2(d))。“毒性兴奋效应(Hormesis)”是指污染物在低剂量下刺激受试物种生长、高剂量下抑制其生长现象的剂量-反应关系[53]。SN对菱形藻属的定植表现出“低促高抑”的现象,显示出了显著的“毒性兴奋效应”(图2)。施文杰等[54]研究发现,在低浓度的诺氟沙星(1 mg·L-1)处理下,新月菱形藻(Nitzschiaclosterium)的终止生物量(Bf)要略高于对照组,这可能与毒性兴奋作用有关。
群落组成最初受随机性过程控制,但随着演替的进行,在选择机制中会存在规模依赖性[55]。Jackson等[56]的研究表明,在饮用水生物膜形成的初始阶段,由于“种源”不同,首先定植的具体物种可能会存在一定的不确定性;微型生物群落的特征是不同种群的定植,缺乏有序的群落结构,这可以部分解释本研究初始阶段各处理组群落结构差异显著的现象(图3(a)和图3(b))。PCoA分析表明,SN胁迫条件下,苦草叶片表面的附着藻类群落结构在胁迫后期,各处理组间差异逐渐减小,一方面可能说明SN的负面影响随着时间减小,另一方面也是由于SN对附着藻类物种产生的“环境过滤”、“筛选”效应所致,只有对SN耐受较强的物种才可获得较高的优势度(图3(e))。实验结束后,高浓度SN处理组的α多样性指数显著小于对照组(P<0.05)(图4)。Kang等[57]的研究也发现,药品和个人护理产品(PPCPs)也会降低附着藻类的物种多样性,这可能与不同物种对这些新型污染物的生理耐受性和生态适应能力有关。

