3种多环芳烃对海胆细胞色素CYP17A1基因表达的影响
刘帅,宿甜甜,刘长发,魏海峰,*,赵肖依,宋雪
1. 辽宁省近岸海洋环境科学与技术重点实验室,大连 116023 2. 大连海洋大学海洋科技与环境学院,大连 116023 3. 大连海洋大学,农业农村部北方海水增养殖重点实验室,大连 116023
近年来,工农业废水以及生活污水大量排入海域、海上油气开发以及海洋溢油事件频发,造成海洋环境污染日益加重,给海洋生物资源带来危害[1]。海洋溢油事件发生后,石油类分解产生多种多环芳烃(PAHs),多环芳烃类污染物分布面积广、致癌性作用强、数量多,与人类生命活动密切相关,是典型的“三致”物质,因此,对PAHs类污染物的生态毒理学研究具有重要意义[2]。研究初期,研究者大多剖析优先控制的16种PAHs,忽视PAHs衍生物的危害性[3]。苯并(a)芘、菲和蒽是最典型的3环PAHs,在石油中含量较高,关于其毒性的研究报道较多[4-5]。国内外关于3-甲基菲和2-甲基蒽和苯并(a)芘毒性的研究缺乏,其毒性机理需深入研究。
CYP17A1(全称为细胞色素P450c17α)是细胞色素P450酶系家族成员之一,该酶同时具有17α-羟化酶、17,20-裂解酶的活性,是一类典型的膜结合的双功能单氧酶,在类固醇性激素合成的途径中起关键作用,是治疗前列腺癌和乳腺癌的重要靶标[6]。PAHs能经过不同途径进入生物体内,从而导致细胞色素P450酶系CYP活力发生不同程度的改变,不同浓度不同种类的PAHs污染物会使CYP含量发生不一致的变化,因此,选用CYP17A1作为毒理学研究的生物标志物,从而观测生物体及生态环境污染程度。在本实验中,选用克隆CYP17A1基因进行相关研究,因为影响CYP17A1基因表达量的P450酶很难分离纯化且不稳定[7-8]。
中间球海胆(Strongylocentrotusintermedius)早期幼体主要以单胞藻类为食,当变态为稚海胆转食底栖硅藻,成体主要食褐藻类、红藻类和绿藻类等大型底栖海藻[9]。我国辽东半岛和山东半岛有这种海胆的养殖[10],实验资源丰富,且生物特征无缺损,是毒理学研究的良好实验体[11]。已有研究进行了多环芳烃类污染物对翡翠贻贝(Pernaviridis)胚胎[12]、仿刺参(Apostichopusjaponicus)[13]和多齿围沙蚕(PeriereisnuntiaSavigy)[14]的毒性评价。与其他海洋生物相比,PAHs污染物对海胆的毒性研究缺乏。因此,以中间球海胆为实验对象,分别设置2组不同底物的对照组以及3组不同浓度的苯并(a)芘、3-甲基菲和2-甲基蒽处理组,检测暴露3、7和14 d后其体内CYP17A1基因的相对表达量。并且根据实验数据分析中间球海胆CYP17A1基因的表达与苯并(a)芘、3-甲基菲和2-甲基蒽暴露浓度之间的关系,为筛选合适敏感标志物提供基础[15]。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:CFX Connect荧光定量PCR仪(美国BIO-RAD),Nano-400A微量核酸蛋白分析仪(杭州奥盛仪器有限公司),TG16-WS型台式微量高速离心机(长沙湘智离心机仪器有限公司),TS-211GZ恒温摇床(常州中诚仪器制造有限公司)。
试剂:苯并(a)芘、2-甲基蒽和3-甲基菲购自Sigma公司(Sigma-Aldrich Corporation, USA),纯度分别为>97%、>97%和>98%;丙酮(分析纯,太仓市双龙贸易有限公司),PrimeScriptTMRT reagent Kit、SYBR PrimeScriptTMRT-PCR Kit Ⅱ和Trizol RNA提取试剂盒均购自上海生工生物有限公司。
1.2 实验材料
从大连海宝渔业有限公司购买健康的中间球海胆(Strongylocentrotusintermedius),因稚海胆对污染物反应灵敏,且其组织样品获取比较容易,故以稚海胆为实验受体。选取直径为(0.8±0.1) cm稚海胆,在实验室海水循环水养殖系统中暂养2周,期间投喂新鲜海带,选健康且状态、大小相同的个体用于实验。
1.3 多环芳烃毒性实验
用海水作为实验用水,装入1 L洁净玻璃烧杯中。将3种多环芳烃以体积分数为1‰的丙酮为助溶剂配成500 μg·L-1的3种储备液,再将这3种储备液用海水稀释成不同浓度的多环芳烃实验溶液。其中,苯并(a)芘浓度分别为1、5和20 μg·L-1,3-甲基菲浓度分别为5、10和100 μg·L-1,2-甲基蒽浓度分别为5、10和50 μg·L-1,同时设置2个对照组,分别为空白对照组和1‰丙酮助溶剂对照组,各处理组设置3个平行组。实验模拟海胆生活习性,每个烧杯中放5只海胆,水温(15±2) ℃,盐度(30±1),pH为8.0±0.5,连续充气以防缺氧,确保溶解氧>4.0 mg·L-1,在弱光条件下进行。
以开始培养为时间起始点,每隔2天换一次新鲜海水,并按以上述步骤重复投加相应的浓度的污染物。
1.4 样品采集及RNA提取
取在不同浓度苯并(a)芘、3-甲基菲和2-甲基蒽以及不同暴露时间的海胆各3只,为防止RNA流失,取出的海胆必须放在冰上进行操作,用移液枪取海胆体液100 μL,装入tube管后立即投入液氮,-80 ℃保存。
1.5 CYP17A1基因表达的测定
用PrimeScriptTMRT reagent Kit进行反转录,用CFX Connect荧光定量PCR仪并采用SYBR PrimeScriptTMRT-PCR Kit Ⅱ进行实时定量PCR。反应条件:95 ℃、30 s,95 ℃、10 s,55 ℃、25 s,72 ℃、25 s,40个循环。采用delta-deltaCT法,并通过海胆的内标基因AB510191.1(Actin)的校正,记录实验样品中CYP17A1基因表达量。采用相对定量方法分析在不同浓度苯并(a)芘、2-甲基蒽和3-甲基菲培养下海胆细胞CYP17A1基因表达的规律,选取海胆体内β-Actin基因表达的规律作为内参基因,根据前期实验获得的海胆CYP17A1序列信息,采用Primer5.0软件设计引物,引物序列具体信息如表1所示。
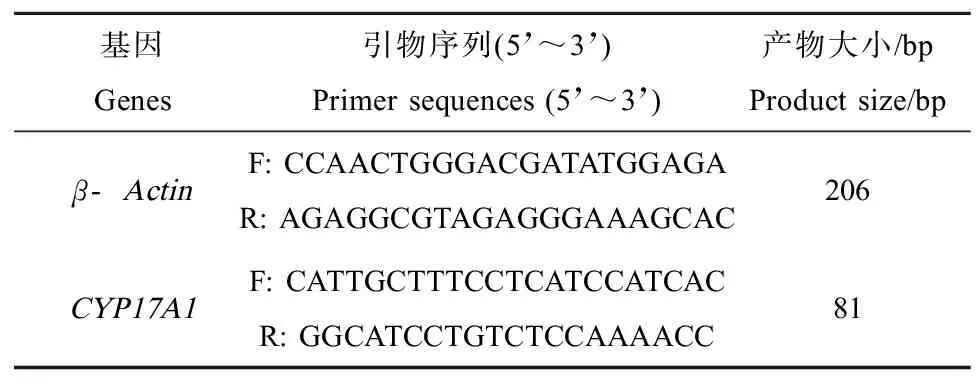
表1 相关基因扩增引物名称及其序列Table 1 Name and sequence of the target gene amplified with primers
1.6 数据统计与处理
实验数据以3次重复试验数据的平均值±标准差表示。数据统计学分析利用SPSS 16统计软件来完成,荧光定量PCR数据差异性分析用单因素方差分析法来完成。P<0.05为差异显著。
2 结果(Results)
2.1 苯并(a)芘对中间球海胆CYP17A1基因表达的影响
海胆在不同浓度苯并(a)芘培养下,其CYP17A1表达量的变化如图1所示。短时间内,空白对照组CYP17A1基因的相对表达量高于丙酮对照组,但暴露后期(14 d),2个对照组CYP17A1基因的相对表达量几乎相近,说明丙酮对海胆CYP17A1基因的表达无影响。苯并(a)芘胁迫初期(3 d),与丙酮对照组相比,各处理组海胆CYP17A1基因的相对表达量更高,而随着胁迫浓度的升高,各处理组海胆CYP17A1基因的相对表达量逐渐降低,即受到的抑制作用逐渐升高,存在明显的剂量-效应关系。苯并(a)芘胁迫中期(7 d),随着胁迫浓度的升高,海胆CYP17A1基因的相对表达量表现出显著降低的趋势。苯并(a)芘胁迫后期(14 d),与丙酮对照组相比,5 μg·L-1和20 μg·L-1处理组对海胆CYP17A1基因的表达产生显著作用,在胁迫浓度达到20 μg·L-1时,海胆CYP17A1基因的相对表达量达到最小值0.607(P<0.05)。
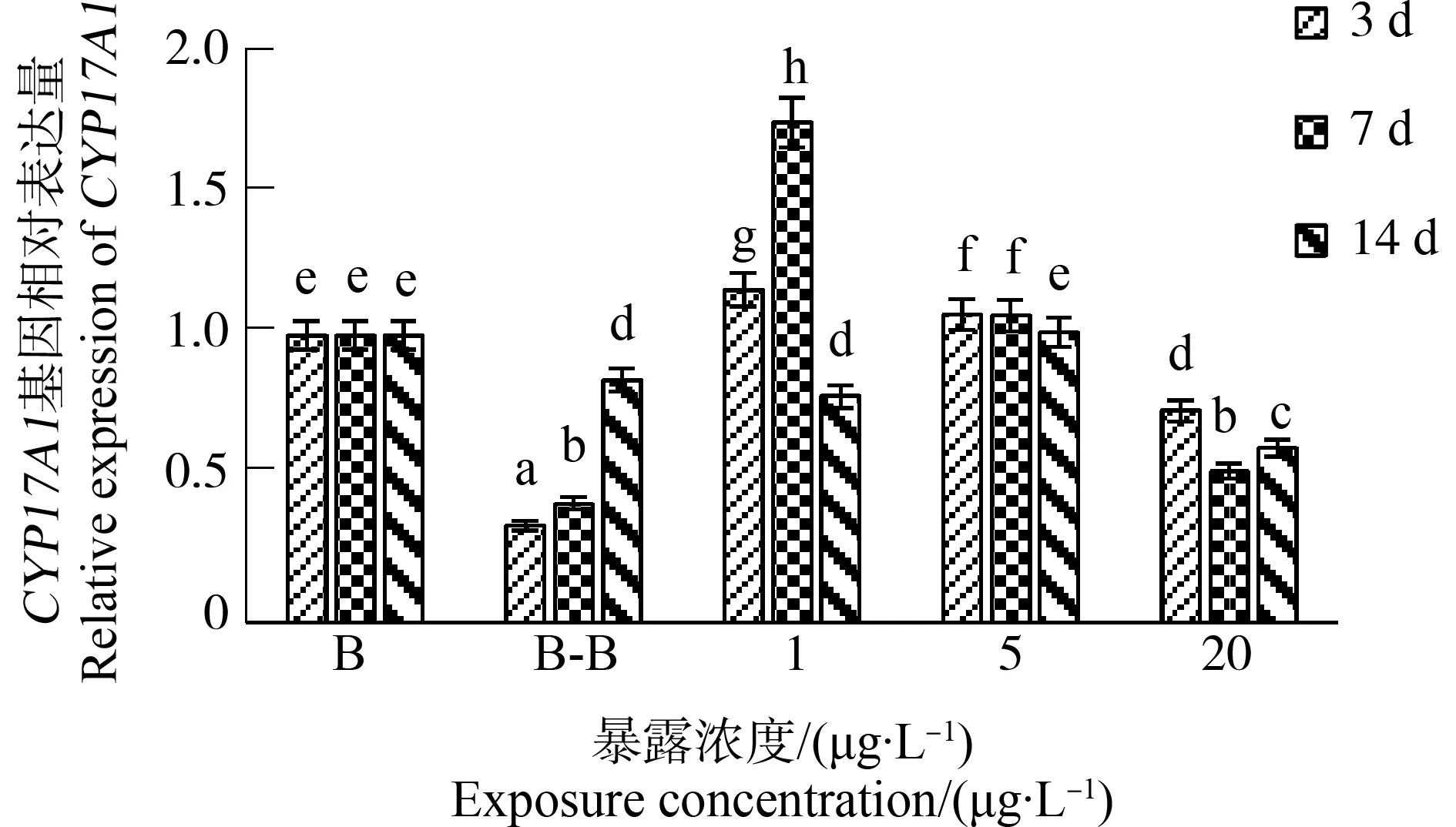
图1 不同浓度苯并(a)芘对海胆体内CYP17A1基因表达的影响注:将所有处理组与对照组进行比较,标有不同小写字母者表示显著性差异(P<0.05),标有相同小写字母者表示无显著性差异(P>0.05);横坐标中B表示空白对照组,B-B表示丙酮助溶剂对照组;下同。Fig. 1 The effect of benzopyrene at different concentrations on the expression of CYP17A1 gene in Strongylocentrotus intermediusNote: All treatment groups were compared with the control group, significant difference (P<0.05) was indicated by different lowercase letters, while no significant difference (P>0.05) was indicated by the same lowercase letters; B represents the seawater control group and B-B represents the acetone control group; the same below.
2.2 不同浓度3-甲基菲对中间球海胆CYP17A1基因表达的影响
海胆在不同浓度3-甲基菲培养下,其CYP17A1表达量的变化如图2所示。3-甲基菲胁迫初期(3 d)对海胆CYP17A1基因的表达表现出显著的抑制作用(P<0.05),随着暴露浓度的升高,CYP17A1基因相对表达量逐渐降低,胁迫浓度达到100 μg·L-1时海胆CYP17A1基因的相对表达量明显达到最小值0.153。3-甲基菲胁迫中期(7 d),海胆CYP17A1基因的表达也受到显著的抑制作用(P<0.05)。3-甲基菲胁迫后期(14 d),随着浓度增高,CYP17A1基因的相对表达量显著增大,胁迫浓度达到100 μg·L-1时相对表达量达到最大值2.428,显著大于对照组(P<0.05)。
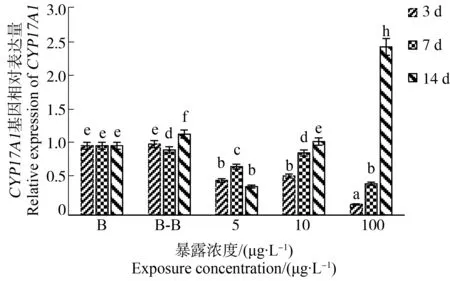
图2 不同浓度3-甲基菲对海胆体内CYP17A1基因表达的影响Fig. 2 The effect of 3-methylphenanthrene at different concentrations on the expression of CYP17A1 gene in Strongylocentrotus intermedius
2.3 不同浓度2-甲基蒽对中间球海胆CYP17A1基因表达的影响
海胆在不同浓度2-甲基蒽培养下,其CYP17A1基因表达量的变化如图3所示。2-甲基蒽胁迫初期(3 d)对海胆CYP17A1基因的表达表现出显著的抑制作用(P<0.05),且随着暴露浓度的逐渐递增,CYP17A1基因相对表达量逐渐降低,胁迫浓度达到50 μg·L-1时海胆CYP17A1基因的相对表达量达到最小值0.43。2-甲基蒽胁迫中期(7 d),海胆CYP17A1基因的表达受到较显著的抑制作用(P<0.05)。2-甲基蒽胁迫后期(14 d),海胆CYP17A1基因的相对表达量随着胁迫浓度的升高,逐渐降低,分别在胁迫浓度为5 μg·L-1和50 μg·L-1时CYP17A1基因的相对表达量达到最大值1.618和最小值0.164。
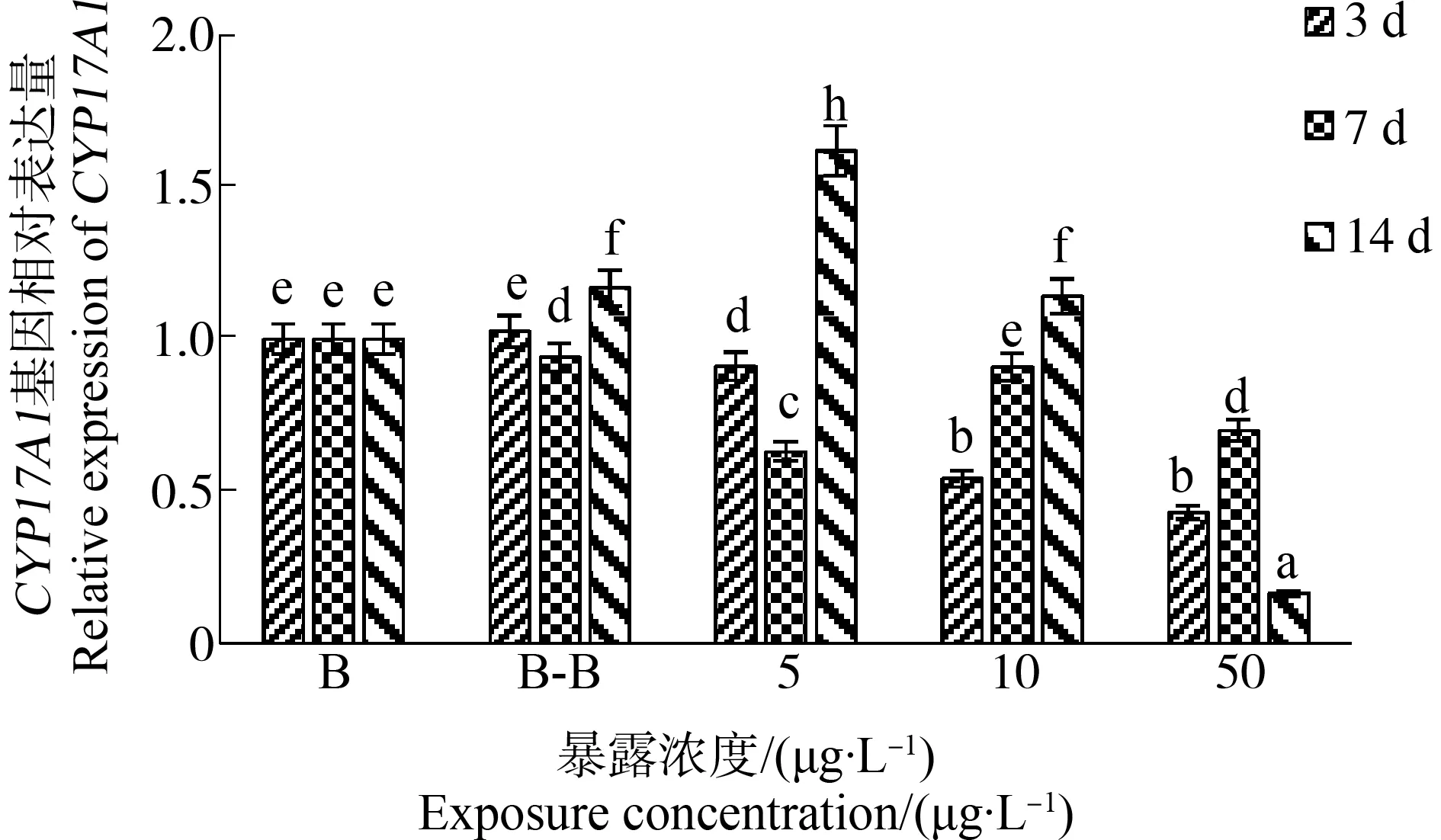
图3 不同浓度2-甲基蒽对海胆体内CYP17A1基因表达的影响Fig. 3 The effect of 2-methylanthracene at different concentrations on the expression of CYP17A1 gene in Strongylocentrotus intermedius
3 讨论(Discussion)
从整体上看,高浓度苯并(a)芘(20 μg·L-1)和2-甲基蒽(50 μg·L-1)污染物长时间作用(14 d)会抑制CYP17A1基因的表达,且高浓度3-甲基菲污染物在3 d和7 d时也会抑制CYP17A1基因的表达。多芳环烃在海胆体内的富集动力学研究表明,苯并(a)芘、3-甲基菲和2-甲基蒽随暴露时间的增长和浓度的增加富集程度升高[16]。可以推测,有毒污染物进入海胆体内会阻止构成CYP17A1基因的相关酶的合成,同时CYP17A1基因的表达可以反抑制污染物的作用,以维持生物有机体的正常生理活动,但不同浓度污染物作用时间不同会导致抑制强度不同,这与CYP17A1基因在生物体内功能密切相关。免疫系统与新陈代谢系统彼此相互联系,它们都参与生物机体抵抗外来侵害的过程,如抵御病毒、细菌以及其他外源化合物,而且生物转化系统与众多激素类产物的调控过程相互关联,其中,细胞色素氧化酶P450单氧化酶类起着重要的转化作用[17]。CYP450酶系是一个大的基因家族,能生物转化多种化合物,具有解毒和代谢的功能[18]。而CYP17A1是生物体内CYP450血红蛋白或相同结构域的酶系,可以转化来自生物体外的或存在生物体内的多种化合物[18]。为维持生物有机体内环境的相对稳定,生物系统具有一定的防范保护措施,当具有差异的外源化合物进入生物体内,细胞内环境中的解毒和代谢系统发生响应,及时发挥保护作用[19]。研究发现,进入生物体内的污染物在P450酶系的作用下,经过一系列生物代谢,毒性大大降低[20]。在有机污染物Ι相代谢过程中,会生成活性氧产物,大量的活性氧会损伤生物机体,甚至会阻止CYP17A1基因的表达[21-24]。在生物代谢过程中,用CYP450酶系转化的原子氧可加快底物羟基化或环氧化,也可为下一转化外源化合物的反应酶提供基础[25]。
在本实验中,海胆CYP17A1基因的表达在苯并(a)芘胁迫14 d后受到抑制,在3-甲基菲胁迫3 d和7 d时均受到抑制,而3-甲基菲处理组(100 μg·L-1)胁迫14 d后表现出显著的诱导作用(P<0.05),在2-甲基蒽胁迫3 d和7 d时均受到抑制,而2-甲基蒽处理组(5 μg·L-1)胁迫14 d后表现出较显著的诱导作用(P<0.05)。因此,海胆CYP17A1基因的表达在不同多环芳烃胁迫下表现出不同的变化规律。这与2-甲基蒽等对仿刺参(Apostichopusjaponicus)CYP450基因的影响[13]、苯并(a)芘对栉孔扇贝(Chlamysfarreri)消化盲囊中8-OHdG含量的影响[26]以及苯并(a)芘对黑鲷(Sparumacrocephalus)肝脏谷胱甘肽巯基转移酶(GST)活性的影响[27]有着相似的规律。由此可以推断,刚开始反应阶段(3 d和7 d)苯并(a)芘诱导海胆CYP17A1基因的表达,生物机体利用相关酶抵制外源污染物的毒性作用,使细胞的应激反应减缓,由于其调节能力有一定的限制,CYP17A1基因的表达不能永久提升,随着暴露时间的增加(14 d),海胆遭受到的毒性强度超过其最大耐受性,CYP17A1基因的合成系统会遭到破坏,因此,CYP17A1基因的相对表达量会降低,最终出现中毒现象。已有学者报道过相似的结果,王淑红等[28]发现菲、芘等多环芳烃在暴露初期会诱导菲律宾蛤仔(Ruditapesphilippinarum)消化腺超氧化物歧化酶(SOD)活性,而穆景利等[29]发现苯并(a)芘长时间作用会抑制黑鲷(Sparusmacrocephalus)胆汁中代谢产物3-羟基-苯并(a)芘的生成。而CYP17A1基因对3-甲基菲和2-甲基蒽的耐受能力较弱,暴露初期(3 d和7 d)3-甲基菲和2-甲基蒽即抑制海胆CYP17A1基因的表达。但随着暴露时间延长,在14 d时,有的处理组中海胆CYP17A1基因的表达显著升高,是因为诱导了细胞色素P450相关系统发生解毒代谢的过程,进而发生氧化应激,使细胞体内产生过量的活性氧,从而诱导CYP17A1基因家族的表达。在芘对马氏珠母贝肝胰腺hsp90基因的影响以及石油烃对马粪海胆(Hemicentrotuspulcherrimus)生殖腺过氧化氢酶(CAT)活性的影响的研究中发现类似规律[30-31]。对比可发现,3-甲基菲对海胆CYP17A1基因表达的影响小于2-甲基蒽。笔者比较了3种多环芳烃暴露下海胆CYP17A1基因的相对表达量(平均值)。在苯并(a)芘的影响下,海胆CYP17A1基因平均相对表达量为0.907;在3-甲基菲的影响下,海胆CYP17A1基因平均相对表达量为0.795;在2-甲基蒽的影响下,海胆CYP17A1基因平均相对表达量为0.782。3种物质对海胆CYP17A1基因相对表达量影响程度总体趋势为苯并(a)芘>3-甲基菲>2-甲基蒽,可能因为三者结构及性质的差异。为更完全了解污染物对海胆的毒性作用机理,需要进一步研究化合物结构对毒性的影响。

