22项生化项目进行风险管理的统计质量控制策略设计
肖雪莲,李翔,周小琳,马健
(四川锦欣妇女儿童医院检验科,成都 610066)
质量控制(QC)是实验室保证检测质量的重要有效手段,实验室通过制定质控策略来监控检测系统的检测性能,以确保检验结果的可靠性。但是当我们制定了不恰当的质控策略时,则不能确定对检验结果有效性具有危害的性能变化幅度,而这些变化可能会显著增加错误的患者结果的风险。设计良好的质控策略则能快速检测出测量系统产生了患者结果有危害风险的变化,以使有影响的患者结果的数量最小化。临床实验标准研究院(CLSI)2016年版的C24-Ed4文件《定量检测程序的统计质量控制》提供了建立基于风险统计质量控制(SQC)策略的指南[1]。该指南指导实验室确立检测项目所需的质量、检测系统的性能指标以及SQC程序(质控规则、质控检测数、SQC事件频率或运行量)的患者危害风险[2],以选择SQC策略的方法。本研究根据C24-Ed4中的SQC文件指南,运用统计QC设计程序为AU5810全自动生化分析仪22项常规生化项目进行SQC策略的设计,并实际运用于日常工作中。
1 材料与方法
1.1仪器与试剂 AU5810全自动生化分析仪及原装配套试剂与校准品(贝克曼库尔特公司)。质控品:2个浓度水平的质控品(批号:1255VN和946UE,英国Randox公司)。
1.2研究项目 钠(Na)、钾(K)、氯(Cl)、钙(Ca)、镁(Mg)、磷(P)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、总蛋白(TP)、总胆红素(T-Bil)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、淀粉酶(Amy)。
1.3数据来源与计算 确定检测项目所需的允许分析总误差(TEa)、确定方法的不精密度(CV)和偏移(Bias)、以及计算西格玛度量(σ)值。本研究中所有项目的临床允许分析总误差(TEa)采用WS/T403-2012临床生化检验常规项目分析质量要求[3];精密度来源于本实验室2018年1月至2019年6月累计的2个批次质控的变异系数(CV);项目T-Bil、P的偏移来自于我室参加2018年度国家卫生健康委临床检验中心室间质量评价中与室内质控相近浓度结果值,其余项目的偏移来自于我室参加的2018年度国家卫生健康委临床检验中心正确度验证计划。计算西格玛度量公式:σ=(TEa-|Bias|)/CV。通过计算公式,每个项目得到2个σ值,选择低σ值[4]来制定SQC程序。
1.4西格玛度量运行大小诺曼图(Sigma-Metric Run Size Nomogram)
1.4.1西格玛度量运行大小诺曼图规则描述 (1)MR4表示13s/22s/R4s/41s多重规则,每个QC事件有4个控制测量值,误差检出率为1.00(Ped=1.00),假失控率为0.03或3%(Pfr=0.03);(2)1∶3s N4表示13s单规则,每个QC事件有4个控制测量值,误差检出率为0.98(Ped=0.98),假失控率为0.01或1%(Pfr=0.01);(3)MR2表示13s/22s/R4s多重规则,每个QC事件有2个控制测量值,误差检出率为0.94(Ped=0.94),假失控率为0.01或1%(Pfr=0.01);(4)1∶3s N2表示13s单规则,每个QC事件有2个控制测量值,误差检出率为0.085(Ped=0.85),假失控率为0.00或1%(Pfr=0.00);(5)1∶2s N1表示12s单规则,每个QC事件有1个控制测量值,误差检出率为0.90(Ped=0.90),假失控率为0.05或5%(Pfr=0.05);(6)SR1w2.5s表示为12.5s单规则,每个QC事件有1个控制测量值,误差检出率为0.82(Ped=0.82),假失控率为0.01或1%(Pfr=0.01);(7)1∶3s N1表示13s单规则,每个QC事件有1个控制测量值,误差检出率为0.66(Ped=0.98),假失控率为0.00或1%(Pfr=0.00)。
1.4.2制定SQC策略并运行质控 在Ped≥0.90同时Pfr≤0.05前提下制定SQC策略,确认质控规则、质控运行数量(N)和最大预期样本运行量。根据制定的SQC策略进行质控运行,以1周为单位的运行数据绘制出每个项目1周的Levey-Jennings(L-J)Z分数质控图。
2 结果
2.1西格玛度量运行大小诺曼图 结果见图1。
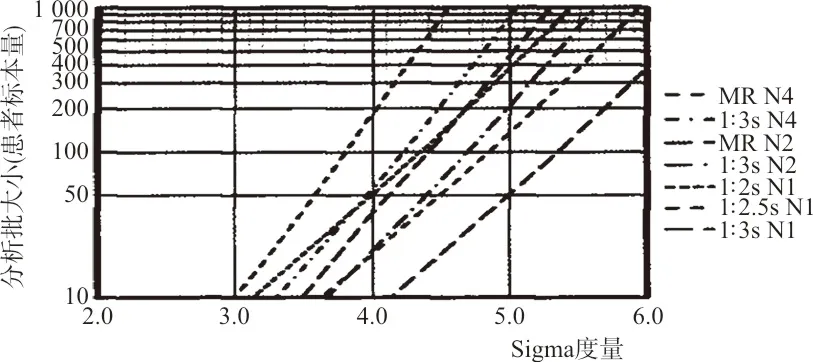
注:X轴代表Sigma度量,虚线代表不同的SQC程序;Sigma度量作垂直线与SQC程序线交叉点确定QC规则和QC测定的个数;交叉点对应Y轴上的值即样本分析批大小或QC频率。 MR,多规则;N,质控测量数量。
2.2各生化项目的σ值、SQC策略及L-J Z分数质控结果 22项生化项目的σ值结果见表1,为每个项目制定SQC策略见表2,按照制定的SQC策略在实验室内进行实际运行,以每项的质控数据绘制出1周的Levey-Jennings(L-J)Z分数质控图(图2、3)。
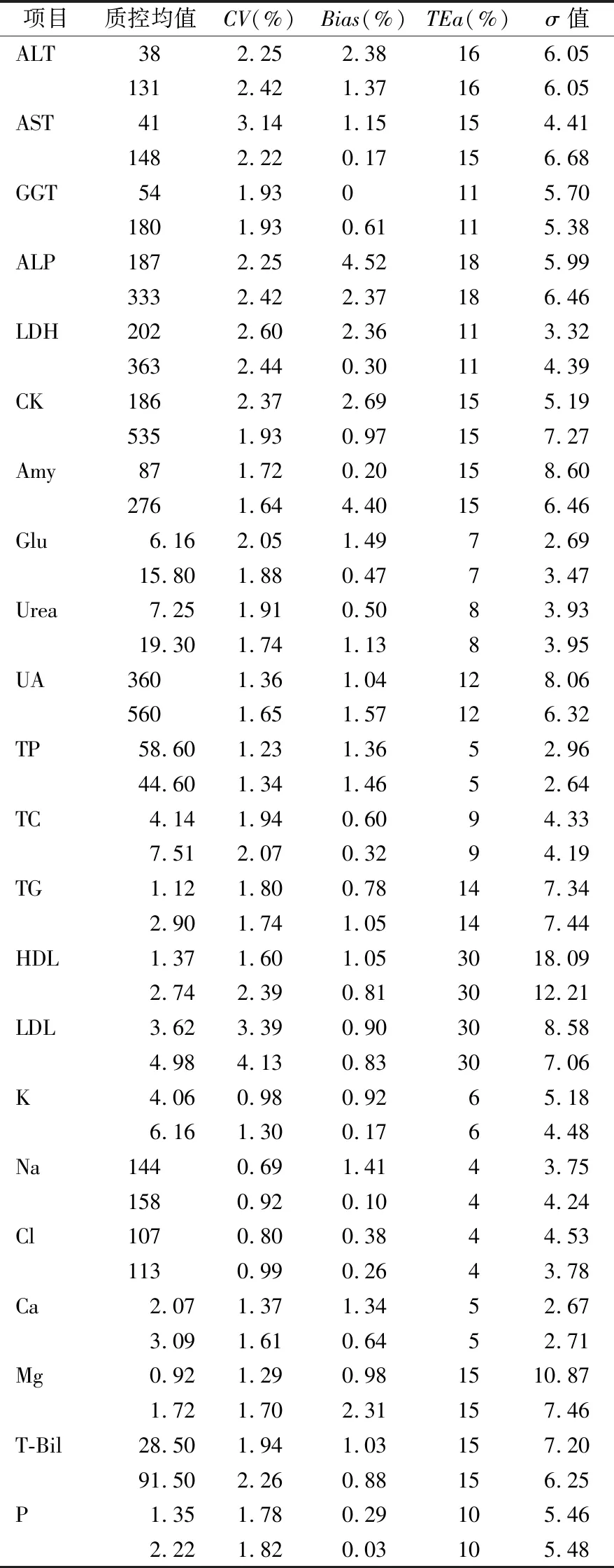
表1 22项生化项目2个水平质控的σ值
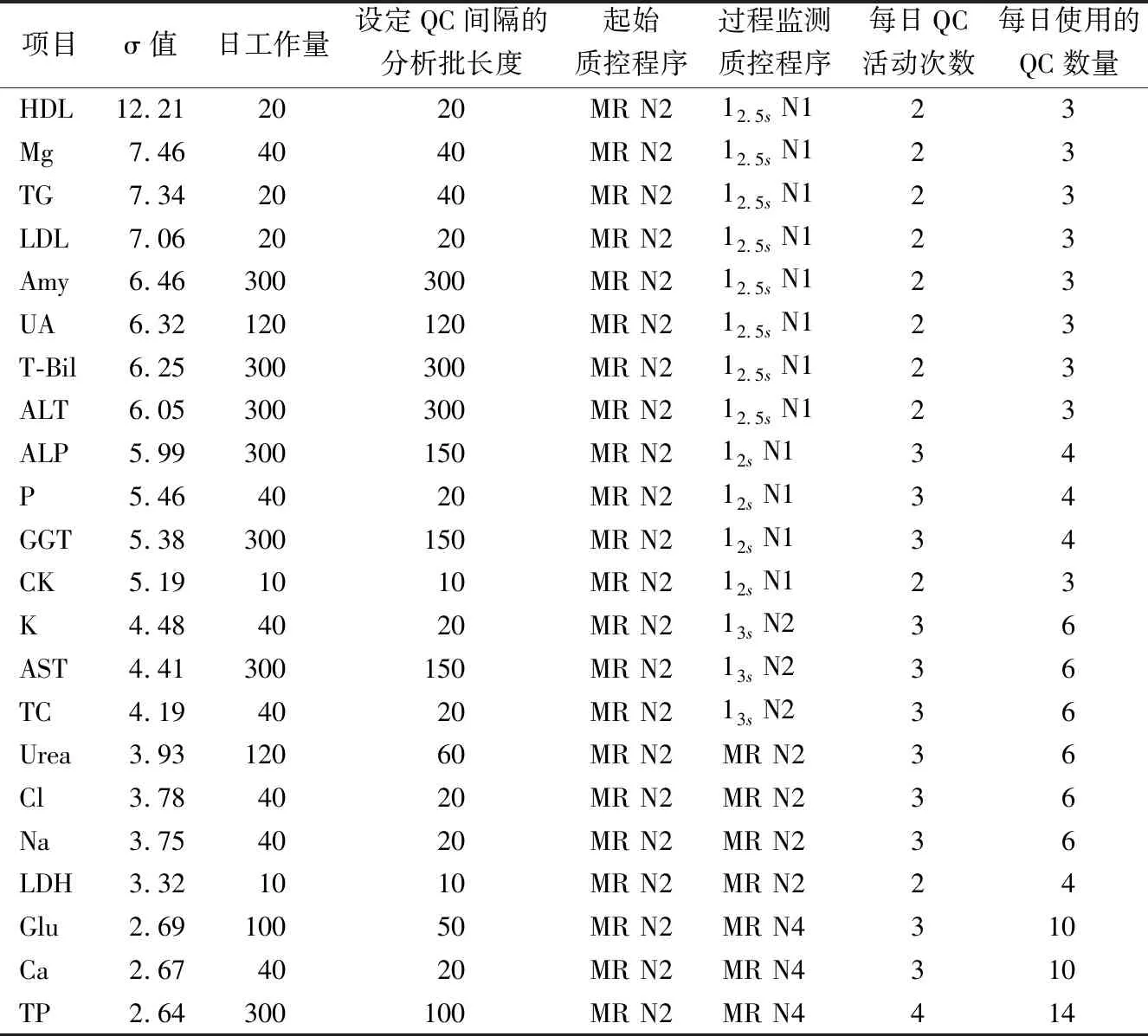
表2 22项生化检测项目SQC策略

注:A,HDL;B,Mg;C,TG;D,LDL;E,Amy;F,UA;G,T-Bil;H,ALT;I,ALP;J,P;K,GGT;L,CK;X轴为1周所运行的质控次数,Y轴为每次质控数据的Z分数;蓝色标记线C1为批号1255UN质控,红色标记线C2为批号946UE质控。

注:A,AST;B,K;C,TC;D,Urea;E,Cl;F,Na;G,LDH;H,Glu;I,Ca;J,TP。X轴为1周所运行的质控次数,Y轴为每次质控数据的Z分数;蓝色标记线C1为批号1255UN质控,红色标记线C2为批号946UE质控。
3 讨论
C24-Ed4指南则是基于Parvin,s MaxE(Nuf)[5]患者风险参数估计来选择SQC策略的方法。Yago等[6]和Hassan等[7]将Westgard的σ与Parvin,s MaxE(Nuf)方法结合起来确定了西格玛度量运行大小工作计量图,该图将西格玛度量、控制规则、控制检测数量和分析批长度(样本运行量)联系起来。Ped和Pfr是质量控制的性能特征,Sigma值是一种性能度量,是制定合适SQC中的评价指标,可以帮助实验室表现检测系统的分析性能[8]。本实验室实际执行了SQC策略后,用1周的运行数据为每个项目绘制出了Z分数L-J质控图。HDL、Mg、TG、LDL、Amy、UA、T-Bil、ALT这8个项目用了最少的质控规则和质控运行数量,在监测过程中的分析性能优秀,没有失控点出现。ALP、P、GGT、CK、K、AST、TC这7个项目缩短了分析批长度,使用了较严格的质控规则。1周的过程监控中,ALP、GGT、CK这3个项目有1次失控,P、K、AST、TC没有出现失控点。Urea、Cl、Na、LDH、Glu、Ca、TP这7个项目则使用的更短的分析批长度和更多的质控规则控制,Urea、Cl、Glu出现了1次失控点,Ca有2次失控点,TP出现了3次失控点。同时从图中可知一些项目出现了明显的系统偏移,如UA、P、GGT、AST、TC、LDH、Glu这7个项目均出现了系统偏移,对于高Sigma值项目即使出现了明细系统偏差,质控监测仍然在控,检测结果准确性得到了保证;而对于低Sigma值的Glu项目,一旦系统开始出现偏移,很快就反映出失控。当Sigma值低于3.0时,根据Parvin,s MaxE(Nuf)风险参数的计算,将会有高的错误的患者结果风险,即使用了更大的Ns和更多的规则程序,也没有办法实现最优的SQC,此时仍不保证患者风险得到了有效的控制。因此改善和提高检测项目的方法性能,得到良好的σ值,才能实现最佳的SQC策略。
从SQC策略的实际运用来看,对于分析性能差的项目实际监控意义更大,在短分析批中可以及时发现失控,降低了患者检测结果的错误风险。同时在实际应用中,实验室可以根据应用结果来制定每个检测项目的最优SQC策略。如在本实验室中,对于ALP、P、GGT、CK、K、AST、TC这几个性能优秀的项目起始质控可以选用更少的质控规则12.5s N1或13s N1;对于Urea、Cl、Na等,虽然属于低Sigma值项目,但是在实际应用中发现分析性能稳定,1周数据里只出现了1个失控点,因此可以适当增加分析批长度,减少质控运行量。总之,实验室运用合适的SQC策略,目的是使实验室在经济成本和错误的患者结果风险上得到双重控制。

