microRNA-873在子宫内膜癌中的表达及对肿瘤细胞增殖和侵袭的影响
黄锦,刘佳淑,刘胜凤,敬巧,刘玉娟
(川北医学院附属医院妇产科,四川南充 637000)
子宫内膜癌(endometrial carcinoma,EC)是女性生殖道中常见的恶性肿瘤之一。早期患者的5年生存率超过90%,而晚期以侵袭性转移的发生和高复发率为特征,因此晚期子宫内膜癌患者的5年生存率降至20%以下[1-2]。近年来研究表明,微小RNA(microRNA)与肿瘤发生关系密切,可参与肿瘤的发生及发展过程中,故而有望成为肿瘤诊断和治疗的新型标志物[3]。miR-873作为一类微小RNA,在食管癌和肝癌中均有不同程度的异常表达[4-5],但其在子宫内膜癌中作用机制的研究报道少见。因此,本研究旨在探讨miR-873在子宫内膜癌组织中的表达及对人子宫内膜癌Ishikawa细胞增殖和侵袭的影响,从而为子宫内膜癌的诊断和治疗提供新的靶点。
1 材料
1.1标本来源 收集2016年1月至2020年1月于川北医学院附属医院就诊的88例子宫内膜癌患者手术切除的子宫内膜癌组织,患者年龄(49.7±10.0)岁。纳入标准[6]:经病理检查证实为子宫内膜癌;术前未接受化疗及放疗。排除标准:合并其他恶性肿瘤患者。临床资料中肌层浸润深度:≥1/2肌层22例,<1/2肌层66例;伴淋巴结转移18例,其中累及淋巴管15例;国际妇产科联盟(FIGO)分期:Ⅰ~Ⅱ期66例,Ⅲ~Ⅳ期22例;组织学类型:Ⅰ型78例,Ⅱ型10例;分化程度:低分化34例,中高分化54例。另收集同期因子宫肌瘤行子宫切除术的60例患者正常子宫内膜组织作为对照组,患者年龄(50.6±9.8)岁。两组年龄差异无统计学意义(t=0.566,P>0.05),具有可比性。本研究经川北医学院附属医院医学伦理学委员会批准(No.2015ER117-1),患者及家属知情同意。
1.2细胞系、主要试剂及仪器 人子宫内膜癌细胞系Ishikawa(武汉博士德公司)。DMEM、胎牛血清、DMSO、100 U/mL青霉素、100 μg/mL链霉素、胰蛋白酶(美国Gibco公司),miRNA提取试剂盒、miRNA荧光定量PCR检测试剂盒、miRNA cDNA合成试剂盒(大连宝生物公司),MTT试剂(上海东仁化学科技公司),结晶紫(美国Sigma公司),Matrigel(美国BD公司),细胞转染试剂Lipofectamine 2000(美国Epitomics公司),miR-873模拟物(miR-873 mimic)及模拟物阴性对照(miR negative control,miR-NC,广州市锐博公司)。Transwell小室(美国Millipore公司),ACB-4A1超净工作台(新加坡Esco公司),3110型CO2培养箱(美国Thermo公司),QuantStudioTM12K Flex实时荧光定量PCR(美国Life technologies公司),SpectraMax M5酶联仪(美国Molecular device公司),IX71正置/倒置荧光显微镜(日本Olympus公司)。
1.3方法
1.3.1细胞分组与转染 将Ishikawa细胞加入至含10%胎牛血清的DMEM中,置于37 ℃、5%CO2细胞培养箱中培养。于转染前1 d接种于6孔细胞培养板,待细胞融合度达30%~50%时,利用Lipofectamine 2000将miR-873 mimic和阴性对照(miR-NC)瞬时转染至子宫内膜癌Ishikawa细胞,并分为空白对照组、阴性对照组和miR-873过表达组。其中,空白对照组:细胞不做处理,正常培养;阴性对照组:按照Lipofectamine 2000说明书将miR-NC转染至Ishikawa细胞,转染终浓度为50 nmol/L,每孔转染2 mL;miR-873过表达组:按照Lipofectamine 2000说明书将miR-873 mimic转染至Ishikawa细胞,转染终浓度为50 nmol/L,每孔转染2 mL。转染6 h后更换为含10%胎牛血清培养基继续培养24 h并进行后续实验。
1.3.2实时荧光定量PCR(qRT-PCR) 取大小约为0.5 cm×1.0 cm的子宫内膜癌组织和正常子宫内膜组织,于液氮中进行充分研磨,另取各组转染后细胞约1×106个,采用miRNA提取试剂盒提取组织及细胞中miRNA,使用SpectraMax M5酶联仪检测吸光度(A260/280 nm)值为1.8~2.1的样本用于后续实验。取2 μL miRNA,按照miRNA cDNA合成试剂盒说明书操作获得cDNA,置于-20 ℃保存。根据NCBI中GenBank提供的miR-873(序列号:NC_000009.12),U6(序列号:NC_000898.1)基因序列,由上海生工公司设计并合成引物。采用miRNA荧光定量PCR检测试剂盒检测组织及细胞中miR-873的表达水平,引物序列见表1。PCR反应体系共20 μL,包括:5×Golden HS SYBR Green qPCR Mix 4 μL,10 μmol/L上、下游引物各1 μL,cDNA 2 μL,ddH2O 12 μL。循环参数:95 ℃预变性15 min;95 ℃ 5 s,60 ℃ 30 s,共40个循环;在60 ℃时采集荧光信号,并用QuantStudioTM12K Flex实时荧光定量PCR自带软件进行熔解曲线分析,以U6作为内参照,采用2-△△Ct法计算miR-873的表达水平。
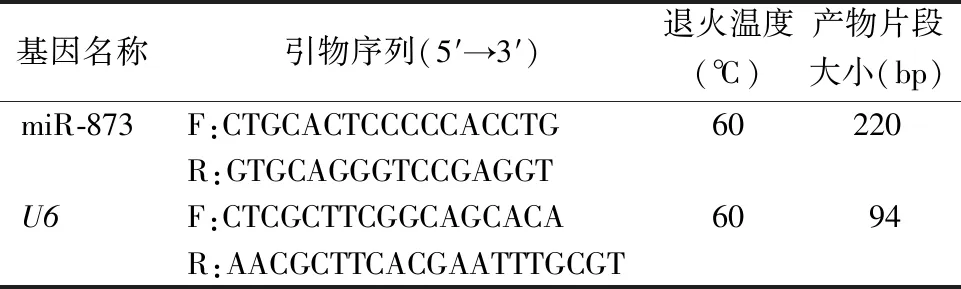
表1 引物序列
1.3.3MTT法检测细胞的增殖能力 采用12.5 g/L胰蛋白酶将各组细胞消化并接种于96孔细胞培养板中(按3 000个/孔的细胞密度接种),每孔培养液总体积为100 μL,置于37 ℃、5%CO2培养箱中培养,待其贴壁,更换为新的DMEM培养基,每孔加入混有10% MTT检测试剂的培养液,37 ℃温育1 h,从培养箱取出96孔细胞培养板室温平衡后分别于24 h、48 h、72 h和96 h时,采用SpectraMax M5酶联仪在波长490 nm处检测各孔吸光度(A490 nm)值,计算平均值,实验重复3次。
1.3.4Transwell试验检测细胞的侵袭能力 取各组转染后的Ishikawa细胞,用不含血清的DMEM培养基重悬,调节细胞密度为1×106/mL,接种于Transwell小室的上室中,在小室下室加入300 μL含胎牛血清的DMEM,37 ℃温育24 h。用无菌棉签轻轻擦拭上室中的上层细胞,擦拭干净后用0.2%结晶紫染色10 min,弃去染液,PBS清洗5 min,置于光学显微镜下观察并拍照,计数穿膜细胞数,实验重复3次。
2 结果
2.1子宫内膜癌组织和正常子宫内膜组织中miR-873的表达水平 与正常子宫内膜组织(1.07±0.04)比较,子宫内膜癌组织中miR-873的表达水平(0.52±0.12)明显降低,差异具有统计学意义(t=34.199,P<0.05)。
2.2miR-873表达与子宫内膜癌患者临床病理参数的关系 子宫内膜癌患者癌组织中miR-873的表达水平与肌层浸润深度、淋巴结转移和FIGO分期有关(t分别为11.557、9.626、7.923,P均<0.05);而与年龄、分化程度、组织类型无关(t分别为0.407、0.381、0.536,P均>0.05),见表2。
表2 miR-873表达与子宫内膜癌患者临床病理参数的关系
2.3qRT-PCR检测各组细胞miR-873的表达水平 与空白对照组(0.51±0.02)和阴性对照组(0.51±0.01)比较,miR-873过表达组中miR-873的表达水平(1.38±0.02)明显升高,差异具有统计学意义(F=5 855.962,P<0.05),提示转染成功;进一步行组间两两比较结果显示,miR-873过表达组miR-873的表达水平显著高于空白对照组和阴性对照组,差异具有统计学意义(t分别为93.985、93.448,P均<0.05),而阴性对照组和空白对照组之间比较差异无统计学意义(t=0.537,P>0.05)。
2.4MTT法检测各组Ishikawa细胞的增殖能力 与空白对照组和阴性对照组比较,转染24 h后miR-873过表达组细胞增殖受到抑制,差异具有统计学意义(P均<0.05);进一步行组间两两比较结果显示,miR-873过表达组在24 h、48 h、72 h和96 h时的细胞增殖水平显著低于空白对照组(t分别为5.908、15.995、19.913、30.242,P均<0.05)和阴性对照组(t分别为5.514、14.715、19.048、28.542,P均<0.05),差异具有统计学意义;而阴性对照组和空白对照组各时间点之间比较差异无统计学意义(t分别为0.394、1.280、0.866、1.699,P均>0.05)。见图1。
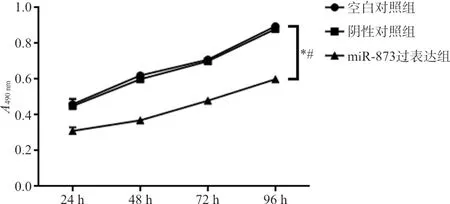
注:与空白对照组比,*,P<0.05;与阴性对照组比,#,P<0.05。
2.5Transwell试验检测各组细胞的侵袭能力 各组细胞于转染24 h后行Transwell试验,结果表明,与阴性对照组和空白对照组比较,miR-873过表达组细胞穿膜数显著降低,差异具有统计学意义(F=36.553,P<0.05);进一步行组间两两比较结果显示,miR-873过表达组细胞穿膜数显著低于空白对照组和阴性对照组,差异具有统计学意义(t分别为7.571、7.227,P均<0.05),而阴性对照组和空白对照组之间比较差异无统计学意义(t=0.344,P>0.05)。见图2。
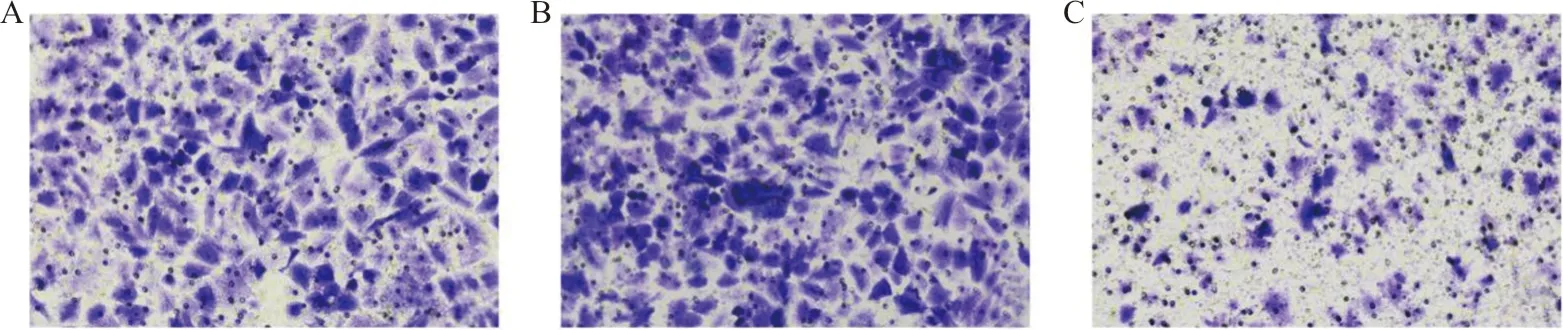
注:A,阴性对照组;B,空白对照组;C,miR-873过表达组。
3 讨论
研究表明,结肠癌[7]、肝细胞癌[8]、非小细胞肺癌[9]等恶性肿瘤中miR-873的表达均降低,提示其在肿瘤发生和发展中起着至关重要的作用。Lin等[10]研究发现,miR-873在原发性胃癌组织中下调,在胃癌进展过程中起到肿瘤抑制作用。本研究结果表明,子宫内膜癌组织中miR-873的表达水平与正常子宫内膜组织相比显著降低,提示miR-873可能在子宫内膜癌进展过程中发挥抑癌基因的功能。进一步对miR-873的表达水平与子宫内膜癌患者临床病理参数进行分析,结果发现miR-873低表达与肌层浸润深度、淋巴结转移和国际妇产联合会FIGO分期有关。肌层浸润深度≥1/2肌层、伴淋巴结转移以及FIGO分期为Ⅲ~Ⅳ期的子宫内膜癌患者组织中miR-873的表达水平显著低于肌层浸润深度<1/2肌层、无淋巴结转移以及Ⅰ~Ⅱ期的子宫内膜癌患者组织,提示miR-873低表达可能促进子宫内膜癌患者病情的进展。
miRNA广泛存在于真核生物中,在细胞分化、细胞周期、迁移等生理和病理过程中发挥着关键作用[11]。Wang等[12]研究发现,miR-873-5p在甲状腺癌组织和细胞系中表达下调,过表达miR-873-5p可抑制甲状腺癌细胞的增殖、迁移和侵袭。Liang等[13]研究表明,miR-873在宫颈癌组织中呈低表达;miR-873的上调明显抑制了人宫颈癌C33a细胞的增殖、侵袭和迁移,但在SiHa细胞中下调的miR-873呈现相反的结果。为探讨miR-873对子宫内膜癌细胞增殖、侵袭的影响,本研究采用Lipofectamine 2000将miR-873 mimc瞬时转染至子宫内膜癌Ishikawa细胞,结果显示miR-873过表达组miR-873表达水平明显增加,提示转染成功。笔者进一步通过增殖与侵袭试验检测Ishikawa细胞增殖和侵袭能力,结果显示miR-873过表达组细胞增殖和侵袭能力明显减弱,提示过表达miR-873能明显抑制Ishikawa细胞增殖和侵袭能力。
综上所述,miR-873在人子宫内膜癌组织中呈低表达,通过上调miR-873表达可抑制Ishikawa细胞增殖和侵袭的能力,初步明确miR-873在子宫内膜癌中发挥抑癌基因的作用。但本研究仍存在以下不足之处:(1)本研究中的临床样本较少,且未进行预后分析;(2)本研究只是初步明确miR-873在子宫内膜癌中发挥抑癌基因的作用,没有进行靶基因的预测及相关机制研究;(3)本次实验只是在体外细胞实验中进行验证,没有进行体内动物实验,后续应进行体内动物实验进行验证,进一步完善miR-873对子宫内膜癌发生、发展的作用机制。

