原始小球藻AP2转录因子的生物信息学分析
付春 唐易 江纳 杨瑶君

摘 要:為了揭示原始小球藻AP2基因家族编码蛋白的理化特性、分子功能和遗传进化特征,该文对原始小球藻AP2基因家族的蛋白成员进行了详细的生物信息学预测和分析,并利用PrtoParam、Pfam 3.20、Protscale等在线工具分析了原始小球藻AP2家族所包含的8个蛋白成员。结果表明:该家族成员含有的氨基酸数为247 (XP_011395646.1)到715 (XP_011401904.1),理论等电点最大为9.39 (XP_011396011.1)、最小为5.81 (XP_011398158.1);家族中各个成员所含有的保守结构域的位置和数量都各不相同;所有蛋白成员均无信号肽,均不包含跨膜螺旋,不具有跨膜区域;蛋白成员中最大亲水性值为-3.222 (XP_011398158.1),最大疏水性值为2.333 (XP_011401904.1),且所有成员的平均亲疏水性值均小于0;成员中有多个磷酸化位点值远超标准值0.5,最大磷酸化位点值为0.998;该基因家族的蛋白成员二级结构的组分含量从大到小排序均为无规则卷曲>α-螺旋>延伸链>β-转角,推测α-螺旋和无规则卷曲是其二级结构的主要方式,延伸链和β-转角则分散在所有蛋白成员的氨基酸链中;所有成员的三级结构分析中均能观察到α-螺旋、β-折叠、β-转角以及N端和C端;系统进化分析结果表明,在其余15个物种中,与原始小球藻亲缘关系最远的是金牛介球菌(Ostreococcus tauri),亲缘关系最接近的是小球藻(Chlorella variabilis NC64A)和螺旋孢子虫(Helicosporidium),较接近的是苦参3号(Picochlorum sp.SENEW3)。该研究较系统地分析了原始小球藻AP2蛋白家族的理化特性、保守基序及系统进化关系,为进一步研究原始小球藻AP2转录因子功能和互作关系提供一定参考依据。
关键词:原始小球藻, AP2转录因子, 生物信息学
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2020)12-1800-16
Abstract:In order to reveal the physicochemical properties, molecular functions and genetic evolution characteristics of AP2 gene family encoded proteins in Auxenochlorella protothecoides, in this study, the protein members of AP2 gene family in A.protothecoides are predicted and analyzed in detail by bioinformatics.Eight protein members of the AP2 family of A.protothecoides were analyzed by online tools such as PrtoParam, Pfam 3.20 and Protscale and so on.The results were as follows:Amino acids numbers of the family members were 247(XP_011395646.1) to 715(XP_011401904.1), the maximum theoretical isoelectric point was 9.39(XP_011396011.1), and the minimum was 5.81(XP_011398158.1); The positions and numbers of conserved domains in each member of the family were different; All protein members had no signal peptide, did not contain transmembrane helix, and did not have transmembrane region; The maximum hydrophilicity value of the protein members was -3.222(XP_011398158.1), and the maximum hydrophobicity value was 2.333(XP_011401904.1), and the average hydrophilicity/hydrophobicity values of all members were less than 0; The values of many phosphorylation sites in the members were far beyond the standard value of 0.5, and the maximum value of phosphorylation site was 0.998; The component content of secondary structures of protein members in the gene family was arranged in the order of random coil > alpha-helix > extended strand > β-turn; and it is speculated that alpha-helix and random coil are the main modes of its secondary structure, while extended strand and β-turn are dispersed in the amino acid chain of all protein members; Alpha-helix, β-sheet, β-turn, N-terminal and C-terminal were observed in tertiary structure of all members; Phylogenetic analysis showed that Ostreococcus tauri was the most distant relative to Auxenochlorella protothecoides, the closest relatives were Chlorella variabilis NC64A and Helicosporidium, and the next closest relatives were Picochlorum sp.SENEW3 among the other 15 species.This study systematically analyzed the physicochemical properties, conserved motifs and phylogenetic relationships of AP2 protein family in Auxenochlorella protothecoides.It provides a reference for further study on the function and interaction of AP2 transcription factors in A.protothecoides.
Key words:Auxenochlorella protothecoides, AP2 transcription factor, bioinformatics
原始小球藻(Auxenochlorella protothecoides)是一种生长周期短,易培养,可利用光能光合作用进行自养,又能利用有机碳源进行异养培养积累油脂,高附加值产物丰富的微藻(汪桂林,2013),它被认为是生物柴油最具潜力的原料之一(桂小华,2017)。原始小球藻生长周期短、适应性强、光合效率和含油量高、单位面积产量高,现已被作为生物柴油方面主要能源藻种加以研究开发(汪桂林等,2013)。AP2是植物所特有的转录因子家族之一,起到调控植物生长发育的转录以及逆境胁迫等生理过程的作用(栗丽和佟少明,2016)。Jofuku(1994)从模式植物拟南芥(Arabidopsis thaliana)中分离了第一个AP2基因,且该基因与花发育有关(张计育等,2012),其后又在原核生物和蓝藻中发现了相同的转录因子(张麒等,2018),证实该转录因子不止只存在于植物中。在不同的植物中含有的AP2/ERF 类转录因子基因家族成员数量是不同的(Riccardo et al., 2010),转录因子AP2/ERF主要特征是具有高度保守的约60~70个氨基酸组成的AP2结构域(闻可心和刘雪梅,2010),这是植物转录因子家族之一,其家族成员均包含保守AP2结构域,人们根据保守结构域的数量和识别成员的不同,通常情况下,将AP2/ERF家族划分为不同的4个转录因子亚家族,分别是AP2、ERF、DREBP、RAV和单独成员Soloist(张麒等,2018)。转录因子AP2基因家族在植物生长发育中起重要作用,它能调控植物的细胞周期、生长发育以及生物和非生物胁迫相关基因的表达(吴丽娟等,2016;郭慧等,2017),也能调控自身生殖器官(花、胚珠和种子)的生长发育(张妍和孙丰宾,2011;王莉莉,2016),而且与其他因子相互协作,参与到复杂的花发育調控网络(刘杨,2009)。虽然关于藻类AP2基因家族的研究较多,但是未见关于原始小球藻AP2转录因子的生物信息学分析的报道。本研究通过分析原始小球藻的AP2转录因子编码蛋白的理化特性、亲疏水性、跨膜域、保守结构域、保守基序、亚细胞定位以及AP2转录因子在不同物种中的进化起源关系,为进一步研究原始小球藻AP2基因家族的生物学功能奠定一定的理论依据。
1 材料与方法
1.1 材料
从plantTFDB (http://planttfdb.cbi.pku.edu.cn/)数据库中下载原始小球藻(Auxenochlorella protothecoides)AP2基因家族中所有成员的蛋白序列和岩藻(Bathycoccus prasinos)、莱茵衣藻(Chlamydomonas reinhardtii)、小球藻(Chlorella variabilis NC64A)、胶球藻(Coccomyxa subellipsoidea C-169)、盐生杜氏藻(Dunaliella salina)、胸状盘藻(Gonium pectorale)、螺旋孢子虫(Helicosporidium)、细小微胞藻(Micromonas pusilla CCMP1545)、微单胞藻(Micromonas sp.RCC299)、深蓝单壳缝藻(Monoraphidium neglectum)、透明介球菌(Ostreococcus lucimarinus)、介球菌(Ostreococcus sp.RCC809)、金牛介球菌(Ostreococcus tauri)、苦参3号(Picochlorum sp.SENEW3)以及团藻(Volvox carteri)等物种的AP2成员蛋白序列。对原始小球藻的AP2所有成员的蛋白质序列进行详细的生物信息学分析,且将原始小球藻与岩藻(Bathycoccus prasinos)等16个物种AP2蛋白进行同源序列比对分析并构建进化树,探究16个物种间的进化起源关系。
1.2 方法
1.2.1 AP2转录因子基因的蛋白成员的一级结构和理化性质分析 用在线程序PrtoParam (https://web.expasy.org/protparam/)对原始小球藻AP2转录因子蛋白成员的一级结构和理化性质进行分析,包括了蛋白成员氨基酸数目、理论pI、分子量、带负电氨基酸残基、带正电氨基酸残基、不稳定系数、脂肪指数、亲疏水性、分子式、原子总数等方面(韩长志和王娟,2016)。通过在线程序Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bioinf/ Cell-PLoc-2/)对原始小球藻AP2转录因子的8个蛋白成员进行亚细胞定位分析(徐志军等,2019),参数设置:物种选择为真核生物。
1.2.2 氨基酸的保守结构域、跨膜结构及信号肽分析 用Pfam 3.20 (http://pfam.xfam.org/)对原始小球藻的蛋白成员进行保守结构域预测(张海燕等,2013),统计分析蛋白成员氨基酸保守结构域的个数及位置。在TMHMM Severv.2.0 (http://www.cbs.dtu.dk/ services/TMHMM/)在线程序中输入AP2转录因子基因蛋白成员,分析跨膜螺旋的数量以及跨膜结构的区域,确定基因蛋白成员是否具有跨膜区域,判断是否为跨膜蛋白。用SignaIP3.0 Server(http://www.cbs.dtu.dk/services/SignalP-3.0/)对原始小球藻蛋白成员进行信号肽分析(柳燕等,2017)。
1.2.3 氨基酸的亲疏水性和磷酸化位点预测分析 用Protscale (https://web.expasy.org/protscale/)在线工具,对该转录因子基因蛋白成员进行亲疏水性预测分析,确定最大亲水值和最大疏水值及其相对应的位置,判断该基因蛋白成员为亲水蛋白还是疏水蛋白。用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)在线程序对转录因子基因蛋白成员进行潜在磷酸化位点预测分析,并统计磷酸化位点种类和数量。
1.2.4 编码蛋白的二级结构和三级结构预测分析 用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线程序对该转录因子蛋白成员的二级结构进行预测分析,统计该蛋白成员中α-螺旋、无规则卷曲、延伸链和β-转角相对应的百分比。通过同源建模法,利用SWISS-MODEL (https://www.swissmodel.expasy.org/)在线工具(Schwede et al., 2003),对该蛋白家族的三级结构进行预测分析,确定其三级结构的组成和构象变化。
1.2.5 保守基序分析 用MEME7.0 (http://meme-suite.org/)在线工具对原始小球藻AP2转录因子的蛋白成员进行保守基序motif分析,参数设置:motif数目为10个,其余参数设为默认值。
1.2.6 同源性分析及进化树分析 在plantTFDB (https://web.expasy.org/protparam/)在线程序中,将原始小球藻的8个成员序列,分别和同为绿藻门下的其余15个物种AP2基因家族的蛋白成员进行同源序列的对比,找到相对应的其余物种的同源序列,并归纳。用MEGA7.0 (Tamura et al., 2011)软件中的ClustalW功能对原始小球藻AP2转录因子所有成员蛋白对应的序列组,分别进行多重比对并邻接法构建其系统进化树(李建伏等,2008),对比8个蛋白成员的同源序列的差距,判断各个物种与原始小球藻之间的亲缘关系。
2 结果与分析
2.1 AP2转录因子基因成员的一级结构和理化性质分析
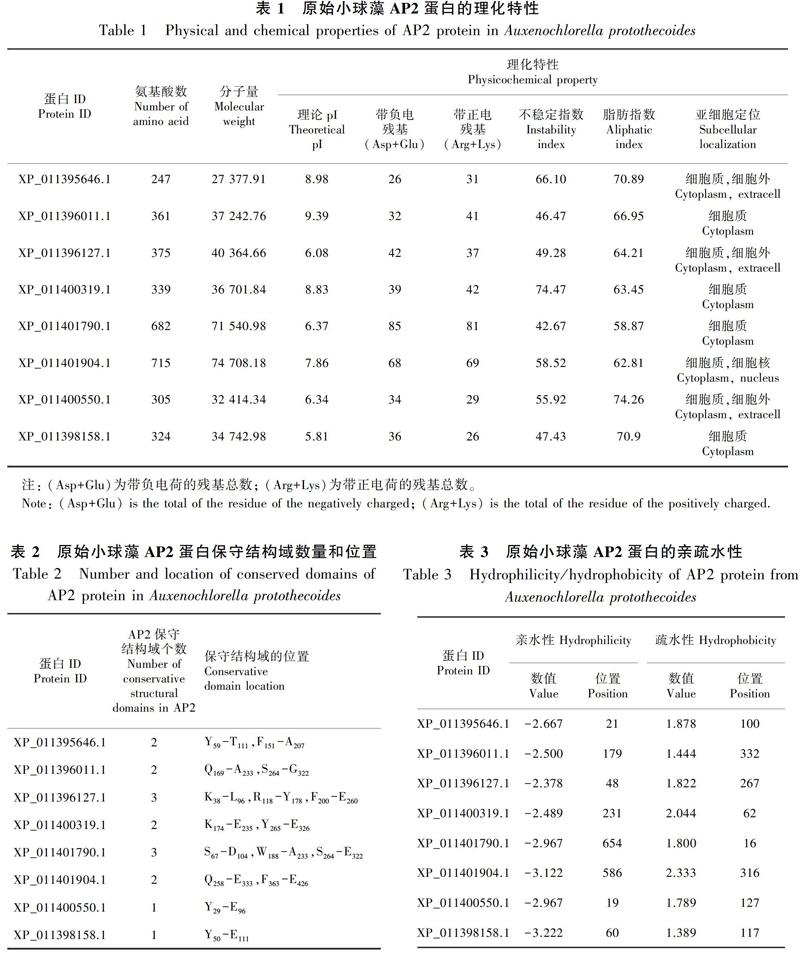
由表1可知,原始小球藻AP2转录因子蛋白家族含有8个成员,该蛋白家族氨基酸数目范围为247~715;等电点范围为5.81(XP_011398158.1)~9.39(XP_011396011.1),其中,XP_011395646.1、XP_011396011.1、XP_011400319.1和XP_011401904.1,理论等电位点>7,为碱性氨基酸,XP_011396127.1、XP_011401790.1、XP_011400550.1和XP_011398158.1,理论等电位点<7,为酸性氨基酸;该家族成员带负电氨基酸残基数目范围为26(XP_011395646.1)~85(XP_011401790.1);该家族成员带正点氨基酸残基数目范围为26(XP_011398158.1)~81(XP_011401790.1);不稳定指数均大于40(不稳定系数<40时稳定)(夏巧玉,2007),推断为不稳定蛋白;脂肪指数范围为58.87(XP_011401790.1)~74.26(XP_011400550.1);原始小球藻AP2蛋白成员进行的亚细胞定位分析中显示该家族全部成员的亚细胞都可定位于细胞质(Cytoplasm),其中4个蛋白成员:XP_011396011.1、XP_011400319.1、XP_011401790.1和XP_011398158.1的亚细胞只定位于细胞质(表1)。通过氨基酸组成分析可知,在所有蛋白成员中,除了XP_011396011.1(氨基酸的最大含量为甘氨酸15.80%)和XP_011398158.1(氨基酸的最大含量为亮氨酸11.10%)两个蛋白家族成员外,其余六个蛋白家族成员含量最高的氨基酸均为丙氨酸,丙氨酸含量最高的成员为XP_011400550.1(19.70%),含有丙氨酸数为60,丙氨酸含量最低的成员为XP_011400319.1(11.2%),含有丙氨酸数为38(图1)。
2.2 氨基酸保守结构域、信号肽和跨膜域结构分析
蛋白成员中,不同基因蛋白成员的AP2保守结构域的数量和位置各不相同,其中XP_011396127.1(K38-L96,R118-Y178,F200-E260)和XP_011401790.1(S67-D104,W188-A233,S264-E322)两个成员各含3个保守结构域;XP_011398158.1(Y50-E111)和XP_011400550.1(Y29-E96)两个成员中各自都只含有1个氨基酸保守结构域;余下的XP_011395646.1(Y59-T111,F151-A207)、XP_011396011.1(Q169-A233,S264-G322)、XP_011400319.1(K174-E235,Y265-E326)和XP_011401904.1 (Q258-E333,F363-E426)4个成员,均包含2个保守结构域。保守结构域跨度最大成员是XP_011401904.1(Q258-E333),其氨基酸数量达75个,蛋白成员XP_011401790.1(S67-D104)中保守结构域跨度最小,其氨基酸数量为37个(表2,图2)。各个蛋白成员的位置和跨度都各不相同,但却有相似,如XP_011395646.1、XP_011400319.1和XP_011401904.1这3个成员就含有相似之处(图2)。信号肽分析表明原始小球藻AP2蛋白均不存在信号肽,属于非分泌型蛋白。TMHMM跨膜域结构分析表明原始小球藻所有蛋白成员均不含跨膜结构域,推断该蛋白为非跨膜蛋白。
2.3 氨基酸亲疏水性预测分析
在这8个蛋白家族成员中,氨基酸疏水性的最大值达到了2.333 (XP_011401904.1),疏水性最小值为1.389 (XP_011398158.1);氨基酸亲水性最大值达到了-3.222 (XP_011398158.1),亲水性最小值为-2.378 (XP_011396127.1)。该家族成员XP_011401904.1的氨基酸亲疏水性差值最大,达到了5.455,对应平均亲水指数(GRAVY)为-0.394 5,其第316位氨基酸表现最大疏水性为2.333,第584、585、586、588、589位氨基酸均表現最大亲水性为3.122。所有的AP2蛋白家族成员中的平均亲水指数均小于0,所以该蛋白亲水性更强,推断该原始小球藻AP2转录因子蛋白为亲水
2.4 磷酸化位点分析
经分析发现,在阈值为0.5时,原始小球藻AP2转录因子蛋白成员中潜在的磷酸化位点最多的是XP_011401790.1 (77),潜在磷酸化位点最少的是XP_011400550.1 (24)。将同种氨基酸对比分析,在整个家族中,潜在位点为丝氨酸(S)数量最多的是XP_011401790.1,达到了49个位点,数量最少的是XP_011395646.1和XP_011400550.1两个成员,均含有17个位点;潜在位点为苏氨酸(T)数量最多的是XP_011401790.1,达到了24个位点,数量最少的是XP_011400550.1,仅含有4个位点;潜在位点为络氨酸(Y)数量最多的是XP_011396011.1和XP_011401904.1,都达到了5,数量最少的是XP_011398158.1,仅1个位点(表4)。在第4个分支XP_011400319.1中,第164位、第218位的苏氨酸,第142位、第160位丝氨酸以及第268位络氨酸可能是潜在的磷酸化位点,其中最有可能是潜在磷酸化位点的是第142位和第160位的丝氨酸,其值均已达到0.998,远超标准值0.5,同时也说明蛋白质可能通过丝氨酸磷酸化位点来实现其功能的调控(表4)。
2.5 原始小球藻AP2转录因子编码蛋白的二级结构和三级结构预测分析
蛋白质的二级结构主要是指蛋白质的多肽链中有规则重复的构象 (曹晨和马堃,2016),在原始小球藻AP2转录因子基因蛋白成员中,二级结构中组分含量从大到小排序均为无规则卷曲>α-螺旋>延伸链>β-转角,其中无规则卷曲和α-螺旋的占比较大,推测其空间结构较小,且受到侧链间相互作用较大的影响(王月,2017)。基因二级结构组分中α-螺旋值最大的是XP_011400550.1,占比达到40.00%,α-螺旋值最小的是XP_011396011.1,其占比为26.04%;该蛋白三级结构组分中延伸链占比最大为XP_011400319.1,达16.22%,其延伸链最小占比为XP_011396127.1,达10.40%;该组分中β-转角值为3.64% (XP_011395646.1)~8.64% (XP_011398158.1);其结构组分中无规则卷曲值为40.00% (XP_011400550.1)~54.55% (XP_011401904.1)(表5)。由此可推断,在原始小球藻AP2基因蛋白成员中α-螺旋和无规则卷曲是二级结构的主要方式,延伸链和β-转角则分散在整个基因蛋白成员的氨基酸链中(表5,图4)。
蛋白质三级结构预测分析表明原始小球藻AP2家族蛋白成员均含有α-螺旋、β-折叠、β-转角以及成员的N端和C端等结构,其中最主要的结构是α-螺旋,其次是β-折叠。且XP_011398158.1、XP_011400550.1和XP_011398158.1的三级结构高度相似,而XP_011400319.1和XP_011400319.1的三级结构也同样高度相似(图5)。
2.6 保守基序MEME分析
通过分析可知,在原始小球藻AP2转录因子家族的8个成员中,motif1只存在于XP_011395646.1和XP_011401904.1中;除XP_011400550.1和XP_011398158.1外,其余6个成员中均含有motif2和motif4;所有成员均包含motif3和motif5;motif6存在于XP_011395646.1和XP_011396011.1中;motif7存在于XP_011396127.1和XP_011398158.1中;motif8存在于XP_011396127.1和XP_011401790.1中;motif9存在于XP_011400319.1、XP_011396127.1和XP_011398158.1中。该家族成员可分为四类,其中XP_011395646.1和XP_011396011.1为一类,都含有motif2、motif3、motif4、motif5、motif6和motif10;第二类是XP_011400319.1和XP_011401904.1, 都含有motif3、motif4和motif5;第三类是XP_011396127.1和XP_011401790.1,都含有motif2、motif3、motif4和motif8;第四类是XP_011400550.1和XP_011398158.1, 都含有motif3和motif5。在原始小球藻AP2蛋白成员中,含有的主要是motif3、motif5(图6,图7)。
2.7 同源性比对及进化树分析
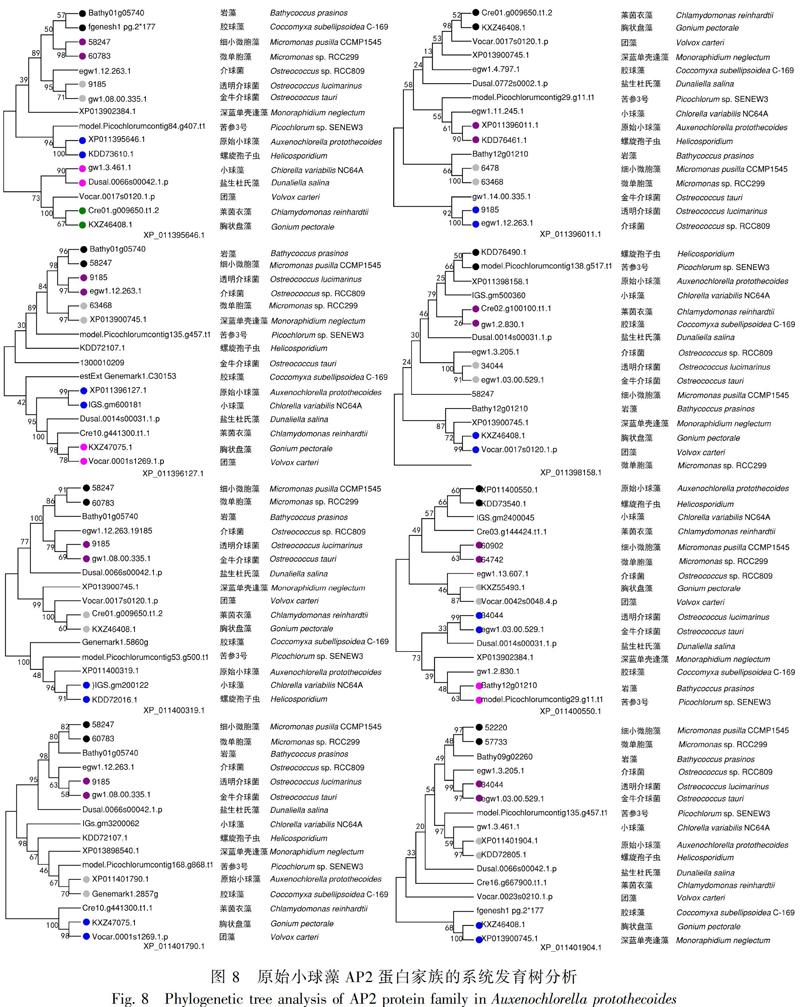
将原始小球藻的8个成员序列分别在plantTFDB在线程序中,与原始小球藻同为绿藻门下的其余15个物种AP2基因家族的蛋白成员进行同源序列的对比,找到相对应的其余物种的同源序列,并分别使用MEGA7.0软件对8个蛋白成员序列组进行系统进化树的构建,对比8个蛋白成员的同源序列的差距,判断各个物种与原始小球藻之间的亲缘关系。在XP_011396127.1和XP_011396011.1两个进化树中亲缘关系最远的是金牛介球菌,在XP_011395646.1进化树中最远的是团藻,在XP_011400319.1进化树中,最远的是盐生杜氏藻,在XP_011401790.1进化树中,最远的是莱茵衣藻,在XP_011401904.1进化树中,最远的是胶球藻,在XP_011400550.1进化树中,最远的是深蓝单壳缝藻,在XP_011398158.1进化树中,最远的是微单胞藻,根据此推断,16个物种中与原始小球藻亲缘关系最远的是金牛介球菌;在XP_011395646.1、XP_011396011.1、XP_011400550.1和XP_011401904.1这4个进化树中都是螺旋孢子虫与原始小球藻的亲缘关系最近,在XP_011396127.1和XP_011398158.1进化树中,亲缘关系最近的是小球藻, 在XP_011401790.1进化树中, 亲缘关系最近的是胶球藻,在XP_011400319.1进化树中亲缘关系最近的是苦参3号。在所有的进化树中,小球藻与原始小球藻亲缘关系在同一大分支中一共有7次,苦参3号有6次,螺旋孢子虫有7次,膠球藻有3次,盐生杜氏藻有1次,莱茵衣藻有2次,深蓝单壳缝藻、胸状盘藻和团藻各有1次,根据此推断,16个物种中与原始小球藻亲缘关系最接近的是小球藻和螺旋孢子虫,较接近的是苦参3号 (图8) 。
3 讨论
通过对原始小球藻AP2基因蛋白成员进行详细的生物信息学分析后,可较详细地了解原始小球藻AP2基因蛋白成员的各种特性。原始小球藻中含有8个家族成员,而在拟南芥(Arabidopsis)中为18个(唐美芳,2007),水稻(Oryza sativa)中为26个(施杨等,2013),玉米中为31个(莫晓婷等,2013)。可见,不同物种的AP2家族蛋白成员数量是不一样的。原始小球藻属于植物界、小球藻科、真核生物(吴丽娟等,2016),在系统进化中最为原始,该蛋白家族成员含有247到715个氨基酸,在其AP2转录因子蛋白成员中,含有多个保守结构域,但是不存在信号肽和跨膜结构域,且AP2蛋白的亲和性平均值均小于0,故其为非分泌、非跨膜、亲水性型蛋白。在原始小球藻的理化性质分析中,AP2家族成员共编码3 348个氨基酸,其中同时存在碱性氨基酸和酸性氨基酸,不稳定系数>40,为不稳定蛋白,而在雷公藤(Tripterygium wilfordii)(祝传书等,2018)、茶树(Camellia sinensis)(吴致君等,2014)和枣(Ziziphus jujube)(纪晴等,2018)中的编码氨基酸同样含有碱性氨基酸和酸性氨基酸、为不稳定蛋白,但茶树含有的碱性氨基酸略多于酸性氨基酸,且蛋白质残基为210~290;而枣的酸性氨基酸多于碱性氨基酸,这与本文研究结果相似。在保守结构域的分析中,不同物种的个数及位置不尽相同:原始小球藻和枣(Ziziphus jujube)(纪晴等,2018)的AP2成员中同样存在3个保守结构域,其中原始小球藻的氨基酸数量跨度最大,达到75,但野生大豆(Glycine soja)(朱延明等,2019)的保守结构域个数只存在两个,其氨基酸数量跨度较大,达到104(209~313)。在亲疏水性分析中,原始小球藻AP2成员蛋白与菠萝 AcPEPC 蛋白(马海洋等,2020)和蔓花生PEPC基因家族(涂嘉琦等,2018)相同,所有蛋白成员均为亲水性蛋白,磷酸化位点分析中,原始小球藻AP2蛋白家族成员含有多个潜在磷酸化位点,最有可能的磷酸化位点为丝氨酸,在蓖麻(Ricinus communis)APs分析中潜在磷酸化位点同样为丝氨酸。在原始小球藻的二级结构分析中,其二级结构的组分含量从大到小排序均为无规则卷曲>α-螺旋>延伸链>β-转角,α-螺旋和无规则卷曲是二级结构的主要方式,延伸链和β-转角则分散在所有蛋白成员的氨基酸链中,在中国樱桃(Chinese cherry)(王月,2017)和甘薯(Dioscorea esculenta)(阮先乐等,2017)中的二级结构占比分布和原始小球藻相同,α-螺旋和无规则卷曲占比最大;但在杨树(Pterocarya stenoptera)(赵金玲等,2015)中,其组分与原始小球藻有所差异,仅以无规则卷曲为主。在三级结构分析中,甘蓝与原始小球藻都能明显观察到α-螺旋和β-折叠,但原始小球藻三级结构家族成员之间结构差异较大,而甘蓝(Brassica oleracea)(郭慧等,2017)和甘薯(Dioscorea esculenta)(阮先乐等,2017)的家族成员三级结构基本相似。在原始小球藻保守基序中,将所有基序一共分为四类,其中所有成员共同含有的是motif3、motif5,这两个可能是参与原始小球藻细胞生长发育和逆境胁迫等多个生理过程有关的功能基序(栗丽和佟少明,2016)。在原始小球藻AP2蛋白家族中不存在信号肽和跨膜结构域,同样在沙棘(Hippophae rhamnoides)WRI1转录因子(马倩等,2016)蛋白序列和蔷薇科植物的19个DELLA蛋白(宋伟等,2013)序列中也均无信号肽和跨膜結构域,但同时也存在不同,例如:在花生profilin蛋白(肖杰等,2011)序列中,信号肽位于第1~24位蛋白,却没有跨膜结构域;在大豆GmANKTM家族(柏锡等,2019)蛋白中存在跨膜结构域;在小麦(Triticum aestivum)F-box蛋白(王俊生等,2013)基因序列中,第94至第115位存在一个可能的跨膜区,且在该蛋白质N端序列不存在信号肽。
目前在植物界对AP2转录因子的研究主要在单双子叶植物上,如:在拟南芥(Arabidopsis)(Jofuku et al.,1994)中发现124个AP2/ERF家族基因;水稻(Oryza sativa)(Nakano, 2006)中发现了139个AP2/ERF家族基因;大豆(Glycine max)中发现了120个AP2/ERF家族基因(Zhang et al., 2008);小兰屿蝴蝶兰(Phalaenopsis equestris)中发现了107个AP2/ERF家族基因等(朱光哲,2016);而在藻类上AP2转录因子的研究较少。本研究主要描述的是对原始小球藻AP2所有蛋白成员进行了详细的生物信息学分析,系统进化分析结果说明了原始小球藻最为原始,与原始小球藻亲缘关系最远的是细小微胞藻ccmp1545 (Micromonas pusilla CCMP1545),亲缘关系最近的是团藻(Volvox carteri)。本研究结果为今后进一步研究AP2转录因子在原始小球藻生长发育过程中的生理特点和分子功能提供了一定的参考依据。
参考文献:
BO X, WANG XY, CHEN Y, et al., 2019.Bioinformatics analysis of GmANKTM family abiotic stress in soybean[J].J NE Agric Univ, 50(7):18-27.[柏锡, 王昕奕, 陈云, 等, 2019.大豆GmANKTM家族非生物胁迫生物信息学分析[J].东北农业大学学报, 50(7):18-27.]
CAO C, MA K, 2016.Protein secondary structure assignment[J].Chin J Bioinform, (14):187.[曹晨, 马堃, 2016.蛋白质二级结构指定[J].生物信息学, (14):187.]
GUI XH, 2017.Culture conditions for oil accumulation and regulation of lipid synthetic metabolism of Chlorella protothecoides[D].Wuhan:Huazhong University of Science and Technology.[桂小华, 2017.原始小球藻产油条件及油脂合成代谢调控的研究[D].武汉:华中科技大学.]
GUO H, JIN SY, LIU H, et al., 2017.In silico cloning and bioinformatics analysis of AP2/ERF gene family from Brassica oleracea[J].Chin Pharm, 20(1):6-10.[郭慧, 金司阳, 刘寒, 等, 2017.甘蓝AP2/ERF转录因子的克隆和生物信息学分析[J].中国药师, 20(1):6-10.]
HAN CZ, WANG J, 2016.Bioinformatics analysis of typeⅥ secreted protein in Xanthomonas campestris pv.raphani 756C[J].J Huazhong Agric Univ, 35(4):42-48.[韩长志, 王娟, 2016.黄单胞菌Xanthomonas campestris pv.raphani 756C中Ⅵ型分泌蛋白的生物信息学分析[J].华中农业大学学报, 35(4):42-48.]
JI Q, ZHOU F, ZHOU J, et al., 2018.Whole genome identification and bioinformatics analysis of AP2/EREBP transcription factors of Ziziphus jujube[J].Genom Appl Biol, 37(7):2983-2997.[纪晴, 周凡, 周军, 等, 2018.枣AP2/EREBP转录因子的全基因组鉴定及生物信息学分析[J].基因组学与应用生物学, 37(7):2983-2997.]
JOFUKU KD, DEN BOER BG, VAN MONTAGU M, et al., 1994.Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J].Plant Cell, 6(9):1211-1225.
LI JF, GUO MZ, LIU Y, et al., 2008.An evolutionary tree reconstruction method combining QuartetPuzzling and neighbor joining[J].J Comput Res Dev, 45(11):1965-1973.[李建伏, 郭茂祖, 刘扬, 等, 2008.一种基于QuartetPuzzling和邻接法的进化树构建算法[J].计算机研究与发展, 45(11):1965-1973.]
LIU Y, 2009.Evolutionary dynamics of flower development regulatory network[D].Beijing:University of Chinese Academy of Sciences, University of Chinese Academy of Sciences.[劉杨, 2009.花发育调控网络的进化动态研究[D].北京:中国科学院研究生院,中国科学院大学.]
LIU Y, XIE LY, LAI ZX, et al., 2017.Cloning and bioinformatics analysis of amaAG in Amaranthus tricolor L.[J].Acta Agric Univ Jiangxi, 39(1):168-174.[柳燕, 谢礼洋, 赖钟雄, 等, 2017.苋菜amaAG基因克隆与生物信息学分析[J].江西农业大学学报, 39(1):168-174.]
MA HY, ZHAO QF, CHEN S, et al., 2020.Bioinformatics analysis of PEPC gene family in pineapple[J].Chin J Trop Crop, 41(1):97-103.[马海洋, 赵秋芳, 陈曙, 等, 2020.菠萝PEPC基因家族生物信息学分析[J].热带作物学报, 41(1):97-103.]
MA Q, LI JB, RUAN CJ, et al., 2016.Bioinformatics analysis of WRI1 gene in Hippophae rhamnoides[J].Hubei Agric Sci, 55(22).[马倩, 李景滨, 阮成江, 等, 2016.沙棘WRI1转录因子基因的生物信息学分析[J].湖北农业科学, 55(22).]
MO XT, ZHAO J, FAN YL, et al., 2013.Research progress on structure and function of maize transcription factors[J].J Agric Sci Technol Chin, 15(3):7-17.[莫晓婷, 赵军, 范云六, 等, 2013.玉米转录因子结构与功能研究进展[J].中国农业科技导报, 15(3):7-17.]
NAKANO T, 2006.Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J].Plant Physiol, 140(2):411-432.
RICCARDO V, ANDREY Z, JASON A, et al., 2010.The genome of the domesticated apple (Malus domestica Borkh.)[J].Nat Genet, 42(10):833-839.
RUAN XL, ZHANG J, ZHANG FL, et al., 2017.The bioinformatics analysis of AP2 gene family in sweet potato[J].Mol Plant Breed, 15(6):2066-2072.[阮先乐, 张杰, 张福丽, 等, 2017.甘薯AP2基因家族的生物信息学分析[J].分子植物育种, 15(6):2066-2072.]
SCHWEDE T, KOPP J, GUEX N, et al., 2003.SWISS-MODEL:An automated protein homology-modeling server[J].Nucl Acid Res, 31(13):3381-3385.
SHI Y, XU X, LI HY, et al., 2013.Bioinformatics analysis of the expansin gene family in rice[J].Hereditas, 36(8):809-820.[施杨, 徐筱, 李昊阳, 等, 2013.水稻扩展蛋白家族的生物信息学分析[J].遗传, 36(8):809-820.]
SONG W, LI DL, WANG R, et al., 2013.Bioinformatics analysis of DELLA proteins in Rosaceous plants[J].Chin Agric Sci Bull, 29(19):142-148.[宋伟, 李鼎立, 王然, 等, 2013.蔷薇科植物DELLA蛋白的生物信息学分析[J].中国农学通报, 29(19):142-148.]
SU L, TONG SM, 2016.Sequence analysis and translation of AP2/ERF transcription factor gene family in Vitis vinifera[J].Biotechnol World, (4):18-19.[栗丽, 佟少明, 2016.葡萄(Vitis vinifera)AP2/ERF转录因子基因家族序列分析[J].生物技术世界, (4):18-19.]
TAMURAK, PETERSON D, PETERSON N, et al., 2011.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J].Mol Biol Evol, 28(10):2731-2739.
TU JQ, GAN L, FENG LL, et al., 2018.Bioinformatics analysis of PEPC gene family in Arachis duranensis[J].J Trop Subtrop Bot, 26(2):107-115.[涂嘉琦, 甘璐, 冯兰兰, 等, 2018.蔓花生PEPC基因家族的生物信息学分析[J].热带亚热带植物学报, 26(2):107-115.]
WANG GH, GUI XH, DENG W, et al., 2013.Effect of “heterotrophic-stress”segmental culture on biomass and lipid content of Chlorella protothecoides[J].Chin Biotechnol, 33(3):99-104.[汪桂林, 桂小华, 邓伟, 等, 2013.“异养-胁迫”分段培养对原始小球藻生物量和油脂含量影响研究[J].中国生物工程杂志, 33(3):99-104.]
WANG GL, 2013.Two-step cultivation mode for Chlorella protothecoides and extraction of high-valued product[D].Wuhan:Huazhong University of Science and Technology.[汪桂林, 2013.原始小球藻分段培養条件优化及高附加值产物提取工艺研究[D].武汉:华中科技大学.]
WANG JS, LI LL, YANG H, et al., 2013.Electronic clone and bioinformatics analysis of F-box protein gene from wheat(Triticum aestivum L.)[J].J Henan Agric Sci, 42(2):15-19.[王俊生, 李俐俐, 杨欢, 等, 2013.小麦F-box蛋白基因的电子克隆和生物信息学分析[J].河南农业科学, 42(2):15-19.]
WANG LL, 2016.Genome-wide investigation of AP2 subfamily in Brassica napus L.and WRI1 in plants[D].Yangling:Northwest A & F University.[王莉莉, 2016.甘蓝型油菜AP2亚家族转录因子及植物中WRI1的基因组学分析[D].杨凌:西北农林科技大学.]
WANG S, LI Y, LI MJ, et al., 2019.Cloning and bioinformatics analysis of APs gene in Ricinus communis[J].Mol Plant Breed, 17(22):7344-7349.[王双, 李跃, 李孟建, 等, 2019.蓖麻APs基因克隆及生物信息学分析[J].分子植物育种, 17(22):7344-7349.]
WANG Y, 2017.Study on expression and function of AP2/ERF transcription factor in flower bud of chinese cherry during dormancy release[D].Jinhua:Zhejiang Normal University.[王月, 2017.中国樱桃AP2/ERF转录因子在花芽休眠解除过程的表达与作用研究[D].金华:浙江师范大学.]
WEN KX, LIU XM, 2010.The important role of AP2 functional genes in plant floral development[J].Biotechnol Bull, (2):1-7.[闻可心, 刘雪梅, 2010.AP2功能基因在植物花发育中的重要作用[J].生物技术通报, (2):1-7.]
WU LJ, YU ZL, LIN XZ, et al., 2016.Advances and perspectives of genetic engineering in Chlorella[J].Bull Sci Technol, 32(12):51-56.[吴丽娟, 余志良, 林祥志, 等, 2016.小球藻基因工程的研究进展及应用前景展望[J].科技通报, 32(12) :51-56.]
WU ZJ, LU L, LI XH, et al., 2014.Isolation and expression profiles analysis of AP2/ERF-B3 group transcription factor from Camellia sinensis[J].J Nanjing Agric Univ, 37(4):67-75.[吴致君, 卢莉, 黎星辉, 等, 2014.茶树AP2/ERF-B3类转录因子基因的克隆与表达特性分析[J].南京农业大学学报, 37(4):67-75.]
XIAO J, WU XY, WANG LL, et al., 2011.Bioinformatics of profilin protein from peanut[J].Immunol J, 27(2):158-161.[肖杰, 吴序栎, 王琳琳, 等, 2011.花生profilin蛋白的生物信息学分析[J].免疫学杂志, 27(2):158-161.]
XIA QY, 2007.Cloning and expression of venom allergen soli1 and soli4 genes in the Solenopsis invicta[D].Chongqing:Southwest University.[夏巧玉, 2007.红火蚁毒素致敏原soli1、soli4基因的克隆及表达[D].重庆:西南大学.]
XU ZJ, LIU Y, XU L, et al., 2019.Bioinformatics analysis of NF-YB gene family of transcription factor in Zea mays[J].Mol Plant Breed,17(12):3807-3816.[徐志军, 刘洋, 徐磊, 等, 2019.玉米转录因子NF-YB基因家族的生物信息学分析[J].分子植物育种, 17(12):3807-3816.]
YANG L, 2015.Clone and functional analysis of carbonic anhydrase gene of tobacco[D].Chengdu:Sichuan Agricultural University.[杨朗, 2015.烟草碳酸酐酶基因的克隆及其生物信息学分析[D].成都:四川农业大学.]
ZHANG G, CHEN M, CHEN X, et al., 2008.Phylogeny, gene structures, and expression patterns of the ERF gene family in soybean (Glycine max L.)[J].J Exp Bot, 59(15):4095-4107.
ZHANG HY, LI ZT, ZHAO CJ, et al., 2013.Genome-wide analysis of LIM domain-containing protein gene family in maize[J].J Maize Sci, (3):40-47.[張海燕, 李佐同, 赵长江, 等, 2013.玉米LIM结构域蛋白基因家族分析[J].玉米科学, (3):40-47.]
ZHANG JY, WANG QJ, GUO ZR, 2012.Progresses on plant AP2/ERF transcription factors[J].Hereditas, 34(7):835-847.[张计育, 王庆菊, 郭忠仁, 2012.植物AP2/ERF类转录因子研究进展[J].遗传, 34(7):835-847.]
ZHANG Q, CHENG J, LI L, et al., 2018.Research progress on plant AP2/ERF transcription factor family[J].Biotechnol Bull, 34(8):1-7.[张麒, 陈静, 李俐, 等, 2018.植物AP2/ERF转录因子家族的研究进展[J].生物技术通报, 34(8):1-7.]
ZHANG Y, SUN FB, 2011.Function of AP2 in plant flower development[J].Chin Sci Technol Overview, (23):436.[张妍, 孙丰宾, 2011.AP2在植物花发育中的功能简述[J].中国科技纵横, (23):436.]
ZHAO JL, YAO WJ, WANG SJ, et al., 2015.AP2/ERF gene family in Populus trichocarpa by bioinformatics[J].J NE For Univ, 43(10):21-29.[赵金玲, 姚文静, 王升级, 等, 2015.杨树AP2/ERF转录因子家族生物信息学分析[J].东北林业大学学报, 43(10):21-29.]
ZHU CS, LIU Y, CHENG MM, et al., 2018.Cloning and expression analysis of two AP2/ERF transcription factors in Tripterygium wilfordii Hook.f[J].Acta Bot Boreal-Occident Sin, 38(8):43-50.[祝傳书, 刘艳, 陈蒙蒙, 等, 2018.雷公藤AP2/ERF转录因子基因的克隆与分析[J].西北植物学报, 38(8):43-50.]
ZHU GZ, 2016.Bioinformatics analysis of AP2/ERF gene family in Phalaenopsis equestris[D].Beijing:Chinese Academy of Forestry.[朱光哲, 2016.小兰屿蝴蝶兰AP2/ERF基因家族生物信息学分析[D].北京:中国林业科学研究院.]
ZHU YM, YU JY, YU Y, et al., 2019.GsRAV3 gene, encoding a member of the AP2/RAV family from Glycine soja, negatively regulates plant ABA sensitivity in Arabidopsis[J].J NE Agric Univ, 50(5):8-18.[朱延明, 于纪洋, 于洋, 等, 2019.野生大豆AP2/RAV亚家族转录因子GsRAV3负调控拟南芥对ABA的敏感性[J].东北农业大学学报, (5):8-18.]
(责任编辑 周翠鸣)

