基于藜麦转录组的脂肪酸生物合成途径解析
时小东 孙梦涵 吴琪 邬晓勇 赵钢

摘 要:藜麥营养丰富,油脂含量高,脂肪酸组成理想,是油脂提取物的潜在资源。植物油脂主要以三酰甘油的形式储存在作物种子和果实等器官中,其合成受到环境和基因水平的调控,涉及质体、内质网和油体等多个细胞器。该文基于藜麦转录组数据,对藜麦油脂合成相关的脂肪酸生物合成途径基因进行挖掘,并对基因表达模式进行分析。结果表明:在藜麦中,与脂肪酸生物合成相关的基因序列共87条,涉及乙酰CoA羧化酶和β-酮脂酰ACP合成酶等关键酶,其中编码长链酰基辅酶A合成酶基因和β-酮脂酰ACP还原酶数目最多。通过基因表达模式分析发现,与脂肪酸生物合成相关的基因在种子表达中呈现整体上调模式,可能与种子中油脂形成和积累密切相关。对藜麦乙酰CoA羧化酶亚基编码基因进行分析发现,accD基因在不同组织间无差异表达,表明在藜麦中accD编码的β-CT亚基可能不是影响乙酰CoA羧化酶发挥作用的限制因子。藜麦KASⅡ含有保守结构域,与其他组织相比,编码基因QcFb15、QcFb45和QcFb75在种子中均存在上调表达,参与藜麦脂肪酸碳链延伸及油脂形成。对藜麦脂肪酸生物合成途径相关基因的挖掘,为藜麦油脂合成和积累的研究提供了理论基础,对高油脂藜麦品种选育等后续研究也具有重要启示作用。
关键词:藜麦, 转录组, 脂肪酸生物合成, 差异表达基因
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2020)12-1721-11
Abstract:Quinoa is rich in nutrients, high in oil content and ideal in fatty acid composition. It is a potential resource for oil extract. Plant oil is mainly stored in crop seeds and fruits in the form of triacylglycerol, and the biosynthesis of oil is catalyzed by a large set of enzymes and regulated by both environmental factors and related genes. In addition, the synthesis and storage of oil involve plastid, endoplasmic reticulum and oil body. The molecular mechanism related to the synthesis of quinoa oil will provide a basis for breeding of oil-quinoa. In this study, the transcriptome of quinoa was analyzed. Based on quinoa transcriptome data, genes involved in fatty acids biosynthesis were explored, and the expression pattern of quinoa genes related to acetyl CoA carboxylase and β-ketoacyl ACP synthase were analyzed. The results were as follows:There were 87 genes related to fatty acid biosynthesis in quinoa, involving key enzymes such as acetyl CoA carboxylase and β-ketoacyl ACP synthase. The number of long-chain acyl-CoA synthetase gene was the most, followed by the β-oxoacyl-ACP reductase gene. Through pathway enrichment analysis, all of these differentially expressed genes were classified into pathways including fatty acid biosynthesis and fatty acid metabolism which were involved in oil synthesis. Based on gene expression pattern analysis, it was found that the genes related to fatty acid biosynthesis showed up-regulation in quinoa seed, which was closely related to the production and accumulation of oil in seed. The accD gene was not differentially expressed between different tissues, indicating that the β-CT subunit may not be a limitation affecting factor for the function of acetyl-CoA carboxylase. The α-CT protein encoded by accD gene, with no signal peptide and was a hydrophobic protein. However, β-CT was a hydrophilic protein. KAS Ⅱ contained a conserved domain, and QcFb15, QcFb45 and QcFb75 were up-regulated in seeds, which were related to the chain extension of quinoa fatty acids and oil formation. The excavation of genes related to fatty acid biosynthesis pathway of quinoa will provide a theoretical basis for the study of the synthesis and accumulation of oil, and it has important enlightenment for the follow-up research of high oil quinoa varieties.
Key words:quinoa, transcriptome, fatty acid biosynthesis, different expression genes
藜麦(Chenopodium quinoa)为一年生苋科植物,原产于南美洲安第斯山区,是哥伦比亚到智利中部等地区重要的粮食作物,已有七千年的栽培历史(Jacobsen et al., 2003)。藜麦为四倍体植物,很多质量性状表现出双染色体遗传特性(Maughan et al., 2004)。藜麦具有丰富的遗传多样性和变异性,表现出不同生态条件下的广泛适应性,纬度分布广,海拔分布广泛。藜麦可以在海平面到海拔4 000 m的范围种植,耐受土壤贫瘠、干旱和盐碱等恶劣环境(Hilal et al., 2004; Hariadi et al., 2011)。根据FAO统计(2017),藜麦产量主要集中在秘鲁、玻利维亚、厄瓜多尔,智利、阿根廷、哥伦比亚也是主产国。此外,藜麦在美国、印度、意大利、法国等95个国家和地区均有种植(崔宏亮等,2019)。藜麦虽然自20世纪90年代,已引入我国,但研究进展相对缓慢。近年来,中国农业科学院作物科学研究所、成都大学等科研机构对藜麦开展了多方面研究。目前,已审(鉴)定藜麦品种10余个,在山西、青海、甘肃、内蒙等18个省(区)进行推广种植,面积达9 000 hm2(2017年数据),并初步呈现规模化种植的发展趋势。基于藜麦在不良气候条件下的持久适应能力,因此被认为是各种不良非生物因素限制条件下进行粮食作物生产的最佳选择之一。
藜麦既是一种极富营养价值的食物,氨基酸配比均衡,含有人体所需的全部必须氨基酸,也是FAO认定的唯一一种单体植物即可满足人体基本营养需求的食物,因此是最适宜人类的完美“全营养食品”。藜麦籽粒中既不含有谷物中常见的谷蛋白等过敏原,也不含麸质,适合孕妇、婴幼儿等特殊人群。同时,藜麦富含油类成分,脂肪平均含量为5%~7%,高于玉米脂肪酸含量(3%~4%)(Zevallos et al., 2012)。藜麦籽粒脂肪酸含量受到品种和种植环境等因素的影响。徐天才等(2017)对不同海拔下藜麦营养成分进行分析表明,藜麦粗脂肪含量随海拔升高而增加。胡一波等(2017)对我国北方种植的25份藜麦种质资源进行品质评价,研究表明不同藜麦品种籽粒脂肪酸含量变化范围为3.51%~6.72%,且与总黄酮含量呈现极显著正相关性。对不同生育期植株(苗期、初花期、灌浆期和成熟期)进行脂肪酸分析表明,植株全株脂肪酸含量由苗期的9.53%下降到成熟期的3.30%,苗期脂肪酸含量较高(魏玉明等,2018)。此外,因其不饱和脂肪酸丰富,皮肤渗透性好,油脂透明度高,藜麦籽油已经在保健产品、婴儿乳液、高档口红等产品中得到应用。柳慧芳等(2018)建立了藜麦油脂的超临界CO2萃取工艺,为藜麦油脂开发利用提供了技术支持。上述研究均表明,藜麦具有较高的油脂含量和理想的脂肪酸组成,既可作為油脂提取物的潜在资源,也被作为非油料种子作物。
植物油脂主要以三酰甘油酯的形式存在,其合成是众多酶和基因的协同表达和调节的复杂过程,涉及脂肪酸合成和三酰甘油组装等过程,大多数步骤已经研究较为透彻(Beisson et al., 2013)。脂肪酸合成是植物体内油脂形成的第一步,主要发生在质体,合成需要前体物质乙酰辅酶A的供应,前体物质在乙酰辅酶A羧化酶的作用下生成丙二酰辅酶A,后经过脂肪酸合酶、脂肪酰-ACP硫酯酶等催化,形成不同链长的游离脂肪酸(Yuan et al., 1995; Pidkowich et al., 2007)。游离脂肪酸在酰基辅酶A合成酶作用下形成酰基辅酶A,后经过3-磷酸甘油酰基转移酶、溶血磷酸酰基转移酶、二酰甘油转酰酶等作用,将酰基转移到磷酸甘油骨架上,形成三酰甘油脂(Oakes et al., 2011)。由此可见,植物油脂合成是多种酶和基因共同参与的复杂过程,这是植物油脂含量和组成表现出复杂多样性的分子遗传基础(陈昊等,2013)。从整体上对植物油脂合成途径相关基因的挖掘和深入分析,将对全面阐明植物油脂代谢调控网络提供参考,为植物油脂合成调控奠定基础。目前,对藜麦油脂方面的研究主要集中于含量、脂肪酸组成和提取工艺等方面,油脂合成调控机理及作用途径等方面的研究尚未开展,这在一定程度上限制了油脂产量的提高和品质的改善。
本研究在藜麦转录组数据基础上,通过生物信息学方法,确定了其脂肪酸合成途径中的相关基因,并对基因结构和表达模式进行分析,对差异表达基因进行鉴定。本研究结果将为藜麦高油脂内在机制的解析奠定基础,同时也为相关功能基因研究和油用藜麦分子育种提供数据支持。
1 材料与方法
1.1 材料
藜麦籽粒种植于成都大学杂粮加工重点实验室试验基地,9月份播种,以陇藜2号品种为试验材料。当材料出现成熟籽粒时,选取5株藜麦,分别取其根、茎、叶、花和种子混匀,使用液氮速冻保存。
1.2 方法
1.2.1 测序文库构建及测序 转录组测序文库构建及测序工作由北京百迈客生物科技有限公司完成,运用Illumina高通量测序平台,基于边合成边测序技术。
1.2.2 数据处理及基因表达 对测序数据进行质量控制和去杂处理后得到有效序列,运用HISAT2软件(Kim et al., 2015)将序列对比到藜麦参考基因组(Jarvis et al., 2017)。使用BLAST软件对序列与公共数据库进行对比,得到注释信息。采用FPKM衡量基因表达水平,并运用EBSeq进行差异基因分析,筛选标准为差异倍数(Fold Change)≥2且错误发现率(False Discovery Rate)<0.01。
1.2.3 脂肪酸合成途径基因挖掘 根据KEGG数据库中脂肪酸合成途径(ko00061)注释信息,得到藜麦脂肪酸合成途径中的相关基因(Kanehisa et al., 2004)。使用ExPaSy、SOPMA、ProtComp等在线软件对序列进行生物信息学分析,参数设置为默认值。
2 结果与分析
2.1 测序数据统计
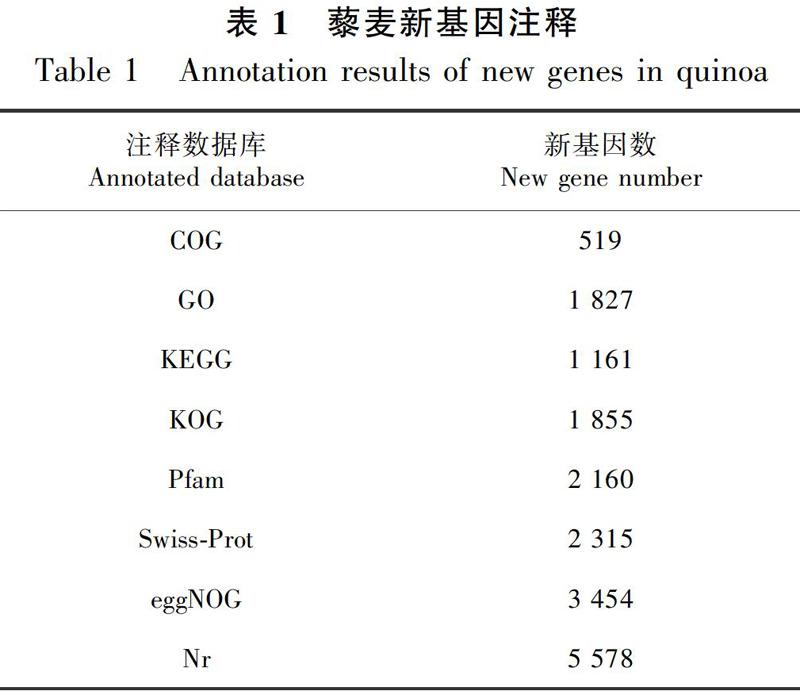
对测序数据进行过滤后,各样品的有效数据量均大于6.30 GB,Q30碱基百分比均大于92.10%,表明该试验得到数据质量较高,能够满足后续分析需求。通过对有效序列与藜麦参考基因组进行对比,匹配到参考基因组效率为92.90%~96.63%,说明转录组测序数据适合该参考基因组。此外,通过与参考基因组注释信息进行比较,共发掘得到7 416个新基因(表1)。将得到的新基因序列分别与公共数据库中进行对比分析,共5 623个基因序列被注释,占新基因数量的75.82%。其中:注释到Nr数据库的新基因数量最多,有5 578个,占所有新基因数目的75.22%;其次是eggNOG数据库,注释新基因数目为3 454个;注释到KEGG数据库的新基因数目为1 161个,占挖掘新基因数目的15.66%。
2.2 藜麦脂肪酸合成途径基因挖掘
基于藜麦基因组和转录组数据的KEGG代谢途径分析,为全面挖掘藜麦营养物质合成途径解析和代谢网络构建提供了数据支撑。脂肪酸合成是植物油脂合成的基础,基于藜麦基因组和不同组织转录组数据,对藜麦脂肪酸生物合成途径(fatty acid biosynthesis,ko00061)进行分析,挖掘得到相关基因87个,共编码15种酶/蛋白(表2,图1)。其中:编码长链酰基辅酶A合成酶(LACS)基因数目最多,为20个;其次为β-酮脂酰ACP还原酶(KAR),编码基因数目为13个。结合KEGG通路对比结果,构建了藜麦脂肪酸生物合成途径(图1),乙酰CoA是藜麦脂肪酸生物合成的前体,其在乙酰CoA羧化酶(ACCase)作用下生成丙二酸单酰CoA,该步骤是从头合成脂肪酸的第一步反应。上述过程形成的丙二酸单酰CoA是脂肪酸链延伸的二碳单位的直接供体。丙二酸单酰CoA再经过脂肪酸合酶(FAS)系统,FAS由5部分组成,分别为丙二酸单酰辅酶A-ACP转移酶(MAT)、β-酮脂酰ACP合成酶(KAS)、KAR、β-酮脂酰ACP脱水酶(HAD)和烯脂酰ACP还原酶(EAR),在藜麦中编码基因数目分别为2、11、13、2和3。FAS系统催化连续循环,每次增加2个碳长度,直到生成软脂酸-ACP和硬脂酸ACP,其在酰基ACP硫酯酶(FAT)的作用下将ACP释放,终止碳链延伸反应。随后,游离脂肪酸在LACS的作用下形成三酰甘油合成的底物——脂酰CoA。
2.3 藜麦脂肪酸合成途径基因的组织表达模式分析
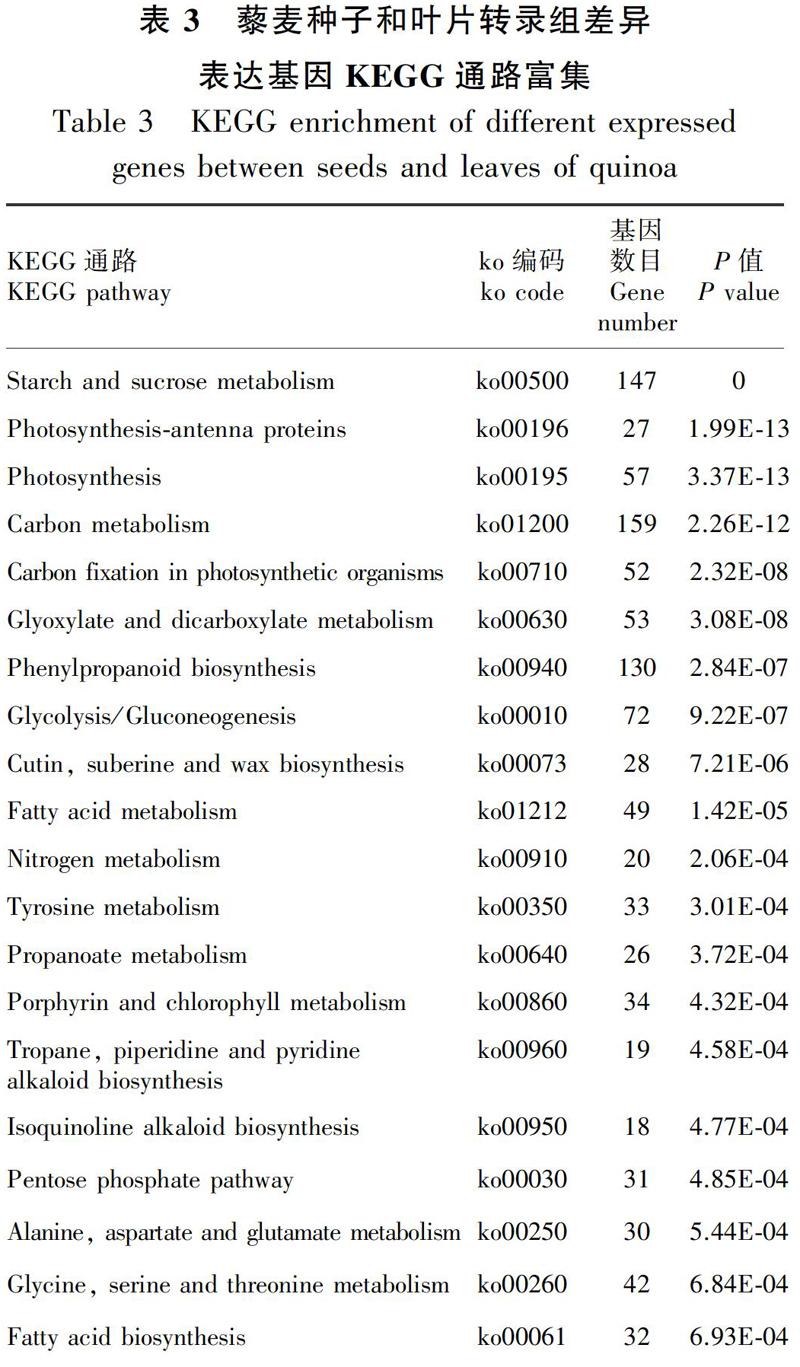
基于藜麦根(T1)、茎(T2)、叶(T3)、花(T4)和种子(T5)转录组的表达数据,以种子为试验组,以其他组织为对照组。对筛选的差异表达基因进行Pathway富集性分析,筛选富集度水平(P<0.05)且显著水平前20个代谢通路进行通路作图,每组差异表达基因都有一些被归类于脂肪酸生成途径,如脂肪酸生物合成途径、脂肪酸代谢途径、脂肪酸延长(表3)。对涉及藜麦脂肪酸合成途径的差异表达基因进行分析,在根vs种子、茎vs种子、叶vs种子和花vs种子中,差异表达基因分别为45个、35个、33个和32个,其中上调表达基因数目分别为39个、31个、22个和25个,下调表达基因数目为6个、4个、11个和7个(图2)。
2.4 乙酰CoA羧化酶(ACCase)分析
乙酰CoA羧化酶催化作用是脂肪酸生物合成的第一步,也是脂肪酸合成的限速步驟,该步骤依赖ATP,与种子含油量密切相关。乙酰CoA羧化酶由4个亚基组成,即生物素羧基载体蛋白(BCCP)亚基、生物素羧化酶(BC)亚基、羧基转移酶(CT)的α-CT亚基和β-CT亚基。在藜麦中鉴定出17个基因编码4个亚基,其中5个accB基因编码BCCP,2个accC基因编码BC,7个accA和3个accD基因分别编码α-CT和β-CT亚基(表4)。在植物中,细胞质中α-CT亚基所表达的前体蛋白被运送到叶绿体中,与β-CT亚基所表达的蛋白结合,形成ACCase的羧基转移酶(CT),对ACCase功能的发挥起着重要的作用。在藜麦中,α-CT亚基氨基酸数目介于513~736,理论等电点为8.08~9.14。除去QcFb26,其余α-CT亚基脂溶系数为89.63~95.43 (小于100), 不稳定系数为33.64~37.51(小于40),亲水性小于0,推测藜麦α-CT以疏水性脂溶蛋白为主,表现为稳定蛋白。β-CT亚基氨基酸数目为237~369,理论等电点为4.75~7.66;脂溶系数为94.64~99.08,均小于100;亲水性为0.01~0.10,推测β-CT为亲水性脂溶蛋白;其不稳定系数为32.74~45.59,稳定性具有差异性。通过对信号肽预测,CT亚基不存在信号肽切割位点,是一个非分泌蛋白。
将基因在种子中表达量与其他组织中的表达量进行两两对比发现,11个基因的表达量出现上调表达,除编码β-CT亚基的accD基因无差异表达外,其余家族编码基因均在藜麦不同组织间存在差异表达(表5)。与其他4个组织相比,QcFb76(accC)、QcFb8(accA)、QcFb46(accB)基因在种子中均表现为上调表达;与叶片相比,基因QcFb52(accB)在种子中为下调表达,这是挖掘得到唯一的1个下调表达基因;剩余6个基因的表达量在任何组织中均没有发生变化。上述结果表明,在种子中ACCase表达量相对其他组织高,有利于种子中脂肪酸的合成,为种子中油脂合成和积累提供更多的底物。
2.5 β-酮脂酰ACP合成酶(KAS)分析
植物脂肪酸的合成是在脂肪酸合成酶的作用下,将C2结构反复添加到脂肪酸链中,经过多次循环,形成不同碳链长度的脂肪酸,β-酮脂酰ACP合成酶(KAS)作为脂酰基载体,在脂肪酸合成中发挥着重要的作用。在藜麦中,鉴定出11个KAS基因编码蛋白,其中7个fabH基因编码KASⅡ、4个fabF基因编码KASⅢ(表6)。运用生物信息学软件,对藜麦KAS家族蛋白理化性质进行预测表明,编码的KASⅡ氨基酸数目为185~549,理论等电点为5.95~7.99。4个KASⅡ不稳定指数小于40,3个KASⅡ大于40,其稳定性存在差异;脂溶系数均小于100,推测KASⅡ为脂溶蛋白。SignalP对信号肽进行预测,QcFb47和QcFt53存在信号肽位点,推测可能为分泌型蛋白,其余KASⅡ为非分泌型蛋白。对KASⅢ家族蛋白理化性质分析表明,藜麦中KASⅢ蛋白表现为高度一致性,为不稳定的亲水性脂溶蛋白。KASⅢ蛋白中也未检测到信号肽, 预测为非分泌型蛋白。对藜麦KASⅡ序列结构分析表明,含有相对保守的KASⅡ结构GPNYSISTACATSN(F/H/Y)CI;同时,藜麦KASⅡ序列N端氨基酸序列存在差异性,C端氨基酸序列相对保守(图3)。
将基因在种子中表达量与其他组织中的表达量进行两两对比发现,除QcFb30外,其他KAS编码基因在种子中均发现存在上调表达;与叶片相比,1个基因(QcFb29)在种子中出现下调表达,这是挖掘到的唯一的下调表达基因(表5)。对差异表达基因进行分析,与根相比,10个基因为上调表达;与茎相比,8个基因为上调表达;在叶和花中存在上调表达的基因数目为4个和6个。与其他4个组织相比,在种子中QcFb15、QcFb45、QcFb75、QcFb51基因均表现为上调表达。上述结果表明,在种子中KAS编码基因表达量相对其他组织中高,有利于种子中脂肪酸链的延长,为油脂合成提供条件。
3 讨论与结论
虽然藜麦全基因组数据已经报道,但藜麦分子生物學研究基础相对薄弱,功能基因数据仍有待深入地研究(Jarvis et al., 2017; Zou et al., 2017)。转录组测序技术成本低,灵敏度高,可在短时间内获得大量基因表达数据,相比其他高通量基因表达数据获得方法具有明显的优势,已经在油桐、核桃等产油植物的脂肪酸合成途径挖掘中得到成功运用(陈昊等,2013; 杨丽等,2017)。本研究利用藜麦5种组织(根、茎、叶、花和种子)转录组数据,测序数据Q30碱基百分比均大于92%,对比参考基因组效率大于92%,表明序列测序质量达到转录组分析的要求。同时,通过基因组对比分析,挖掘得到了7 461个新基因序列,并有5 623个新基因得到注释, 新基因的挖掘可能与品种选择及参考基因组测序质量等原因有关,将为完善藜麦参考基因组序列提供数据。油脂合成代谢过程复杂,涉及多个途径,如脂肪酸生物合成、脂肪酸延长、脂肪酸去饱和、甘油磷脂代谢等过程,脂肪酸生物合成途径是油脂合成代谢的前体(White et al., 2005)。通过对藜麦转录组数据进行KEGG功能注释,挖掘得到了藜麦脂肪酸生物合成途径信息,共得到87条编码基因序列。相比其他物种而言,挖掘得到编码基因数目相对较多,如在油桐中共发现54条序列归类于脂肪酸生物合成途径(陈昊等,2013),在于玛氏骨条藻(Skeletonema marinoi)中挖掘得到了脂肪酸生物合成途径相关的转录本33个,编码26种酶(张梅等,2018)。这可能与藜麦脂肪酸生物合成途径调控相对复杂有关。
对藜麦种子与其他组织脂肪酸生物合成途径基因的表达谱进行两两对比发现,差异基因表达以上调为主。其中与叶片相比,种子中上调表达基因数目最少,下调表达基因数目最多。魏玉明等(2018)对藜麦不同生育期粗脂肪含量进行测定,结果表明在藜麦成熟期,粗脂肪含量仅存在于叶片和籽粒中,茎秆、根系等组织未检测到粗脂肪,且叶片和籽粒中脂肪酸含量差异不显著(P<0.05)。这说明藜麦不同组织转录组的分析结果与生理研究结果相一致。
在油脂合成中,脂肪酸生物合成途径是目前了解最为清晰的途径(Tran et al., 2014)。accD是制约质体ACCase活性水平的关键制约因子,有研究结果表明通过转基因技术实现accD超表达,提高了质体ACCase水平,并引起叶片脂肪酸含量的提高和结籽量的增加,但籽粒脂肪酸含量没有变化(Sasaki et al., 2001; Madoka et al., 2003)。对藜麦脂肪酸生物合成途径基因进行分析,在藜麦乙酰辅酶A羧化酶组成相关的基因中,与其他组织相比,种子中accD基因未发生差异表达。KAS催化脂肪酸合成的缩合反应,作为脂酰基载体,对脂肪酸合成的启动和循环起着重要作用。KASⅢ是启动脂肪酸合成,KASⅡ是催化植物棕榈酸到硬脂酸转化过程的关键酶,对最终油脂组成起着重要的决定作用,此外还与植物的低温适应性和植物的生长发育密切相关(Carlsson et al., 2002)。在藜麦中,与其他组织相比,在种子中KASⅡ编码基因fabH均表现出上调表达,使硬脂酸含量增加。Ando et al.(2002)对藜麦籽粒脂肪酸组成的研究结果表明,18碳组成脂肪酸远高于16碳组成脂肪酸,与藜麦种子中fabH高表达具有一致性。结合藜麦参考基因组和转录组数据,对藜麦脂肪酸生物合成途径进行分析,明确了脂肪酸生物合成途径相关基因及编码蛋白信息,为深入研究藜麦脂肪酸形成的分子机理提供了数据支撑,也为解析藜麦油脂形成与基因的关系解析奠定了基础。
参考文献:
ANDO H, CHEN YC, TANG H, et al., 2002. Food components in fractions of quinoa seed[J]. Food Sci Technol Res, 8(1): 80-84.
BEISSON F, ABRAHAM J, SARI R, et al., 2003. A 2003 census of the candidates, a study of the distribution of expressed sequence tags in organs, and a web-based database[J]. Plant Physiol, 132(2):681-679.
CARLSSON A, LABRIE S, KINNEY A, et al., 2002. A KAS2 cDNA complements the phenotypes of the Arabidopsis fab1 mutant that differs in a single residue bordering the substrate binding pocket[J]. Plant J, 29(6):761-770.
CHEN H, JIANG GX, LONG HX, et al., 2013. Analysis of oil synthesis metabolism pathways based on transcriptome changes in tung oil trees seeds during three different development stages[J]. Hereditas, 21(3):13-17.[陈昊, 蒋桂雄, 龙洪旭, 等, 2013. 基于油桐种子3个不同发育时期转录组的油脂合成代谢途径分析[J]. 遗传, 35(12):1403-1413.]
CUI HL, XING B, YAO Q, et al., 2019. SWOT analysis on development of quinoa industry in Ili Valley of Xinjiang[J]. Crops, 1:13-17.[崔宏亮, 邢宝, 姚庆, 等, 2019. 新疆伊犁河谷藜麦产业发展的SWOT分析[J]. 作物杂志, 1:13-17.]
HARIADI Y, MARANDON K, TIAN Y, et al., 2011. Ionic and osmotic relations in quinoa (Chenopodium quinoa Willd.) plants grown at various salinity levels[J]. J Exp Bot, 62(1):185-193.
HE HF, ZHU TC, LIN FW, 2018. Application prospect of quinoa in cosmetics[J]. Guangdong Chem Ind, 45(2):
120-122.[何海芬, 朱統臣, 林飞武, 2018. 藜麦在化妆品中的应用前景[J]. 广东化工, 45(2):120-122.]
HILAL M, PARRADO MF, ROSA M, et al., 2004. Pre-harvest sprouting in white wheats and its resistant characteristics of cultivars[J]. Photochem Photobiol, 79(2):205-210.
HU YB, YANG XS, LU P, et al., 2017. The resistance and mechanism of pre-harvest sprouting in spring wheat[J]. Acta Agron Sin, 43(3):464-470.[胡一波, 杨修仕, 陆平, 等, 2017. 中国北部藜麦品质性状的多样性和相关性分析[J]. 作物学报, 43(3):464-470.]
JACOBSEN SE, MUJICA A, JENSEN CR, 2003. The resistance of quinoa (Chenopodium quinoa Willd.) to adverse abiotic factors[J]. Food Rev Int, 19(1-2):99-109.
JARVIS DE, HO YS, LIGHTFOOT DJ, et al., 2017. The genome of Chenopodium quinoa[J]. Nature, 542(7641):307-312.
KANEHISA M, GOTO S, KAWASHIMA S, et al., 2004. The KEGG resource for deciphering the genome[J]. Nucl Acid Res, 32(Database issue):D277-D280.
KIM D, LANGMEAD B, SALZBERG SL, 2015. HISAT:A fast spliced aligner with low memory requirements[J]. Nat Methods, 12(4):357-360.
LIU HF, GUO JY, JIANG LH, et al., 2018. Optimization of supercritical CO2 extraction of quinoa oil and analysis of its fatty acid components[J]. Sci Technol Food Ind, 39(22):200-203.[柳慧芳, 郭金英, 江利华, 等, 2018. 超临界CO2萃取藜麦油脂的工艺优化及其脂肪酸成分分析[J]. 食品工业科技, 39(22):200-203.]
MADOKA Y, TOMIZAWA K, MIZOI J, et al., 2002. Chloroplast transformation with modified accD operon increases acetyl-CoA carboxylase and causes extension of leaf longevity and increase in seed yield in tobacco[J]. Plant Cell Physiol, 43(12):1518-1525.
MAUGHAN PJ, BONIFACIO A, JELLEN EN, et al., 2004. A genetic linkage map of quinoa (Chenopodium quinoa) based on AFLP, RAPD, and SSR markers[J]. Theor Appl Genet, 109(6):1185-1195.
OAKES J, BRACKENRIDGE D, COLLETTI R, et al., 2011. Expression of fungal diacylglycerol acyltransferase2 genes to increase kernel oil in maize[J]. Plant Physiol, 155(3): 1146-1157.
PIDKOWICH MS, NGUYEN HT, HEILMANN I, et al., 2007. Modulating seed beta-ketoacyl-acyl carrier protein synthase Ⅱ level converts the composition of a temperate seed oil to that of a palm-like tropical oil[J]. Proc Natl Acad Sci USA, 104(11):4742-4747.
SASAKI Y, KOZAKI A, OHMORI A, et al., 2001. Chloroplast RNA editing required for functional acetyl-CoA carboxylase in plants[J]. J Biol Chem, 276(6):3937-3940.
TRAN TH, HSIAO YS, JO J, et al., 2015. Structure and function of a single-chain, multi-domain long-chain acyl-CoA carboxylase[J]. Nature, 518(7537):120-124.
WEI YM, YANG FR, LIU WY, et al., 2018. Regulation of nutrient accumulation and distribution in quinoa at different growth stages[J]. Pratac Sci, 35(7):1720-1727.[魏玉明, 杨发荣, 刘文瑜, 等, 2018. 藜麦不同生育期营养物质积累与分配规律[J]. 草业科学, 35(7):1720-1727.]
WHITE SW, ZHENG J, ZHANG YM, et al., 2005. The structural biology of type Ⅱ fatty acid biosynthesis[J]. Ann Rev Biochem, 74:791-831.
XU TC, HE GQ, LI ZG, et al., 2017. Nutritional components in Chenopodium quinoa at different elevations[J]. Chin Agric Sci Bull, 33(17):129-133.[徐天才, 和桂青, 李兆光, 等, 2017. 不同海拔藜麦的营养成分差异性研究[J]. 中国农学通报, 33(17):129-133.]
YANG L, CHEN H, PAN CD, et al., 2017. Transcriptome analysis for walnut seed during oil synthesis period[J]. J Fruit Sci, 34(9):1084-1094.[杨丽, 陈虹, 潘存德, 等,2017. 核桃种子油脂转化期转录组分析[J]. 果树学报, 34(9):1084-1094.]
YUAN L, VOELKER TA, HAWKINS DJ, 1995. Modification of the substrate specificity of an acyl-acyl carrier protein thioesterase by protein engineering[J]. Proc Natl Acad SciUSA, 92(23):10639-10643.
ZEVALLOS VF, JULIA EH, SULIGOJ T, et al., 2012. Variable activation of immune response by quinoa (Chenopodium quinoa Willd.) prolamins in celiac disease[J]. Am J Clin Nutr, 96(2):337-344.
ZHANG M, MI TZ, ZHEN Y, et al., 2018. Description of fatty acid synthesis pathway based on Skeletonema marinoi transcriptome[J]. Period Ocean Univ Chin, 48(4):81-93.[張梅, 米铁柱, 甄毓, 等, 2018. 基于玛氏骨条藻转录组的脂肪酸合成途径分析[J]. 中国海洋大学学报, 48(4):81-93.]
ZOU C, CHEN A, XIAO L, et al., 2017. A high-quality genome assembly of quinoa provides insights into the molecular basis of salt bladder-based salinity tolerance and the exceptional nutritional value[J]. Cell Res, 27(11):1327-1340.
(责任编辑 蒋巧媛)

