拟草果总黄酮制备纯化及抗炎活性研究
柴玲 陈明生 袁健童 冯军 刘布鸣


摘 要:该文在前期研究的基础上,以拟草果的甲醇粗提液为原料,研究拟草果总黄酮成分的纯化方法以及考察拟草果总黄酮的抗炎活性。结果表明:通过静态吸附-洗脱试验,筛选出HP-20为纯化拟草果总黄酮的最佳大孔吸附树脂;以吸附率、解吸率等参数为指标,考察上样液和洗脱液的质量浓度、体积、流速等因素对纯化工艺的影响,确定最佳工艺条件为上样液质量浓度0.5 mg·mL-1、上样体积流量4 mL·min-1、上样体积15 BV、洗脱剂乙醇浓度70%、洗脱流速2 mL·min-1、洗脱剂用量10 BV,在此条件下纯化的总黄酮保留率为65.48%;通过检测获得的拟草果总黄酮对脂多糖刺激的小胶质BV2细胞中白介素(IL)-6水平的影响,发现其可显著下调炎症因子IL-6的表达,具有一定的抗炎活性。
关键词:拟草果, 总黄酮, 大孔吸附树脂, 纯化工艺, 抗炎活性
中图分类号:Q946
文献标识码:A
文章编号:1000-3142(2020)12-1706-06
Abstract:This article aimed to develop a separation and purification method for the total flavonoids of the methanol extraction from Amomum paratsao-ko, and the anti-inflammatory activity of total flavonoids from A. paratsao-ko was also investigated. The static adsorption-elution test screened out the HP-20 as the best macroporous adsorption resin for purifying the total flavonoids of A. paratsao-ko. The comprehensive scores of adsorption and desorption rates were used as the indexes to determine the optimal purification process parameters as follows:the concentration of the upper column sample solution 0.5 mg·mL-1, the sample flow rate 4 mL·min-1, and the upper column volume 15 BV, 70% ethanol 10 BV for elution, the elution flow rate 2 mL·min-1. The obtained total flavonoids of A. paratsao-ko were evaluated for the anti-inflammatory activity via examination of the effect on IL-6 in LPS-stimulated BV2 microglial cells. The results showed that the total flavonoids of A. paratsao-ko significantly inhibit IL-6 expression in the LPS-stimulated BV2 microglial cells.
Key words:Amomum paratsao-ko, total flavonoids, macroporous adsorption resin, purification process, anti-inflammatory activity
擬草果又称白草果或广西草果,是壮药中的一个常用品种,为姜科豆蔻属植物拟草果(Amomum paratsao-ko)的干燥成熟果实,主产于亚热带气候的广西、云南等省(区),在广西主产地为那坡县壮族集居地,靖西、隆林等地也有零散分布(广西壮族自治区中医药研究院,1984;中国科学院中国植物志编辑委员会,1992)。拟草果收载于广西壮族自治区壮药质量标准(第3卷)(广西壮族自治区食品药品监督管理局,2017),壮民将其作为草果的代用品用于烹饪提香或者民间药用,用以治疗反胃呕吐、脘腹胀满冷痛、痰饮、积食、疟疾等症。拟草果虽然在广西有着长期的民间使用基础和广阔的种植面积,但目前针对其化学物质基础方面的研究却较少(覃兰芳等,2014;黄云峰等,2014),对拟草果的开发利用也相对滞后。
本课题组前期药理活性试验研究发现,拟草果具有较好的抗炎镇痛作用(柴玲等,2017,2018)。其后通过化学成分研究,从拟草果中分离得到以鼠李柠檬素为代表的、较大量系列的黄酮醇类化合物(柴玲等,2018)。因此,推测拟草果中的主要抗炎活性成分为黄酮类化合物。本文在前期研究的基础上,研究拟草果黄酮类成分的纯化工艺,并采用体外试验,探讨拟草果总黄酮的体外抗炎活性,以期为拟草果的综合开发利用提供研究基础。
1 材料与方法
1.1 仪器和试剂
仪器:UV2550紫外-可见分光光度计(日本岛津仪器公司);KQ-5200B超声波清洗器(昆山市超声仪器有限公司);RE-5210A旋转蒸发仪(上海亚荣生化仪器厂);HH-S恒温水浴锅(常州万科仪器科技有限公司)。试剂:鼠李柠檬素对照品(试验室前期制备获得,纯度≥98%);AB-8、D101型大孔吸附树脂(北京慧德易科技责任有限公司);HP-20型大孔吸附树脂(北京绿百草科技发展有限公司);水为超纯水;甲醇、无水乙醇(分析纯,广东光华科技股份有限公司);DMEM高糖培养基、胎牛血清、胰酶(美国GBICO公司);BDTM Cytometric Bead Array (CBA) Human Inflammation Kit、BDTM Cytometric Bead Array (CBA) Mouse Inflammation Kit试剂盒(美国BD公司)。
拟草果果实于2017年9月采集于广西那坡县,经广西中医药研究院中药资源研究所黄云峰副研究员鉴定为姜科豆蔻属植物拟草果(Amomum paratsao-ko S. Q. Tong et Y. M. Xia)。
1.2 方法
1.2.1 供试品溶液的制备 取拟草果粗粉200.3 g,加入2 000 mL甲醇摇匀,水浴回流60 min后过滤,滤液减压蒸干并用适量甲醇溶解定容至1 000 mL,作为母液,4 ℃下保存备用。取母液1 mL用甲醇稀释至50 mL,作为供试品溶液。
1.2.2 标准曲线的绘制 精密称取鼠李柠檬素对照品1.26 g,置10 mL容量瓶中,甲醇溶解并定容至刻度,作为对照品储备液。用移液管依次移取对照品储备液0.4、0.8、1.2、1.6、2.0、2.4 mL,并用甲醇分别稀释至10 mL,制成5.04、10.08、15.12、20.16、25.20、30.24 mg·mL-1浓度梯度的标准品溶液。取上述系列浓度的标准品溶液,在紫外359 nm处按浓度由低到高依次测定吸光度A,绘制标准曲线。
1.2.3 总黄酮含量的测定 取供试品溶液,按照1.2.2的方法进行测定,根据回归方程计算样品中总黄酮的质量浓度。
1.2.4 树脂预处理 先取三种不同型号(HP-20、AB-8、D101)的大孔树脂,加入适量95%乙醇浸泡,搅拌使分散均匀后静置24 h;再按傅春燕等(2015)对大孔树脂的处理方法进行预处理;最后用95%乙醇浸泡储存,试验使用前用蒸馏水洗至无醇味。
1.2.5 大孔树脂纯化拟草果总黄酮的工艺优化 以不同类型树脂对拟草果总黄酮的吸附率和解吸率为评价指标,通过静态吸附和解吸附试验筛选出最适合拟草果总黄酮纯化的树脂类型,并采用单因素试验考察不同的上样条件和洗脱条件,对拟草果总黄酮的纯化工艺进行优选。
1.2.5.1 静态吸附和解吸附试验筛选最优大孔树脂 取按1.2.4项下预处理好的三种大孔树脂,分别以蒸馏水洗去乙醇,抽滤并吸干其表面水分后各称取3.0 g,精密称定,分别置于3个250 mL锥形瓶中;另取1.2.1项下适量母液蒸干,用水溶解混匀,配制成0.975 mg·mL-1、60 mL的上样液各3份,加入上述装有三种树脂的锥形瓶中,置全温振荡培养箱中,30 ℃、120 r·min-1震荡吸附24 h,待大孔树脂吸附饱和后,过滤并吸取一定体积的上清液,按1.2.3项方法测定其总黄酮浓度,以此推算树脂对总黄酮的吸附率;过滤后大孔树脂放入250 mL锥形瓶中,加入50 mL 95%乙醇溶液进行解吸附,于24 h后吸取一定体积的乙醇溶液,测定其中的总黄酮含量,计算树脂对总黄酮的解吸率。
1.2.5.2 上样液质量浓度对动态吸附性能的影响 按每份35 mL的湿体积量取HP-20型大孔树脂共6份,湿法装柱;按1.2.5.1项分别配制浓度为0.2、0.3、0.4、0.5、0.6、0.7 mg·mL-1的上样液100 mL,以1 mL·min-1的流速上样。分别收集流出液,蒸干后用甲醇溶解并定容至50 mL,测定流出液的总黄酮浓度,计算不同浓度上样液中总黄酮在HP-20树脂中的吸附率。
1.2.5.3 上样流速对总黄酮吸附率的影响 按每份35 mL湿体积量取HP-20型大孔树脂共4份,分别装柱,按1.2.5.1项配制4份浓度均为0.5 mg·mL-1、100 mL的上样液,分别以1、2、3、4 mL·min-1的流速上样,按1.2.5.2项收集流出液并测定其总黄酮浓度,考察不同上样流速对总黄酮在HP-20树脂中吸附率的影响。
1.2.5.4 上样体积的考察 量取35 mL湿体积的HP-20树脂装柱;按1.2.5.1项配制0.5 mg·mL-1的上样液700 mL (20 BV),以4 mL·min-1的流速连续上样,按2~3 BV的柱体积收集流出液共9份,测定每份流出液中的总黄酮浓度,计算泄露百分数。
1.2.5.5 洗脱液浓度对树脂解吸率的影响 量取35 mL湿体积的HP-20树脂4份,分别装柱;按1.2.5.1项配制0.5 mg·mL-1的上样液525 mL,以4 mL·min-1流速上样,上样完成后先用350 mL(10 BV)蒸馏水洗脱,再以2 mL·min-1的洗脱流速用浓度分别为30%、50%、70%、90%的乙醇依次洗脱10 BV。分别收集不同浓度乙醇洗脱下来的流出液,浓缩后测定其总黄酮含量并计算解吸率。
1.2.5.6 洗脱液流速对树脂吸附率的影响 量取35 mL的HP-20树脂4份,分别装柱;取0.5 mg·mL-1的上样液525 mL,以4 mL·min-1流速上样,上样完成后先用10 BV蒸馏水洗脱,再用70%乙醇10 BV分别以1、2、3、4 mL·min-1的流速洗脱,分别收集不同洗脱流速下的洗脱液,测定总黄酮含量并计算解吸率。
1.2.5.7 洗脱液用量的工艺考察 量取35 mL湿体积的HP-20树脂,湿法装柱;取0.5 mg·mL-1的上样液525 mL,以4 mL·min-1流速上样,蒸馏水洗脱后,以525 mL、70%乙醇和2 mL·min-1的洗脱流速连续洗脱,分批收集洗脱液,每35 mL(1 BV)为1份。以洗脱体积(BV)为横坐标,每份洗脱液中的总黄酮含量(mg·mL-1)为纵坐标绘制洗脱曲线。
1.2.5.8 驗证试验 根据1.2.5.2~1.2.5.7单因素试验确定的最佳上样和洗脱条件,以树脂对拟草果总黄酮的保留率为考察指标进行平行试验(n=3),验证试验的可重复性。
1.2.6 抗炎活性试验 鼠源神经小胶质BV2细胞,采用DMEM高糖培养基(含10% FBS,1%青霉素和1%链霉素),于37 ℃,含5% CO2,饱和湿度条件下的细胞培养箱中培养。细胞为贴壁生长,根据细胞生长情况换液,以0.25%胰酶消化传代,试验前将细胞接种于12孔板,接种细胞数每1 mL为106个,孵育6~9 h后换液加入LPS或DMSO,2 h后加入10 μmol·L-1浓度的化合物孵育24 h,收集细胞上清进行CBA检测。每个样本设3个复孔。
2 结果与分析
2.1 静态吸附和解析附试验筛选最优大孔树脂
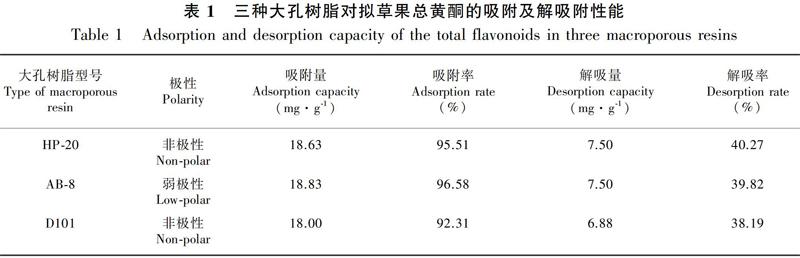
表1展示三种不同型号的大孔树脂对拟草果总黄酮吸附及解吸附试验的筛选结果。从表1可以看出,HP-20型大孔树脂对总黄酮的吸附率在三种树脂中属中等水平,但其解吸率在三者中最高。因此,在后续研究中以HP-20型大孔树脂为最优树脂进行工艺考察。
2.2 HP-20型大孔树脂对拟草果总黄酮纯化工艺的单因素考察
2.2.1 上样液质量浓度对动态吸附性能的影响 表2展示上样不同浓度的上样液后流出液中总黄酮浓度的变化。从表2可以看出,随着上样液中总黄酮浓度的增加,HP-20树脂对其吸附率也逐渐增加,上样浓度为0.5 mg·mL-1时,吸附率达到最大值98.30%。上样液浓度再次增加时,吸附率开始下降,可能是由于水液饱和,上样液呈絮状沉淀较多,树脂无法吸附,从而导致水洗时沉淀颗粒随水洗液洗出,吸附率下降。因此,确定最佳上样浓度为0.5 mg·mL-1。
2.2.2 上样流速对总黄酮吸附率的影响 表3展示不同的上样流速对总黄酮在HP-20树脂中吸附率的影响。从表3可以看出,上样流速为2.0~4.0 mL·min-1时,随着上样流速增大吸附率逐渐增大。上样流速为1.0 mL·min-1时,吸附率较高的原因可能是由于流速慢吸附时间长,或是流速慢水液停留时间长,在树脂上表面形成沉淀和大颗粒沉淀物,水洗不完全。综合考虑认为,缩短上样时间,提高上样效率,确定4.0 mL·min-1为最佳上样流速。
2.2.3 上样体积对流出液总黄酮浓度的影响 由图1可知,随着上样量的增加泄露百分数呈增大趋势,其中上样体积为15 BV时泄露百分数趋于平稳,上样体积达17 BV时泄露百分数逐渐下降,但仍未达到泄露点,即泄露百分数10%。考虑到水液保存时间较短,且试验缺乏自动上样设备,上样时间过长影响试验效果。因此,确定525 mL,即15 BV的柱体积为最佳上样体积。
2.2.4 洗脱液乙醇的浓度对总黄酮在HP-20树脂中解吸率的影响 由表4可知, 随着洗脱剂浓度的增大洗脱率也逐渐增大, 洗脱剂浓度为70%、90%时洗脱率变化不大,为节省乙醇用量,确定70%乙醇浓度为最佳洗脱浓度。
2.2.5 洗脱流速的考察 表5展示不同洗脱流速下的总黄酮在HP-20树脂中的解吸附效果。由表5可知,随着洗脱流速的增大洗脱率先缓慢增大,随后呈下降趋势,当洗脱流速为2.0 mL·min-1时洗脱率最大。因此,取2.0 mL·min-1为最佳洗脱流速。
2.2.6 洗脱液乙醇用量的考察 图2展示洗脱液乙醇的用量(洗脱体积)对流出液总黄酮浓度的影响。由图2可知,洗脱含量随洗脱量增加呈先增大后下降的趋势,在洗脱量达10 BV时洗脱含量开始下降并趋于洗脱终点。因此,在尽可能节省洗脱剂的条件下,确定10 BV(350 mL)为最佳洗脱量。
2.2.7 验证试验 称取湿体积35 mL的HP-20型大孔树脂湿法上柱,加样0.5 mg·mL-1的上样液15 BV到色谱柱中,调节上样流速为4 mL·min-1,上样完成后用1 BV的蒸馏水洗涤,接着用70%乙醇10 BV进行洗脱。平行3次试验,测得总黄酮保留率分别为67.86%、64.29%、64.29%,平均值为65.48%,RSD值为3.15 %,表明重复性较好。
2.3 抗炎活性试验
拟草果总黄酮对炎症因子IL-6表达的影响见表6。从表6可以看出,拟草果总黄酮提取物能显著抑制炎症因子IL-6表达,具有一定的抗炎活性。
3 讨论
弱极性、非极性的吸附树脂对黄酮类化合物具有较好的提取性能(Wu et al., 2015)。因此,本研究中,我们选择了三种不同型号和极性的大孔树脂对拟草果中的总黄酮进行了吸附和解吸试验, 其中非极性的HP-20树脂在吸附率和解吸率上均优于另外两种树脂。因此, 确定了HP-20型大孔树脂是分离纯化拟草果总黄酮的最优树脂。
通过单因素试验,确定了拟草果总黄酮纯化的最佳工艺条件:上样浓度为0.5 mg·mL-1、上样体积为15 BV、上样体积流速为4 mL·min-1、乙醇洗脱浓度为70%,洗脱体积流速为2 mL·min-1、乙醇洗脱用量为10 BV。拟草果提取液经HP-20型大孔树脂纯化后,总黄酮含量由9.735 mg·g-1提升至平均50.526 mg·g-1,提高了5.19倍,表明本研究中大孔树脂纯化工艺对拟草果总黄酮的纯化效果较好。
体外抗炎试验结果表明,拟草果总黄酮提取物可显著抑制炎症因子IL-6表达,具有一定的抗炎活性。本研究结果可为拟草果药材资源的开发利用及提高其应用价值提供数据和科学依据。
参考文献:
CHAI L, LIN X, LI YJ, et al., 2017. Anti-inflammatory activity research of the ethyl acetate extracts from Amomum paratsao-ko [J]. Res Pract Chin Med, 31(3):32-35.[柴玲, 林霄, 李燕婧, 等, 2017. 擬草果乙酸乙酯部位抗炎作用及机制研究[J]. 现代中药研究与实践, 31 (3):32-35.]
CHAI L, LIN X, LI YJ, et al., 2018. Anti-inflammatory and analgesic effects of methanol extracts from nicaoguo (Amomum paratsao-ko S. Q. Tong et Y. M. Xia)[J]. Guid J Trad Chin Med Pharm, 24 (10):88-89.[柴玲, 林霄, 李燕婧, 等, 2018. 拟草果甲醇提取物抗炎镇痛作用研究[J]. 中医药导报, 24 (10):88-89.]
CHAI L, LIN X, LIANG BZ, et al., 2018. Chemical constituents from fruits of Amomum paratsao-ko [J]. Chin Trad Herb Drugs, 49(14):3217-21.[柴玲, 林霄, 梁柏照, 等, 2018. 拟草果化学成分研究[J]. 中草药, 49(14): 3217-21.]
FU CY, LIU YH, YANG L, et al., 2015. Purification and antidepression activity of total flavonoids from Fissistigma oldhamii [J]. Nat Prod Res Dev, 27(8):1441-1447.[傅春燕, 刘永辉, 杨林, 等, 2015. 大孔树脂纯化瓜馥木总黄酮工艺及抗抑郁活性研究[J]. 天然产物研究与开发, 27(8):1441-1447.]
Guangxi Zhuang Autonomous Region Food and Drug Administration, 2017. Guangxi Zhuang Autonomous Region Zhuang Medicine Quality Standard (Vol. 3)[M]. Nanning:Guangxi Science and Technology Publishing House.[广西壮族自治区食品药品监督管理局, 2017. 广西壮族自治区壮药质量标准(第3卷)[M]. 南宁:广西科学技术出版社.]
Guangxi Traditional Chinese Medicine Resources Survey Office, 1993. List of medicinal resources in Guangxi[M]. Nanning:Guangxi Nationalities Publishing House.[广西中药资源普查办公室, 1993. 广西药用资源名录[M]. 南宁:广西民族出版社.]
HUANG YF, QIN LF, HU QM, et al., 2014. Gas chromatogrphy-mass spectrometry analysis of essential oil from Amomum tsao-ko Crevost et Lemarie and Amomum paratsao-ko S. Q. Tong et Y. M. Xia grow in Guangxi [J]. Res Pract Chin Meds, 28 (2):22-24.[黃云峰, 覃兰芳, 胡琦敏, 等, 2014. 广西红草果与白草果挥发油的GC-MS分析[J]. 现代中药研究与实践, 28 (2):22-24.]
QIN LF, HUANG YF, HU QM, et al., 2014. Gas chromatogrphy-mass spectrometry analysis of essential oil from Amomum paratsao-ko S. Q. Tong et Y. M. Xia[J]. Guid J Trad Chin Med Pharm, 20(11):23-25.[覃兰芳, 黄云峰, 胡琦敏, 等, 2014. 拟草果挥发油的GC-MS分析[J]. 中医药导报, 20 (11):23-25.]
Delecti Florae Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita, 1992. Flora Reipublicae Popularis Sinicae (Vol. 61)[M]. Beijing:Science Press.[中国科学院中国植物志编辑委员会, 1992. 中国植物志(第61卷)[M]. 北京:北京科学出版社.]
WU SH, WANG YY, GONG GL, et al., 2015. Adsorption and desorption properties of macroporous resins for flavonoids from the extract of Chinese Wolfberry (Lycium barbarum L.)[J]. Food Biop Proc, 93:148-155.
(责任编辑 蒋巧媛)

