肥桃流胶病病原鉴定
吕孟辕彭骋张东刘洪明何邦令刘会香
(1.山东农业大学植物保护学院/山东省林业有害生物防控工程技术研究中心,山东泰安 271018;2.泰安市泰山景区桃花峪管理区,山东泰安 271000)
肥桃Prunus persica‘Feicheng'是山东省肥城市乃至全国独特的桃品种,是中国水果名优特产之一。种植面积达到了近7 000 hm2,年产量1.6 亿公斤,经济和社会效益显著。近几年来,肥桃流胶病发生严重,对肥桃的生产、销售造成了极大影响。
多数学者认为桃树流胶病是生理现象,属于非侵染性病害[1]。20 世纪 70 年代,Weaver 第 1 次分离出Botryosphaeria dothidea,人们才发现真菌可导致桃树流胶病的发生[2]。1863 年葡萄座腔菌属才被正式定义[2]。在上海、广州、湖北等南方桃产区陆续发现Physalospora persicae[3]、Botryosphaeria dothidea[4]、Cucurbitaria[5]、Leptosphaeria[5]等属真菌也导致桃流胶病。多种报道认为葡萄座腔菌属真菌Botryosphaeriaspp.可引起桃流胶病[6-9]。B.dothidea进入寄主组织可通过皮孔,气孔或树皮上小的伤口途径侵入[10]。大量研究表明,温度、湿度是影响桃流胶病发生的重要因素[11],气温高、降雨量大是春夏桃流胶暴发的主要原因,入冬后,低温、少雨等因素抑制病害发生[12-17]。
笔者首次对肥城桃树流胶病的发病情况进行了全面调查,通过大量样本采集和分离鉴定明确了肥桃流胶病病原的分类地位,以期为肥桃流胶病的科学防控提供参考依据。
1 材料与方法
1.1 试验方法
1.1.1 发病情况调查 2017 年9 月在肥城市的西尚里村、东尚里村、刘台村景区、南尚里村和桃园镇肥桃种植区5 个主要肥桃产区中选取多年生桃树,每个肥桃产区按照东南北四个方位分别选取4 个桃园,每个方位的桃园选取15 棵树势相似、栽培条件相同的桃树进行桃流胶病的发病率及发病程度的调查与统计。每次每个种植区调查60 株,计算发病率和病情指数。
发病率(%) =发病总株数/调查总株数×100
病情指数 = ∑(各级病株数 × 相应病级值)/(调查总株数×最高病级值) ×100
桃流胶病发病程度的分级标准,参考罗江会[1]制定的桃流胶病害分级标准。
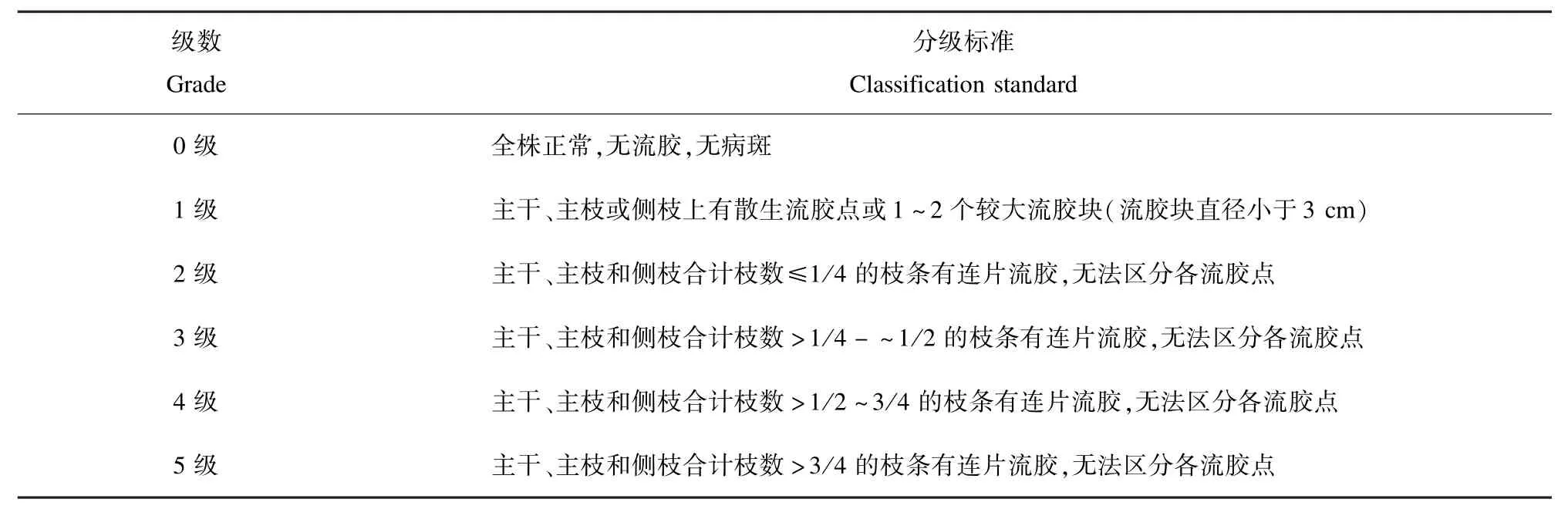
表1 桃流胶病病害分级标准Tab.1 The classification standard of peach gummosis disease
1.2 样本采集 2016—2018 年共6 次在山东省肥城市的西尚里村、东尚里村、刘台村景区和南尚里村、桃园镇肥桃种植区5 个主要肥桃产区,分别选取典型桃园内5 个采样点的不同方位(东、南、西、北、中),采用随机取样的方法,在每个桃园采集5 组具有典型症状的病枝,共计125 个病枝作为试验材料并编号。
1.3 病原菌的分离与纯化 采用组织分离法进行病原菌分离[18]。每个病枝分离25 个病健交界组织,放置于 PDA 平板放入28 ℃生化培养箱培养[19]。5 d 后,观察病组织分离情况,统计微生物的种类和数量。将上述分离的微生物,按照不同类型进行纯化培养,获得单一的微生物。
1.4 病原菌的鉴定
1.4.1 培养特性观察 分离纯化的菌株继续在28 ℃下培养。观察记录菌丝形态、菌落边缘特征、菌落颜色变化特征。
1.4.2 形态学特性观察 供试菌株在PDA 培养基上观察其子实体大小、颜色等形态,显微镜下观察病菌分生孢子器和分生孢子大小、形状和颜色等形态,分别测定100 个分生孢子器和分生孢子。
1.4.3 ITS 序列鉴定 采用2 ×CTAB 法进行基因组的 DNA 提取,采用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS4(5′- TCCTCCGCTTATTGATATGC-3′) 进行 PCR 扩增[20],经过琼脂糖凝胶电泳,将上述所获得的PCR 产物经纯化后送公司测序,获得的序列与GenBank 核酸数据库中相关菌株进行比对,用MEGA5.0 软件构建系统发育树,对ITS 基因序列数据进行NJ(Neighbor Joining)分析,以启发式搜索获得系统发育树,鉴定病原菌种类和分类地位。
1.5 致病性测定 从7 种类型的分离菌株中各挑选1 个典型菌株分离纯化后,选取3 个菌株重复,按照柯赫氏法则,分别接种到与分离物来源一致的肥城红里桃2 a 生健康枝条上,7 d 后确定分离物致病性。采用离体刺伤接种法。剪取红里肥桃15 cm 长的2 a生枝条,用清水冲洗后用75 %酒精进行表面消毒,无菌水漂洗3 次后用吸水纸吸干水分;用无菌针在枝条中间部位针刺5 针,将准备好的菌丝块接种于伤口处,以PDA 琼脂块同样处理接种为对照;于25 ℃条件下培养。测量7 d 时枝条病斑长度,比较不同分离菌株的致病力大小,根据柯赫氏法则,对枝条发病病斑进行再分离,观察分离得到的病菌是否与原接种菌株相同。
2 结果与分析
2.1 肥桃流胶病发病情况 基于2017 年对5 个主要肥桃产区的肥桃流胶病田间症状调查,肥城市肥桃流胶病发生较为严重,肥城桃产区平均发病率为61.77%,最高发病率 88.0%;平均病情指数为24.9,最高病情指数为26.9(表2)。
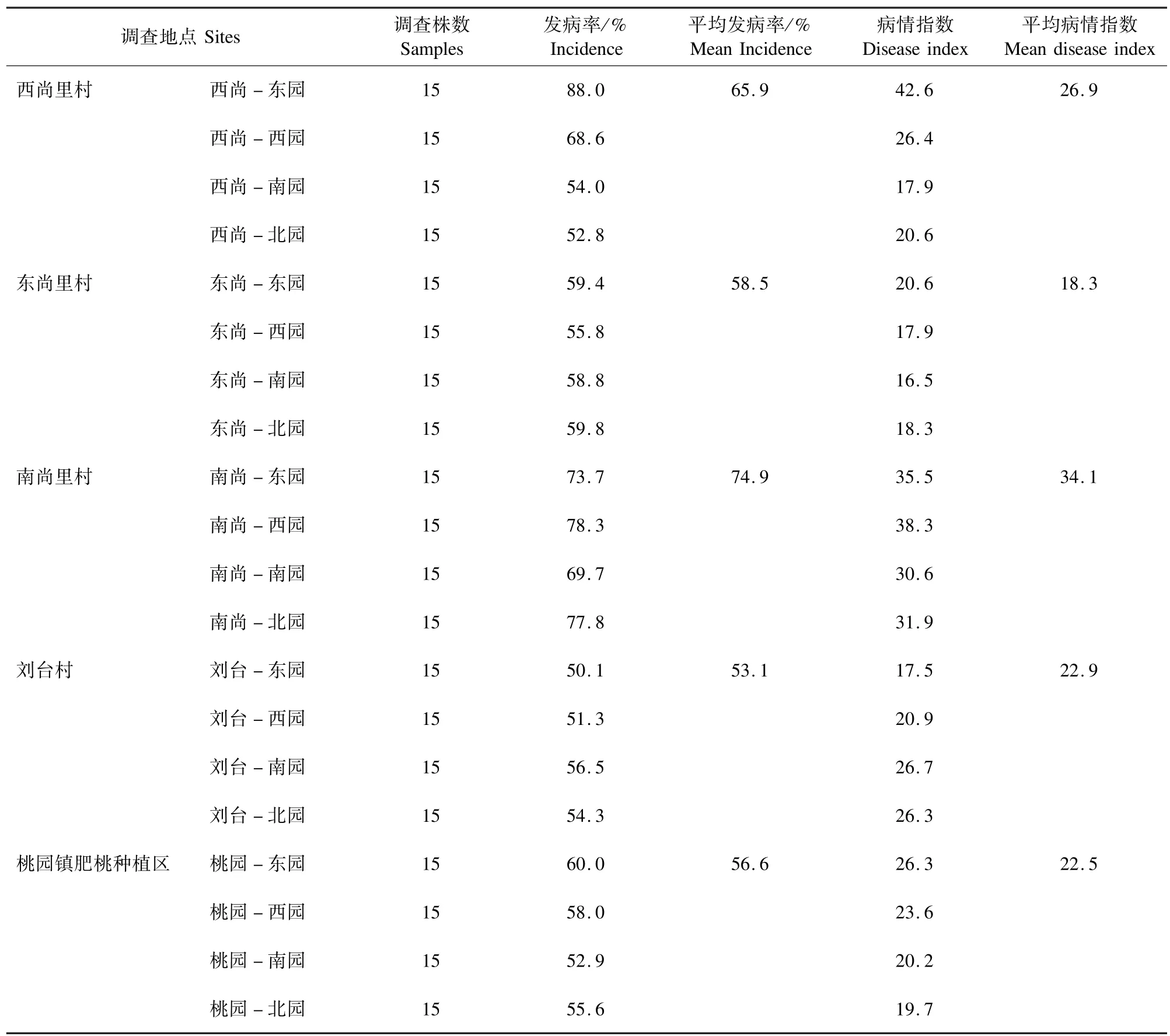
表2 肥城市各桃园肥桃流胶病发病率和病情指数Tab.2 Incidence rate and disease index of peach tree gummosis disease in Feicheng city
2.2 肥桃流胶病病原鉴定
2.2.1 采集分离纯化获得的病原菌株 2016—2018 年通过对125 个病枝分离纯化后共获得160个菌株,根据培养特征分为7 个类型,其分离纯化结果见表3。类型1 和类型4 是病斑上分离到的优势菌株,其他菌株是偶发的菌株。
2.2.2 病斑分离物菌落培养特性
类型1 菌株生长较为旺盛,菌落生长速度快,菌丝呈棉絮状;中部菌丝较外缘菌丝旺盛,菌丝初为白色,后由中心向四周辐射状变黑;最终整个菌落呈现墨黑色。
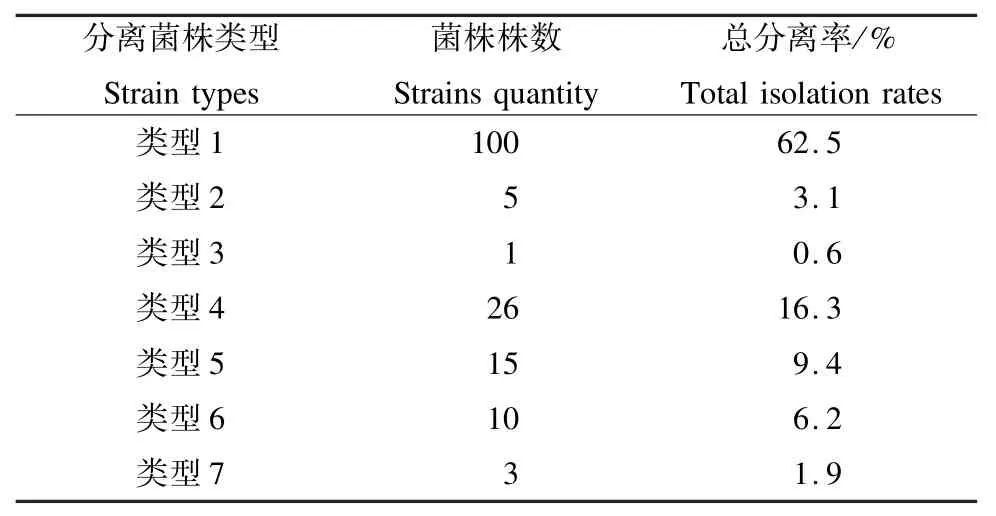
表3 肥桃流胶病菌株分离结果Tab.3 Isolation result of pathogen from peach gummosis spots
类型2 菌株菌丝生长相对平缓,菌落扁平;菌丝初为白色后颜色逐渐变深直至变为黑色。
类型3 菌株菌丝生长非常旺盛,后期菌丝可生长至培养皿顶端,整个菌落呈棉絮状,菌丝颜色变化为先白后黑。
类型4 菌株菌丝生长平缓,呈绒毛状,菌丝初为白色,后逐渐呈辐射状变红,直至整个菌落呈砖红色。
类型5 菌株菌丝白色,生长平缓;外围菌丝较内部菌丝旺盛。
类型6 菌株菌丝白色,匍匐,中部菌丝比四周菌丝生长旺盛。
类型7 菌株菌丝疏松、生长旺盛,菌落外围一圈菌丝生长旺盛,菌丝颜色初为白色,后逐渐变为浅红色。
7 个类型菌株的培养菌落形态见图1。
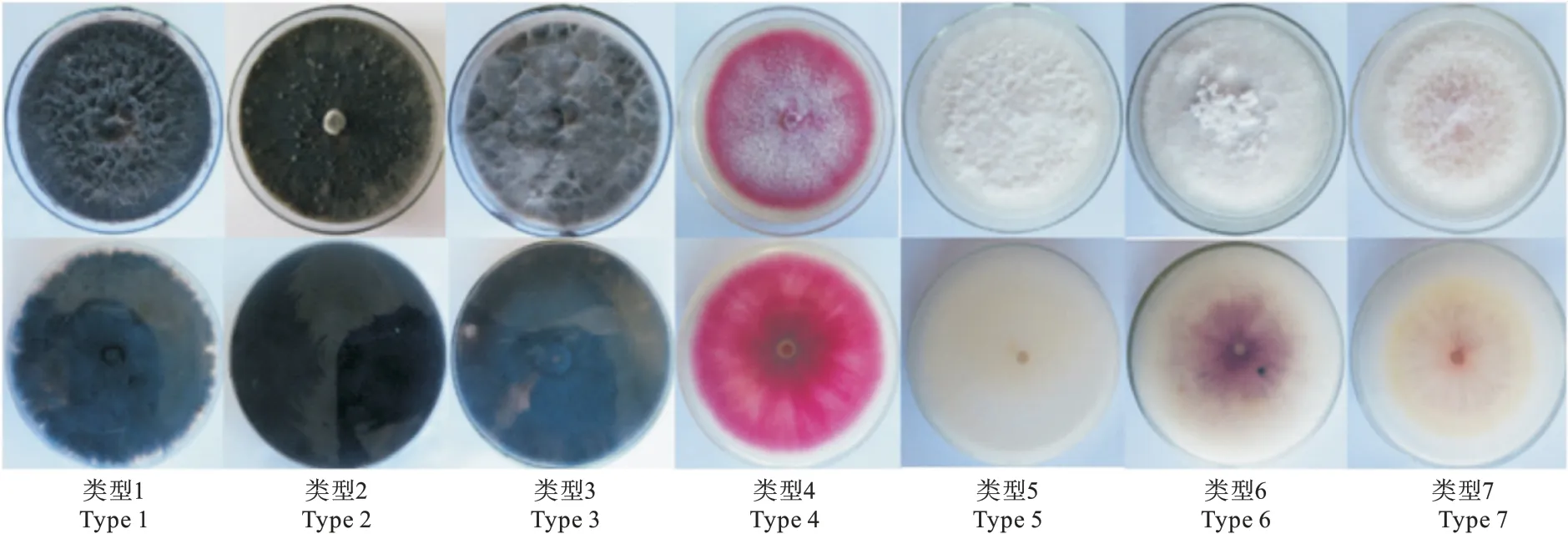
图1 肥桃流胶病病斑分离物菌落培养特征Fig.1 Culture characteristics of strains isolated from peach gummosis disease spots
2.2.3 病斑分离物的形态学特性 显微镜下,部分菌株的子实体形态见图2;7 种类型菌株的分生孢子形态见图3;7 种类型菌株的分生孢子器和分生孢子形态描述如表4。
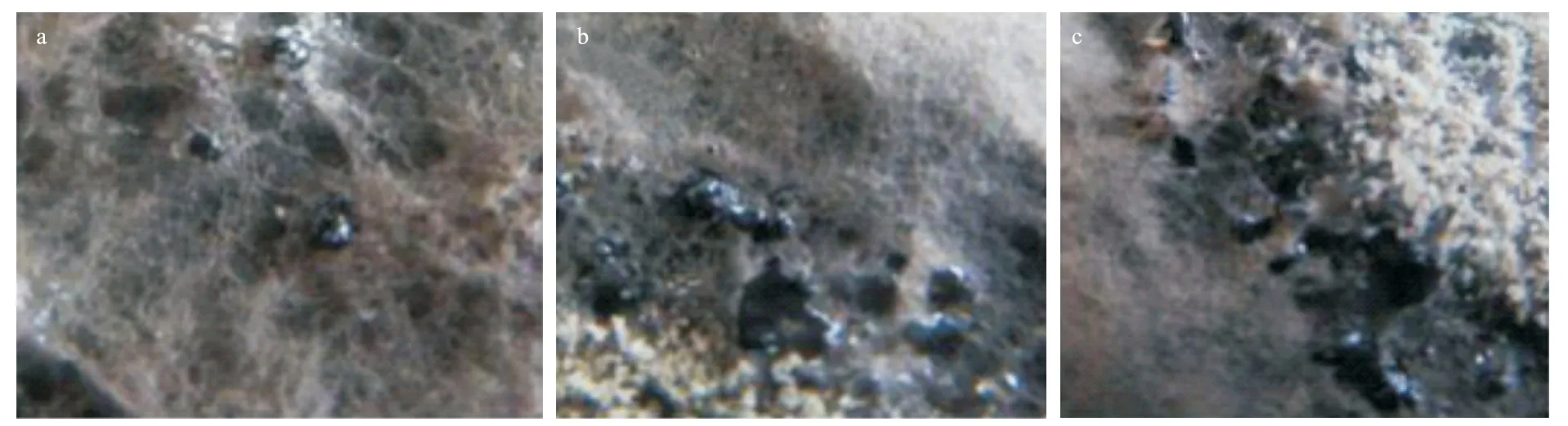
图2 肥桃流胶病病斑分离菌株子实体形态学特征Fig.2 Morphological characteristics of fruiting body of strains isolated from peach gummosis disease spots


图3 肥桃流胶病病斑分离菌株分生孢子形态学特征Fig.3 Morphological characteristics of conidiospore of isolated strains from peach gummosis disease spots
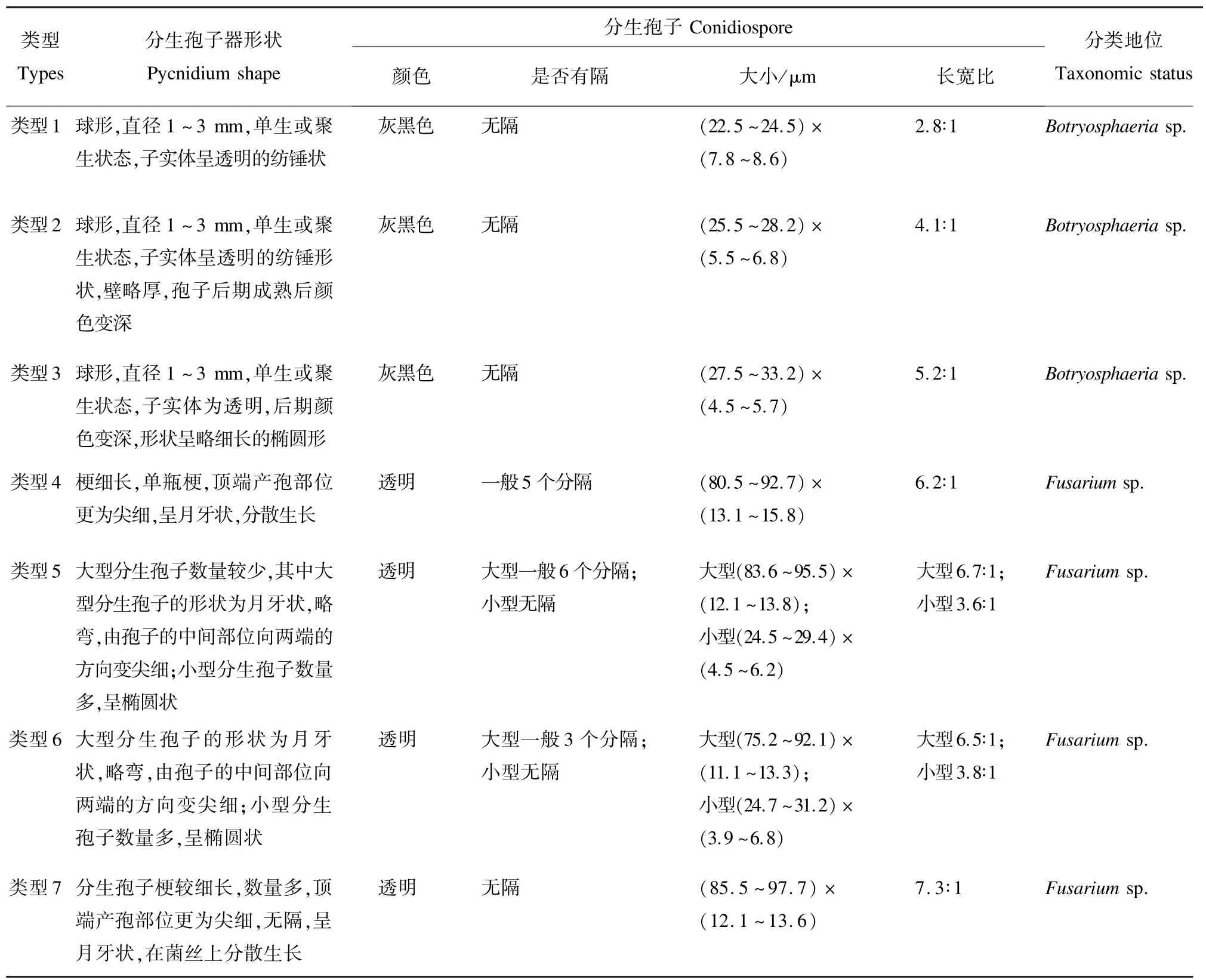
表4 肥桃流胶病病斑分离物形态学特征Tab.4 Morphological characteristics of strains isolated from peach gummosis disease spots
2.2.4 病原菌分子鉴定 从分离菌株的rDNA-ITS的PCR 扩增、BLAST 序列比对结果(图4)可以看出类型1(菌株 T1、T9、T15、T16、T19、T22)与Botryosphaeria dothidea序列相似性100%;类型2(菌株L11) 与Lasiodiplodia theobromae的序 列 相 似性98%;类型3(菌株T7)与B.obtusa(无性态为Diplo-dia seriata) 的序列相似性 99%;类型 4 (菌株F27-2、F8-2)与Fusarium lateritium的序列相似性100%;类型5(菌株F11-3)与F.fujikuroi的序列相似性100%;类型 6(菌株 F3-3、F44-2、F13-2、F39-3)与F.proliferatum的序列相似性100%;类型7(菌株F38-2)与F.oxysporum序列相似度100%。
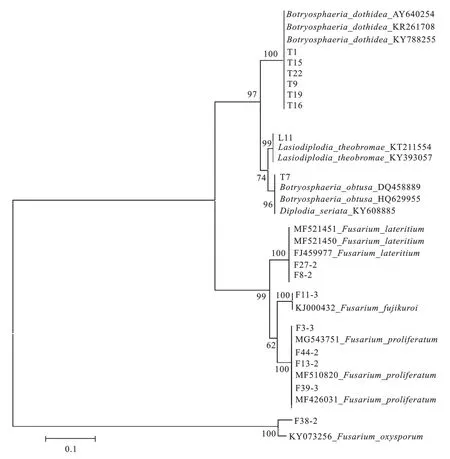
图4 基于rDNA-ITS 序列的桃树流胶病病原菌株系统发育树Fig.4 Phylogenetic tree based on rDNA-ITS sequence of isolated strains of peach gummosis disease spots
2.2.5 病原菌致病性 所有接种菌株均能引致枝条病斑出现。接种后48 h 就有水渍状病斑产生,圆形至椭圆形,随时间推移病斑由浅褐色变为褐色,且逐渐向四周扩展,病斑出现凹陷及流胶(图5)。

图5 肥桃流胶病斑分离物接种健康枝条发病症状Fig.5 Symptoms of peach gummosis disease using isolated strains inoculation in healthy shoot
对发病枝条的病斑处进行再分离及鉴定,均可获得与原接种菌株一致的病原菌,因此确定T1 菌株(B.dothidea)、T7 菌株(B.obtusa)、L11 菌株(Lasiodiplodia theobromae)、F8-2 菌株(F.lateritium)、F44-2 菌株(F.proliferatum)、F11-3 菌株(F.fujikuroi)和 F38-2 菌株(F.oxysporum)均可致肥桃流胶病发生,即B.dothidea、B.obtusa、Lasiodiplodiae theobroma、F.proliferatum、F.fujikuroi、F.oxysporum与F.lateritium7 种病原菌为肥城桃流胶病的病原菌。表5 也表明不同接种菌株致病力有差异,综合以上结果Botryosphaeria dothidea和Fusarium lateritium是引起肥桃流胶病的优势病原。
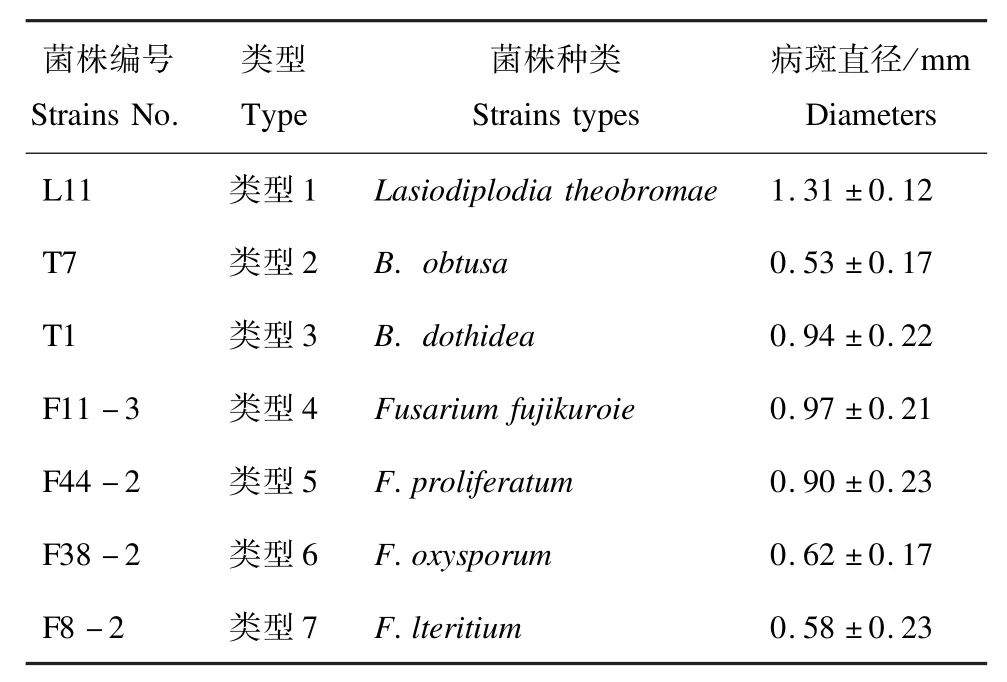
表5 接种7 d 后肥桃流胶病病斑代表分离菌株的致病性测定Tab.5 Lesion diameters in shoots inoculated with seven strains seven days after inoculation
3 讨论与结论
综合肥桃流胶病病斑分离物的培养学、形态学、ITS 序列及致病力测定,明确了肥桃流胶病可由7种真菌引起,包括B.dothidea、B.obtusa、Lasiodiplodia theobromae、F.proliferatum、F.fujikuroi、F.oxysporum与F.lateritium,其中B.dothidea和F.lateritium是优势种,其他均是偶发种,这7 种病原菌间的互作及其与肥桃流胶病的关系,尚需继续研究。
本研究中共分离出镰孢菌类菌株4 种,为F.proliferatum、F.fujikuroi、F.oxysporum与F.lateritium,在肥桃流胶病病原研究中,这是首次发现镰孢菌类真菌为致病菌。F.lateritium分离率最高,为优势病原菌。但在镰孢菌类菌株致病性测定试验中,F.lateritium的致病力却最低。F.fujikuroi与F.proliferatum的致病性差异不大,明显高于F.lateritium与F.oxysporum两类菌株。但镰孢菌种类病原菌无论分离率还是致病性均低于葡萄座腔菌。
本实验中,镰孢菌类菌株的分离比率明显低于葡萄座腔菌菌株,并且在分离过程中发现,镰孢菌类菌株与葡萄座腔菌菌株全部相伴而生,没有发现镰孢菌类菌株单独被分离的现象,由此推论葡萄座腔菌类菌株是肥桃流胶病主要病原菌,镰孢菌类菌株是伴生病原菌,可混合侵染危害。

