菠菜转录因子MYB基因家族的鉴定及表达分析
王晓珊 葛晨辉 康亚妮 王全华 徐晨曦

摘 要: 利用生物信息学手段鉴定了76个具有典型R结构的菠菜转录因子(Spinacia oleracea)MYB,其中包括72条R2R3-MYB基因(2R-MYB)和4条R1R2R3-MYB基因(3R-MYB)。通过生物信息学对菠菜MYB转录因子家族成员的理化性质、染色体定位、结构域序列保守性和系统进化关系进行了分析,结果表明:菠菜MYB家族有32个基因位于染色体正链,另外44个基因位于染色体反链;MYB的DNA结合域中的保守域主要位于两个R重复序列的第二和第三螺旋之间,结合域中每个R重复的第一和第二色氨酸之间的氨基酸序列相对不保守;根据菠菜、拟南芥及甜菜的MYB家族系统进化关系可以推测,菠菜MYB家族中56个成员可以按功能划分为4类,在菠菜的生长发育过程中可能起着重要的调节作用,其余成员中有7个MYB基因可能参与菠菜响应氮素浓度的氮素利用及生长发育进程。
关键词: 菠菜(Spinacia oleracea); 转录因子MYB; 氮素处理; 基因表达
中图分类号: S 636.1 文献标志码: A 文章编号: 1000-5137(2020)06-0677-15
Abstract: In this study,76 transcription factor genes within MYB gene family were identified.According to their structural characteristics,these MYB genes were divided into two categories,i.e.R2R3-MYB and R1R2R3-MYB.Based on the Prot Param,Soft Berry,MEGA7.0 and other online softwares were applied for bioinformatics analyses,such as physical and chemical properties,subcellular localization,and system evolution.According to their MYB conserved domain numbers,76 spinach (Spinacia oleracea) MYB genes were identified and divided into two subgroups,2R-MYB (72) and R1R2R3-MYB(4).Chromosome mapping shows,spinachs MYB family has 32 genes in the chromosome chain,the other 44 genes are located in the reverse chain of chromosomes.Conservative domain analysis shows that,the conserved domains in the MYB DNA binding domain are mainly located between the second and third spirals of the two R repeats while the amino acid sequences between the first and second tryptophan repeats of each R in the DNA binding domain are relatively unconservative.The phylogenetic analysis indicated that spinach,Arabidopsis thaliana and beet MYB transcription factor proteins can be divided into thirty-five clusters.It was speculated that the 56 members,which can be functionally divided into 4 groups,of the spinach MYB family,plays an important regulatory role in the growth and development of spinach.The seven MYB genes from other members may be involved in the process of nitrogen utilization and development in response to nitrogen concentration in spinach.
Key words: spinach (Spinacia oleracea); transcription factor MYB; nitrogen treatment; gene expression
0 引 言
MYB家族是植物最大的轉录因子家族之一,普遍参与调控植物器官发育、激素信号转导、逆境胁迫应答及植物次生代谢等多个生物学过程[1-2]。MYB家族蛋白质的共同特征是都含有高度保守的DNA结合域,即位于这些蛋白质的N端的MYB结构域。每个MYB结构域包括1~4个连续的非冗余不完全重复序列(R1,R2,R3和R4)。每个重复包含大约50~53个氨基酸,形成3个α螺旋,在第二个和第三个α-螺旋之间形成一个“螺旋-转角-螺旋”(HTH)结构[3-4]。DNA结合区以外的氨基酸序列c-末端是一个激活结构,长度和序列极其不同,这就导致了MYB蛋白功能的多样性[5-6]。基于这些结构的重复次数,MYB家族又可分为4个亚家族,分别为1R-MYB(MYB-相关),2R-MYB(R2R3-MYB),3R-MYB(R1R2R3-MYB)以及4R-MYB[7-8]。在植物中,R2R3-MYB是常见的亚家族[7,9-10],并且这些蛋白质几乎涉及植物生长发育的各个方面和阶段。例如参与拟南芥、玉米、毛竹、甜菜和菠萝等植物中[7,11-16]的种子胚发育[17]、腋芽分生组织的形成[18-19]、花瓣的形态发生[20]、花药外壁的形成[21]、雄性生殖细胞的分裂和分化[22]、雌配子体的发育、花粉管的诱导、丝状器的形成[23]、对赤霉素和茉莉酸的响应[24]、黄体酮的生物合成[25]以及次生壁的形成[26]等。研究表明:部分MYB转录因子还参与了植物氮代谢,例如拟南芥MYB转录因子PAP2受低氮胁迫的诱导而高丰度表达,通过参与花青素代谢的过程,调控氮代谢的循环通路[27]。
菠菜(Spinacia olerancea)是重要的经济作物,也是常见的喜硝植物,硝态氮是植物生长的主要氮素来源[28]。硝态氮也作为信号分子参与植物体内许多生理代谢过程[29-30],植物中碳氮比的变化是影响植株开花及花芽的因素之一[31]。菠菜是雌雄异株植物,性型分化复杂,受环境因素调控明显,目前关于硝态氮及碳氮比对菠菜性别分化的影响未見报道。本研究利用生物信息学手段筛选、分析了菠菜MYB 转录因子家族基因,及菠菜MYB转录因子在不同氮处理下的表达模式,为后续菠菜MYB基因参与氮代谢及性别分化的功能研究提供重要基础。
1 材料与方法
1.1 菠菜SoMYBs家族基因的检索、鉴定与理化性质分析
从拟南芥种质信息数据库(http://www.arabidopsis.org/)下载拟南芥MYB基因家族蛋白质序列,从菠菜种质信息数据库(http://www.spinachbase.org/)下载菠菜MYB家族基因CDS和蛋白质序列,从植物转录因子数据库数据库(http://planttfdb.cbi.pku.edu.cn/)下载MYB结构域序列。以拟南芥MYB蛋白为探针在菠菜蛋白数据库中进BlastP搜索得到候选菠菜基因。在Expasy网站(https://prosite.expasy.org)、Pfam网站(http://pfam.xfam.org/)和、EBI网站(http://www.ebi.ac.uk/)逐条鉴定这些候选菠菜基因的R结构重复区,含有R重复区则记为MYB家族;若含有一个残缺或完整的R结构,则记为MYB-相关(MYB-related)家族。
在Expasy网站(https://web.expasy.org/protparam/)得到菠菜MYB基因家族的蛋白质等电点及相对分子质量。在菠菜种质信息数据库(http://www.spinachbase.org/)查找基因在染色体上的位置。在亚细胞定位预测网站(https://wolfpsort.hgc.jp/)预测得出菠菜MYB基因的亚细胞定位。
1.2 保守结构域和基因结构分析
为了探索R2R3-MYB蛋白DNA结构域的特点,将所有含有R2R3重复的菠菜MYB家族基因(SoMYBs)通过MEGA(version 7.0)中的ClustalW进行多重比对[32]。用WebLogo分析R2R3-SoMYBs保守结构域中相应位置的氨基酸残基分布[33]。以上各软件参数均为默认参数。
为了进一步分析基因结构,用TBtools分析了R2R3-MYBs外显子和内含子、系统发育关系以及蛋白保守基序。
1.3 系统发育分析和功能预测
为了探索菠菜MYB家族基因(SoMYBs)与拟南芥MYB家族基因(AtMYBs)、甜菜MYB家族基因(BvMYBs)的进化关系,进而更好地预测菠菜MYBs的功能,用ClustalW软件将这些氨基酸全序列进行比对(76SoMYBs,168AtMYBs和68BvMYBs)后绘制邻接进化树(NJ tree),参数设为默认值。
1.4 表达模式分析
供氮处理的实验材料SP75为本实验的自交系材料。将种子浸种1 d后,播于72孔育苗穴盘中,培养基质为草炭土与珍珠岩等比例混合。置于温室培养,条件为光照10 h,黑暗14 h,温度20 ℃,湿度70%。21 d后移栽至大花盆中,培养条件不变。7 d后,选取长势一致的菠菜幼苗,进行不同硝态氮浓度的供氮处理。设置4个浓度梯度的营养液进行浇灌,营养液中氮(NO3-)的物质的量浓度分别为0(无),0.294(低氮),5.880(中氮),11.760(高氮)mmol?L-1。处理7 d后收集第3对功能叶,使用Trizol法提取菠菜总核糖核酸(RNA),并使用NanoDrop? OneC分析RNA的浓度与质量。通过PrimeScript? RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒将提取的总RNA反转录成互补脱氧核糖核酸(cDNA)模板。使用Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast)进行引物设计。使用TB Green? Premix Ex Taq?(Tli RNaseH Plus)试剂盒在ABI7500上进行实时荧光定量聚合酶链式反应(qRT-PCR)。采用So18s rRNA作为内参基因,用2-ΔΔCt法计算相对表达量,用Excel软件对数据进行统计、作图。
2 结果与分析
2.1 菠菜SoMYBs鉴定、定位及蛋白质二级结构预测
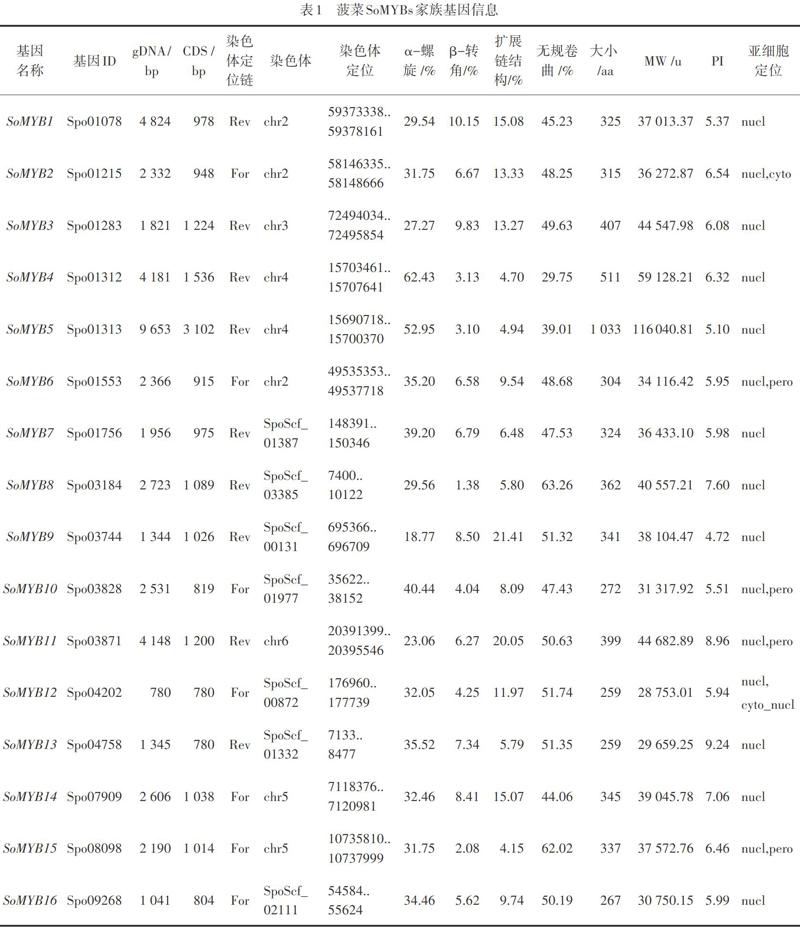
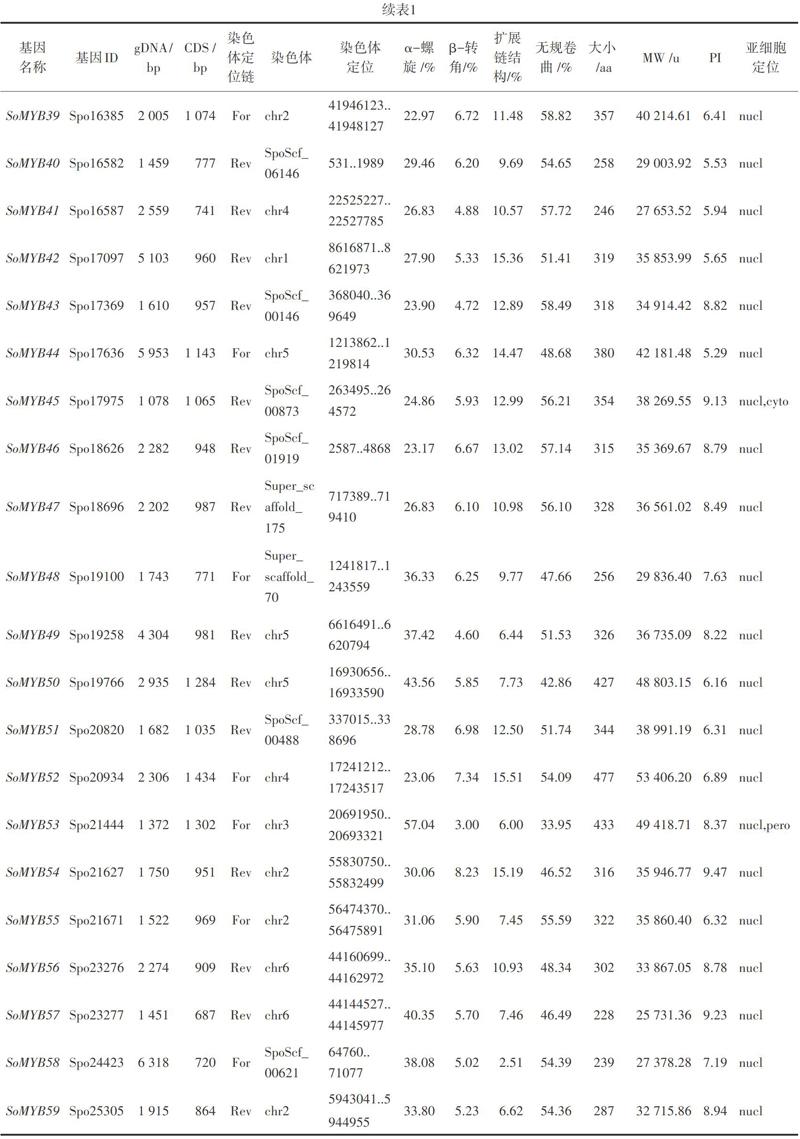
通过综合比对,在菠菜中共鉴定出了76条具有R重复区的MYB家族基因,其中包括72条R2R3-MYB基因(2R-MYB)和4条R1R2R3-MYB基因(3R-MYB)。将2R-MYBs命名为SoMYB1-SoMYB72,3R-MYB命名为SoMYB73-SoMYB76。
菠菜SoMYBs基因的基因组核苷酸序列长度最长的是SoMYB75(14 134 bp),最短的是SoMYB66(735 bp);CDS最长SoMYB67(4 797 bp)的是,最短的是SoMYB57(687 bp),如表1所示。
菠菜MYB家族有32个基因位于染色体正链,另外44个基因位于染色体反链。除26条基因未准确定位外,SoMYB19,SoMYB33,SoMYB42等8条基因定位于1号染色体;SoMYB1,SoMYB2,SoMYB6等9条基因定位于2号染色体;SoMYB3,SoMYB17,SoMYB29等7条基因定位于3号染色体;SoMYB4,SoMYB5,SoMYB21等7条基因定位于4号染色体;SoMYB14,SoMYB15,SoMYB18等9条基因定位于5号染色体;SoMYB11,SoMYB20,SoMYB26等10条基因定位于6号染色体。
菠菜MYB蛋白二级结构均由α-螺旋、β-转角、扩展链结构、无规卷曲这4种结构组成,且这4种结构的比例均不相同。普遍来看,α-螺旋和无规卷曲的比例高于β-转角和扩展链结构,无规卷曲的比例通常最高,但也有例外,如SoMYB4。
菠菜MYB蛋白质氨基酸数量最多的是SoMYB67(1 598 aa),最少的是SoMYB57(228 aa),蛋白质相对分子质量(MW)在最大的是SoMYB67(173 481.38 u),最小的是SoMYB57(25 731.36 u);等电点(pI)最小为4.59(SoMYB23),最大为9.47(SoMYB54)。亚细胞定位预测结果显示,有54个SoMYBs仅在细胞核中表达,SoMYB71和SoMYB75定位在细胞核与叶绿体中,推测其余的SoMYBs基因在细胞核及细胞质中均存在。
2.2 菠菜R2R3-MYB基因家族保守结构域分析
为进一步研究和鉴定R2R3-MYB蛋白同源结构域的特征,通过R2和R3重复的氨基酸序列对R2R3-MYBs进行了多序列比对和weblogo分析。结果如图1所示,和其他物种相似,菠菜的R2R3-MYB均含有基本的R2重复和R3重复结构,即[-W-(X19)-W-(X19)-W-]和[-F-(X18)-W-(X18)-W-]。结果显示:R2重复有高度保守的色氨酸(Tryptophan,W)三联结构,分别位于第9,29和49位,这3个色氨酸被19个其他氨基酸隔开。R3重复有类似的保守结构,但与R2不同,R3中的第1个保守色氨酸(第62位)主要被苯丙氨酸(Phenylalanine,F)取代,少量被异亮氨酸(Isoleucine,I)和亮氨酸(Leucine,L)所取代,其与第81,100位的色氨酸构成保守的R3结构,这3个氨基酸也直接被其他18个氨基酸间隔。除了这2个高度保守的结构外,在R2重复中,第13位的谷氨酸(Glutamic acid,E)、第14位的天冬氨酸(Aspartic acid,D)、第17位的亮氨酸、第45位的半胱氨酸(Cysteine,C)和第48位的精氨酸(Arginine,R)也是比较保守的;在R3重复中,比较保守的是第66位的谷氨酸、第84位的异亮氨酸、第91位的精氨酸和第92位的苏氨酸(Threonine,T)。MYB的DNA结合域中的保守域主要位于两个R重复序列的第二和第三周之间(每个重复中HTH结构域的第三螺旋),如图1所示。然而,MYB的DNA结合域中每个R重复的第一和第二色氨酸之间的氨基酸序列相对不保守。
2.3 基于基因结构的MYB转录因子的系统发育分析
利用MEME网站(http://meme-suite.org/)对菠菜和拟南芥的MYB蛋白质序列进行分析,共鉴定出10个保守基序。长度为11~29,这些motifs的分布如圖2所示。每个MYB蛋白中的motif数量为2~7个,其中,motif5存在于所有76个菠菜MYB蛋白中,并且均不位于C末端;其次是motif1和motif3存在于69个蛋白中;motif2和motif4存在于68个蛋白中;motif6存在于60个蛋白中,并且均位于C末端;motif7存在于35个蛋白中,并且均位于N末端;motif8仅存在于SoMYB41,SoMYB66,SoMYB68,SoMYB69,SoMYB70这5个蛋白中;motif9仅存在于SoMYB66,SoMYB68,SoMYB69,SoMYB70,SoMYB72这5个蛋白中;motif10仅存在于SoMYB73,SoMYB74,SoMYB75,SoMYB76这4个蛋白中。
对SoMYBs进行结构分析后发现其成员的基因结构存在显著的差异性和多样性,例如内含子外显子的相对位置和数量。SoMYB12,SoMYB37,SoMYB45和SoMYB66没有内含子,其余的SoMYBs所含有的内含子数目为1~17个。根据预测的基因结构来看,大部分的SoMYBs都含有2个或3个外显子,其中16条含有2个外显子,有45条含有3个外显子。为了揭示MYB蛋白的系统发育关系,用SoMYBs的氨基酸序列进行了多序列比对,并且根据序列的相似性和系统进化,将SoMYBs分成22个亚组(分别命名为S1~S22),并且每个亚组具有1~7个成员。同一亚组中最高度同源的成员通常共享相同或类似的外显子/内含子模式,显示出相似的数量、位置和外显子长度。例如,S21中的3个SoMYBs(SoMYB8,SoMYB15和SoMYB23)包括3个外显子和2个内含子。在每个亚组的末端节点中能发现有高度同源性的一对或多对的SoMYBs,表明这些蛋白具有相似的功能。S10,S11是例外,其中外显子和内含子的位置和长度显著不同,成员间遗传相似性低。
2.4 菠菜SoMYBs基因系统发育分析
在拟南芥中,MYB转录因子家族被分为27类,且每一类的功能均被注释[7,34-36]。推测聚集在一起的同源蛋白具有相似的功能,表明同一类中菠菜SoMYBs具有与AtMYBs相似的功能。因此,以拟南芥AtMYBs的功能注释为参考,经比对分析,可以预测菠菜SoMYBs的功能。以76个菠菜SoMYBs,67个甜菜BvMYBs和137个拟南芥AtMYBs氨基酸序列为对象,利用MEGA软件构建了基于NJ法的系统发生树(图3)。结果表明:这3种植物的MYB成员被聚为35个分支(分别命名为C1~C35)。其中,C1位于独立的分支,仅包含1个甜菜和12个菠菜MYB,它们可能是苋科植物特有的MYB种类,与拟南芥AtMYB88和AtMYB124所在分支较近;C9是菠菜特有的MYB类型,而C12,C28,C30,C33类中没有菠菜的SoMYBs。
根据上述分析,共发现56个SoMYBs,隶属于24个函数注释类,20个SoMYBs属于7个函数未知类。在此基础上,将56个SoMYBs划分为4个功能类:I类(C4,C17,C18,C19,C23和C32)通过调节木质素、纤维素和半纤维素的生物合成和沉积参与了次生壁的形成[7,34-36];II类(C7,C8,C14,C20,C22,C24和C31)通过调节ABA途径参与了对生物和非生物胁迫的反应[7,34-36];III类(C10,C13,C15,C16,C21,C27,C29,C34和C35)在根系、表皮细胞、花药、营养细胞和气孔细胞发育及胚胎发生等器官发生和器官发生中起重要作用[7,34-36];IV类,包括两个类群(C6和C29,C25和C27)参与调节次生代谢,如花青素和黄酮醇生物合成[7,34-36]。这些结果表明(表2):菠菜SoMYBs具有广泛的功能,可能在菠菜的生长发育中起着重要的作用。
2.5 菠菜C1,C9 SoMYBs基因响应不同氮素条件的表达模式分析
由菠菜与拟南芥、甜菜的系统进化树可以看出,C1类型中只包括菠菜及甜菜的基因,C9类型中只包括菠菜的基因。以菠菜SP73为材料,经不同浓度硝态氮处理(无,低氮,中氮,高氮),取营养生长时期叶片样品,对其中基因(SoMYB39,SoMYB41,SoMYB66,SoMYB67,SoMYB68,SoMYB69和SoMYB70)进行表达量分析(图4),结果表明:这7个基因的表达水平均受硝态氮浓度变化的影响。其中,硝态氮的施加分别使SoMYB67,SoMYB68,SoMYB69和SoMYB70基因的相对表达量显著下降,中浓度硝态氮能够诱导SoMYB39和SoMYB66基因的表达,而低浓度和高浓度硝态氮均能诱导SoMYB41基因的高水平表达。
3 讨 论
MYB转录因子家族是植物中较丰富的一类,具有高度保守的MYB结构域,可以参与多个调控过程。随着越来越多植物基因组和转录组测序的完成,许多植物的MYB转录因子家族被相继鉴定出来。但是对菠菜MYB转录因子家族的分析及单个基因的功能研究未见报道,因此对菠菜MYB 转录因子进行研究具有重要的意义。
本研究鉴定到76个具有典型R重复结构的MYB基因家族,与甜菜(67个)相近。菠菜MYB转录因子蛋白性质分析表明:在76个MYB转录因子蛋白中,大部分成员属于碱性蛋白,表明其能与酸性的核糖核苷酸相结合。蛋白质二级结构预测发现:菠菜MYB蛋白二级结构均由α-螺旋、β-转角、扩展链结构、无规卷曲这4种结构组成,且α-螺旋和无规卷曲具有较大的占比,高于β-转角和扩展链结构,是MYB转录因子的主要二级元件。α-螺旋的结构较为稳定,无规卷曲多位于蛋白表面,易于形成DNA结合结构域。这种占比与MYB结构域的螺旋-螺旋-转角-螺旋结构相符合,该结构易与DNA的大沟发生特异性结合,调节DNA转录,从而对基因表达起增强或抑制作用。
菠菜MYB转录因子系统进化树及保守基序分析表明:相同类型的MYB 转录因子均聚类在一起,分支相近的转录因子具有相似的结构域及基序。由菠菜具有R结构的MYB 转录因子与拟南芥和甜菜MYB 转录因子共同构建的进化树可知:不同物种间MYB转录因子具有较高的保守性;依据拟南芥的分类标准,发现其聚在不同的亚组,与拟南芥MYB转录因子处于同一亚组的菠菜MYB转录因子可能具有相似的功能,因此将56个SoMYBs划分为4个功能类。I类通过调节木质素、纤维素和半纤维素的生物合成和沉积参与了次生壁的形成。Ⅱ类通过调节ABA途径参与了对生物和非生物胁迫的反应。Ⅲ类在根系、表皮细胞、花药、营养细胞和气孔细胞发育及胚胎发生等器官发生和器官发生中起重要作用。IV类,包括两个类群参与调节次生代谢,如花青素和黄酮醇生物合成。另外的20个SoMYBs功能尚不清晰。在系统发育树仅有菠菜和甜菜所处亚组的MYB转录因子可能具有独立的功能。
对菠菜7个未预测功能的SoMYBs基因响应不同硝态氮浓度的表达模式进行分析,结果表明:SoMYB41基因能够分别受低浓度和高浓度硝态氮诱导而高水平表达;SoMYB39和SoMYB66基因的表达受浓度硝态氮诱导;而SoMYB67,SoMYB68,SoMYB69和SoMYB70基因受硝态氮抑制表达。拟南芥氮素相关的转录调控网络研究表明[37-38]:包括MYB在内的20余个转录因子能够系统响应根及地上部分的氮素浓度变化,它们通过影响相关酶的协同转录调控氮代谢。菠菜MYB在菠菜氮素利用中可能也起到重要的调控作用。
4 结 论
通过生物信息学的方法对菠菜MYB转录因子家族成员、理化性质、基因分类染色体定位、结构域序列保守性和系统进化关系進行了分析预测。结果表明:菠菜MYB家族成员在菠菜的生长发育过程中起着广泛且重要的调节作用,可能参与纤维素和半纤维素的生物合成和沉积,可能参与对生物和非生物胁迫的反应以及在根系、表皮细胞、花药及胚胎发生等器官发生中起重要作用。其中7个菠菜SoMYBs基因在不同硝态氮浓度下的表达模式不同,可能参与调控菠菜氮素利用及生长发育进程。
参考文献:
[1] KRANZ H D,DENEKAMP M,GRECO R,et al.Towards functional characterisation of the members of the R2R3-MYB gene family from Arabidopsis thaliana [J].Plant Journal,2010,16(2):263-276.
[2] 冯盼盼,陈鹏,洪文杰,等.拟南芥MYB转录因子家族研究进展 [J].生命科学研究,2016,20(6):555-560.
FENG P P,CHEN P,HONG W J,et al.Research progress of MYB transcription factor family in Arabidopsis thaliana [J].Life Science Research,2010,20(6):555-560.
[3] LIPSICK J S.One billion years of MYB [J].Oncogene,1996,13(2):223-235.
[4] RALF S M W,WEISSHAAR B.The R2R3-MYB gene family in Arabidopsis thaliana [J].Current Opinion in Plant Biology,2001,4(5):447-456.
[5] KRANZ H,KAI S,WEISSHAAR B.C-MYB oncogene-like genes encoding three MYB repeats occur in all major plant lineage [J].The Plant Journal,2010,21(2):231-235.
[6] JIN H,MARTIN C.Multifunctionality and diversity within the plant MYB-gene family [J].Plant Molecular Biology,1999,41(5):577-585.
[7] DUBOS C,STRACKE R,GROTEWOLD E,et al.MYB transcription factors in Arabidopsis [J].Trends in Plant Science,2010,15(10):573-581.
[8] HE Q,JONES D C,LI W,et al.Genome-wide identification of R2R3-MYB genes and expression analyses during abiotic stress in Gossypium raimondii [J].Scientific Reports,2016,6:22980.
[9] DU H,WANG Y B,XIE Y,et al.Genome-wide identification and evolutionary and expression analyses of MYB-related genes in land plants [J].DNA Research,2013,20(5):437-448.
[10] NIU Y,JIANG X,XU X,et al.Reaserch advances on transcription factor MYB gene family in plant [J].Molecular Plant Breeding,2016,8:129-138.
[11] WILKINS O,NAHAL H,FOONG J,et al.Expansion and diversification of the populus R2R3-MYB family of transcription factors [J].Plant Physiology,2009,149(2):981-993.
[12] DU H,FENG B R,YANG S S,et al.The R2R3-MYB transcription factor gene family in maize [J].Plos One,2012,7(6):e37463.
[13] STRACKE R,HOLTGRWE D,SCHNEIDER J,et al.Genome-wide identification and characterisation of R2R3-MYB genes in sugar beet (Beta vulgaris) [J].BMC Plant Biology,2014,14(1):249.
[14] SALIH H,GONG W,HE S,et al.Genome-wide characterization and expression analysis of MYB transcription factors in Gossypium hirsutum [J].BMC Genetics,2016,17(1):129.
[15] YANG K,LI Y,WANG S,et al.Genome-wide identification and expression analysis of the MYB transcription factor in moso bamboo (Phyllostachys edulis) [J].PeerJ,2019,6(9):e6242.
[16] LIU C,XIE T,CHEN C,et al.Genome-wide organization and expression profiling of the R2R3-MYB transcription factor family in pineapple (Ananas comosus) [J].BMC Genomics,2017,18(1):503.
[17] WANG X,WEN Q,TENG C,et al.Overexpression of PGA37/MYB118 and MYB115 promotes vegetative-to-embryonic transition in Arabidopsis [J].Cell Research,2009,19(2):224-235.
[18] THOMAS K,JESSICA A,THOMAS M,et al.Arabidopsis regulator of axillary meristems1 controls a leaf axil stem cell niche and modulates vegetative development [J].Plant Cell,2006,18(3):598-611.
[19] DRTE M,GREGOR S,KLAUS T.Blind homologous R2R3 Myb genes control the pattern of lateral meristem initiation in Arabidopsis [J].Plant Cell,2006,18(3):586-597.
[20] BAUMANN K,PEREZRODRIGUEZ M D,VENAIL J,et al.Control of cell and petal morphogenesis by R2R3 MYB transcription factors [J].Development,2007,134(9):1691-1701.
[21] HUY A P,SYLVANA I,SONG F,et al.The MYB80 transcription factor is required for pollen development and the regulation of tapetal programmed cell death in Arabidopsis thaliana [J].Plant Cell,2011,23(6):2209-2224.
[22] LYNETTE B,SAID H,MICHAEL B,et al.A plant germline-specific integrator of sperm specification and cell cycle progression [J].Plos Genetics,2009,5(3):e1000430.
[23] PUNWANI J A,RABIGER D S,ALAN L,et al.The MYB98 subcircuit of the synergid gene regulatory network includes genes directly and indirectly regulated by MYB98 [J].Plant Journal,2010,55(3):406-414.
[24] 戴毅,高瑩莹,黄泽峰,等.玉米R2R3型MYB转录因子家族生物学功能综述 [J].江苏农业科学,2013,41(3):6-8.
DAI Y,GAO Y Y,HUANG Z F,Review on biological functions of R2R3 MYB transcription factor family in maize [J].Jiangsu Agricultural Sciences,2013,41(3):6-8.
[25] STRACKE R,ISHIHARA H G,BARSCH A,et al.Differential regulation of closely related R2R3-MYB transcription factors controls flavonol accumulation in different parts of the Arabidopsis thaliana seedling [J].Plant Journal,2010,50(4):660-677.
[26] YANG J H,WANG H Z.Molecular mechanisms for vascular development and secondary cell wall formation [J].Frontiers in Plant Science,2016,7:e1001312.
[27] DING Q,WANG X,HU L,et al.MYB-like transcription factor SiMYB42 from foxtail millet (Setaria italica L.) enhances Arabidopsis tolerance to low-nitrogen stress [J].Hereditas,2018,40(4):327-338.
[28] SMITH V R.Effect of nutrients on CO2 assimilation by mosses on a sub-antarctic island [J].New Phytologist,2010,123(4):693-697.
[29] SCHEIBLE W R,GONZALEZ F A,LAUERER M,et al.Nitrate acts as a signal to induce organic acid metabolism and repress starch metabolism in tobacco [J].Plant Cell,1997,9(5):783-798.
[30] WANG R.Microarray analysis of the nitrate response in Arabidopsis roots and shoots reveals over 1,000 rapidly responding genes and new linkages to glucose,trehalose-6-phosphate,iron,and sulfate metabolism [J].Plant Physiology,2003,132(2):556-567.
[31] SULISTIAWATI N P A,KARTINI L,YULIARTINI M S.Identification of development phases and changes shoots flowering orange siam plants [J].International Journal of Life Sciences,2017,1(2):28-38.
[32] KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets [J].Molecular Biology and Evolution,2016,33(7):1870.
[33] GAVIN E C,HON G,CHANDONIA J M,et al.WebLogo:a sequence logo generator [J].Genome Research,2004,14:1188-1190.
[34] ZHONG R,LEE C,YE Z,et al.A battery of transcription factors involved in the regulation of secondary cell wall biosynthesis in Arabidopsis [J].Plant Cell,2008,20(10):2763-2782.
[35] MCCARTHY R L,RUIQIN Z,ZHENG H Y.MYB83 is a direct target of SND1 and acts redundantly with MYB46 in the regulation of secondary cell wall biosynthesis in Arabidopsis [J].Plant and Cell Physiology,2009,50(11):1950-1964.
[36] LI X,XUE C,LI J,et al.Genome-wide identification,evolution and functional divergence of MYB transcription factors in Chinese white pear (Pyrus bretschneideri) [J].Plant and Cell Physiology,2016,57(4):824-847.
[37] KROUK G,MIROWSKI P,LECUN Y,et al.Predictive network modeling of the high-resolution dynamic plant transcriptome in response to nitrate [J].Genome Biology,2010,11(12):R123.
[38] GAUDINIER A,RODRIGUEZMEDINA J,ZHANG L,et al.Transcriptional regulation of nitrogen-associated metabolism and growth [J].Nature,2018,563(7730):259-264.
(責任编辑:顾浩然,包震宇)

