尼罗罗非鱼pik3r1 基因的克隆和mRNA 表达分析
谢彩霞,汪志文,鲁义善,汤菊芬,简纪常
(广东海洋大学水产学院//广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
罗非鱼(Oreochromis)是全世界广泛养殖的经济鱼类,有生长快、食性杂、适应性强等特点。我国是罗非鱼生产大国,但随着罗非鱼种质退化及养殖环境污染,各种疾病暴发,特别是无乳链球菌病,对罗非鱼养殖业造成较大影响[1-2]。无乳链球菌(Streptococcus agalactiae)感染罗非鱼后最明显症状是,部分病鱼眼球突出、周围充血,鳃盖内侧发红、充血或出血,病鱼死亡率高达25%~80%[3-7]。
免疫机制研究已成为鱼类疾病预防的热点,PI3K/Akt 信号通路是细胞内极其重要的信号转导途径,磷脂酰肌醇3-激酶(PI3K)为该信号通路上主要调节蛋白,参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。IA 类PI3K 是一种专性异二聚体,由一个催化亚基(p110)和调节亚基(p85)组成[8],其中p110 由pik3ca基因编码,p85 由pik3r1基因编码。pik3r1是磷酸肌醇信号通路的重要调控基因,在哺乳动物中已证实参与多种免疫途径,目前对该基因的研究报道主要是在人的癌症[9-11]、肿瘤[12-13]、胰岛素调控[14]等方面,但在水产方面鲜有报道。笔者从尼罗罗非鱼(Oreochromis niloticus)脾脏组织中克隆得pik3r1基因,研究该基因在健康及经无乳链球菌刺激的罗非鱼中的表达情况,为pik3r1在罗非鱼链球菌病防控方面研究奠定基础。
1 材料和方法
1.1 材料
实验用尼罗罗非鱼 [(100 ± 10)g]购自湛江市东风市场,在(28±2)℃条件下暂养4 周后备用;大肠杆菌(Escherichia coli)DH5α 和无乳链球菌(S.agalctiaeZQ0910)菌种由广东省水产经济动物病原生物学及流行病学重点实验室提供;克隆载体pMD18-T Vector、Ex Taq 酶购自TaKaRa 公司(大连);引物由广州生工合成,DNA 胶回收试剂盒购自ThermoFish 公司。
1.2 方法
1.2.1 罗非鱼总RNA 提取和cDNA 合成 取健康尼罗罗非鱼脾脏组织10~ 20 mg,按照上海生工UNIQ-10 柱式Trizol 总RNA 抽提试剂盒说明书提取罗非鱼脾脏的总RNA;按照TaKaRa 公司的Reverse Transcriptase M-MLV 说明书将提取到的罗非鱼脾脏组织的总RNA 反转成cDNA 第一链用于后续试验。无乳链球菌诱导试验中,实验组腹腔注射磷酸盐缓冲液(PBS)重悬的无乳链球菌(1×107CFU/mL)0.1 mL,空白对照组注射灭菌的0.1 mL PBS,然后在4、8、12、24、48、72、96 h 取罗非鱼头肾、肌肉、脾脏、鳃、皮肤、肠道、脑、胸腺等8 个组织约10~ 20 mg,同法进行罗非鱼总RNA 提取和cDNA 合成。
1.2.2 罗非鱼pik3r1 基因的分子克隆 依pik3r1基因编码区利用 PrimerPremier 5.0 设计引物On-pik3r1-1F、On-pik3r1-2190R(表1),然后进行PCR 扩增,反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min 10 s,33 个循环;72 ℃ 10 min;4 ℃下保存,对PCR 产物进行电泳检测,目的条带经切胶回收后与pMD18-T 载体连接,转化到大肠杆菌(E.coil)DH5α 中,最后进行菌落PCR鉴定,阳性克隆送广州生工测序。

表1 实验所用引物Table 1 Primers used in this study
1.2.3 罗非鱼pik3r1基因的生物信息学分析 用SeqMan 软件对阳性克隆的送测结果进行拼接,获得On-pik3r1 编码序列。分别用ExPASy(http://expasy.org/tools/),InterProScan 程序(http://www.ebi.ac.uk/Tools/pfa/iprscan/)进行蛋白质分析和结构域预测;利用UCSC 预测内含子外显子;蛋白质二级,三级结构的预测网址分别为PORTER (http://www.distill.ucd.ie/porter)、SWISSM-MODEL (http://swissmodel.expasy.org/inter active)。Clutalx 和Genedoc 程序被用于氨基酸同源序列比对。通过MEGA6.0 软件,用邻接法构建系统进化树。
1.2.4 用qRT-PCR 分析pik3r1的组织表达 荧光定量特异性引物 q R T-P I K 3 R 1-1 3 0 4 F、qRT-PIK3R1-1514R 见表1,以β-actin作为内参基因,每个样本设置3 个平行复孔,使用荧光定量PCR仪对健康鱼组织及经无乳链球菌感染后的组织分别进行qRT-PCR。反应条件参考TransScript Green Two-Step qRT-PCR SuperMix 试剂盒:预变性94 ℃30 s;94 ℃ 5 s,60 ℃ 15 s,40 个循环;95 ℃15 s。采用2-ΔΔCt法计算On-pik3r1在健康鱼及经无乳链球菌感染后组织中的相对表达量,并使用SPSS 20.0 软件进行单因素方差分析。
2 结果与分析
2.1 On-pik3r1 克隆结果及序列分析
On-pik3r1编码区长2 190 bp,编码729 个氨基酸(图1),理论分子质量为83.99 ku,5′端UTR 为542 bp,3′端UTR 为2 248 bp,理论等电点为5.73,分子式为C3728H5839N1029O1136S23;脂肪系数为80.26,不稳定指数为50.56,归类为1 个不稳定蛋白;该蛋白总平均亲水值为-0.689;ProtScale 分析(图2)表明,On-pik3r1 蛋白亲水性氨基酸含量较高,亲水区域较大,为亲水性蛋白,与理化分析结果一致,因此推测On-pik3r1基因编码的蛋白质为亲水性蛋白。Signal P 4.1 Server 预测该序列不存在信号肽;TMHMM Server 2.0 预测该蛋白为胞外蛋白,不存在跨膜区。对On-pik3r1的亚细胞定位预测结果为细胞质。ProtParam 在线分析显示,On-pik3r1 推导的氨基酸序列中亮氨酸 (Leu) 含量最高,为10.2%;谷氨酸(Glu) 含量次之,为8.6%,色氨酸 (Trp) 含量最低,为1.2%。带正电荷氨基酸 (Arg+Lys) 95 个,带负电荷氨基酸 (Asp+Glu) 110 个。SoftBerry-Psite 预测该序列功能位点(图1),发现该序列N-糖基化位点6个,酪蛋白激酶II 磷酸化位点15 个,酪氨酸激酶磷酸化位点1 个,蛋白激酶C 磷酸化位点13 个,酰胺化化位点3 个,N-豆蔻酰化位点3 个,戊基结合位点3 个,C-末端定位信号序列微体10个。InterProScan程序预测pik3r1结构域由SH2、SH3 和RhoGAP 组成(图3)。UCSC 预测的内含子外显子结构如图4。

图1 尼罗罗非鱼pik3r1 基因核苷酸序列及推导的氨基酸序列Fig.1 Open reading frame and deduced amino acid sequences of pik3r1 gene in Nile tilapia

图1 续(Continued)

图2 pik3r1 蛋白亲疏水性预测Fig.2 Predicted hydrophobicity of pik3r1 protein

图3 pik3r1 功能结构域预测Fig.3 pik3r1 functional domain prediction

图4 pik3r1 基因内含子-外显子基因结构Fig.4 Intron-exon gene structure of pik3r1 gene
2.2 二级结构和三级结构预测
On-pik3r1 蛋白的二级结构(图5)中,α 螺旋含量为45.95%,β 折叠3.98%,无规则卷曲39.92%,延伸链为10.15%。On-pik3r1 三维结构如图6 所示。
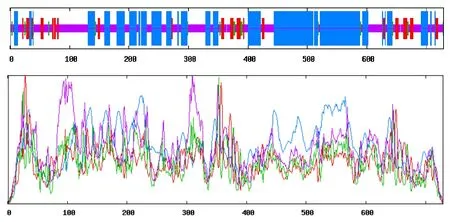
图5 尼罗罗非鱼pik3r1 蛋白质对应的二级结构Fig.5 Secondary structure prediction domains of pik3r1 protein in Nile tilapia

图6 罗非鱼与人类pik3r1 蛋白三维结构Fig.6 Three-dimensional structures of pik3r1 in Nile tilapia and Homo sapiens
2.3 罗非鱼On-pik3r1 同源性及系统进化树分析
将pik3r1基因编码的氨基酸序列进行BLAST比对(图7),发现pik3r1较保守,与其他物种的同源性在70%以上,其中与斑马拟丽鱼(Maylandia zebra)相似性最高,为98.53%,与虹鳟(Oncorhynchusmykiss)、电鳗(Electrophorus electricus)、欧加里托几维鸟(Apteryx rowi)的相似性分别为87.96%、84.14%、79.38%。在系统进化树中,罗非鱼和同斑马拟丽鱼聚为一支,亲缘关系最为相近(图8)。

图7 罗非鱼pik3r1 与其他物种pik3r1 氨基酸序列比对Fig.7 Multiple alignment of the predicted On-pik3r1 with amino acid sequences in other species
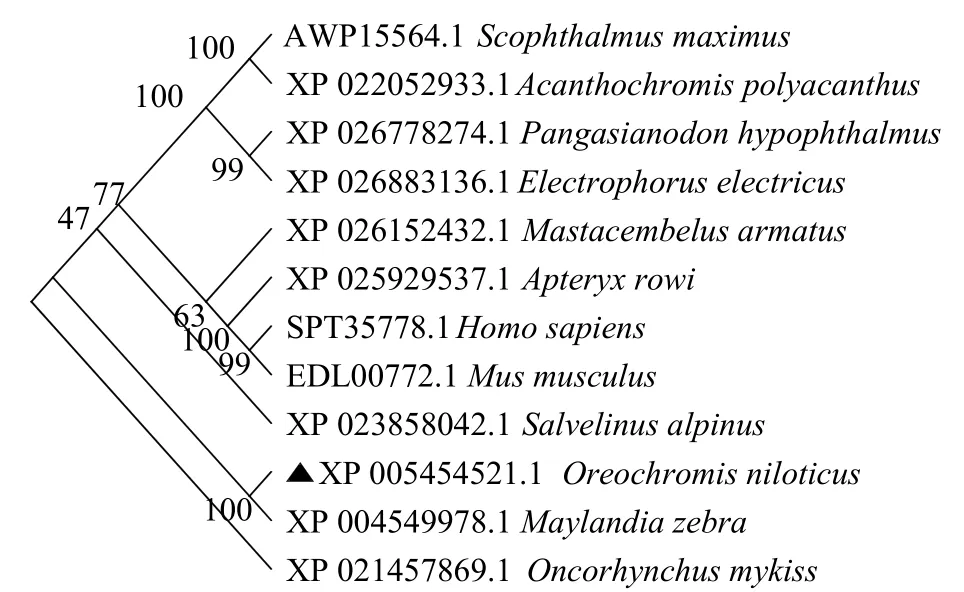
图8 邻接法构建pik3r1 氨基酸系统进化树Fig.8 Phylogenetic tree of pik3r1 by neighbour-joining method
2.4 On-pik3r1 的组织表达分析
荧光定量结果显示,On-pik3r1基因在所有组织中均可表达,且在肌肉中表达量最高,其次是鳃、皮肤,在胸腺中表达量最低(图9)。在灭活无乳链球菌刺激罗非鱼后,在不同时间点,On-pik3r1基因表达量在鳃、脾脏、头肾、肠道、脑部等5 个组织中的表达均极显著下调,在胸腺中表现为4 h 时极显著下调,24、48、72 h 时为显著下调(图10)。
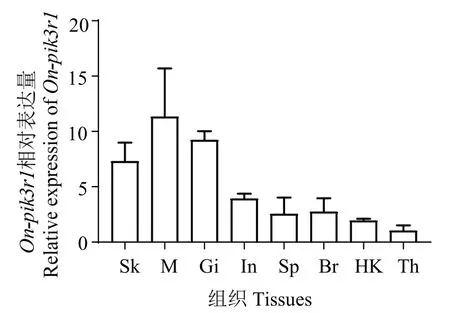
图9 罗非鱼pik3r1 在不同组织中的表达情况Fig.9 Expression of pik3r1 of Tilapia in different tissues

图10 无乳链球菌感染后罗非鱼pik3r1 在各个组织中的时序表达Fig.10 Temporal expression of pik3r1 in different tissues after infected by S.agalactiae
3 讨论
本研究克隆鉴定得pik3r1(命名为On-pik3r1),On-pik3r1基因编码区为2 190 bp,5′ UTR 为542 bp,3′ UTR 为2 248 bp。进化树中与斑马拟丽鱼亲缘关系较近。在推导的On-pik3r1 序列中发现两个SH2 结构域、一个SH3 结构域和RhoGAP 结构域,这些保守区域与其他物种序列较一致。经比对,pik3r1 氨基酸序列在鱼类、鸟类和哺乳动物中高度保守,这些结果表明,pik3r1 在这些物种中可能有类似的功能。
本研究中,On-pik3r1在健康尼罗罗非鱼各组织中均有表达,但不同组织间表达量差异较大,肌肉最高,鳃、皮肤次之,胸腺最低,pik3r1在半滑舌鳎(Cynoglossus semilaevis)[15]的脾脏、肝脏、心脏、肠、脑、皮肤、肾脏、一侧性腺、肌肉、鳃丝10 种组织中亦均有表达,且不同组织间表达量差异较大,说明pik3r1基因参与鱼类的多种生理反应。胸腺是T 细胞成熟分化的场所,PI3K 信号可通过激活PKB、Rac 等信号途径而参与T细胞的活化、分化[16],PI3K 的激活主要依赖于p110 的活性,但p85 对p110 有抑制作用[17],pik3r1表达量低,则p85对p110的抑制作用降低,有利于p110参与PI3K的激活,从而激活PKB、Rac 等信号途径而参与T细胞的活化、分化。本研究中,On-pik3r1在罗非鱼胸腺表达量低,表明pik3r1参与罗非鱼T细胞的活化、分化,在罗非鱼免疫调节中有重要作用。
经灭活无乳链球菌刺激后,On-pik3r1的表达量在鳃、肠道、脾脏、头肾、脑部等5 个组织中均表现为极显著下调,在胸腺中4 h 时极显著下调,24、48、72 h 时为显著下调,这可能与pik3r1的调控模式有关:pik3r1表达的下调激活了PI3K 信号通路,使炎症的发生成为可能[18-19],pik3r1可能对炎症的发生发挥抑制作用。已在患有肝细胞癌的小鼠中验证pik3r1的这种调控模式[20],但在其他动物上并未得到证实。无乳链球菌在体内大量繁殖时会引起急性炎症反应。无乳链球菌侵染鱼体时,最先是巨噬细胞首先对无乳链球菌吞噬作用,但当无乳链球菌繁殖速度比巨噬细胞吞噬速度快得多时,巨噬细胞中pik3r1的下调会损伤应答脂多糖(LPS)的NO和白介素(IL-12)的产生,使胞内易受细菌感染[21],巨噬细胞会携带着无乳链球菌突破血脑屏障进入血液循环系统和中枢神经系统[22],病原菌因而可逃避鱼体免疫系统的清除作用,使链球菌更易扩散至其他器官和组织,引起多器官功能障碍和细菌性败血症,最后导致鱼体死亡。因此,pik3r1的下调表达可能可作为鱼体发生无乳链球菌病的有效征兆,通过进一步研究,pik3r1可能会给无乳链球菌病的治疗提供新靶点。

