海洋弧菌鉴定与分类相关功能基因研究进展
陈 星,唐金利,姜宫凌侠,亢振军,李 楠
(1.南宁师范大学北部湾环境演变与资源利用教育部重点实验室,广西 南宁 530001;2.广西大学生命科学与技术学院,广西 南宁 530004;3.北部湾大学海洋学院,广西 钦州 535011)
海洋弧菌(Vibrio)是一类菌体短小的异养型革兰阴性细菌,兼性厌氧,广泛分布于海水及海洋动物体内,多有好盐性、运动性及氧化酶阳性,可在硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(Thiosulfate-citrate-bile salts-sucrose,TCBS)琼脂培养基上生长[1]。海洋弧菌中,重氮营氧弧菌(Vibriodiazotrophicus)、需钠弧菌(V.natriegens)和海利斯顿氏菌(V.pelagius)等异养型固氮菌可将空气中的氮分子还原成氨态氮,参与海洋无机氮循环[2]。多糖降解性弧菌可降解几丁质等复杂糖类,可用于处理海洋污染物[1]。费希尔弧菌(V.fischeri)、哈维氏弧菌(V.harveyi)和火神弧菌(V.logei)等少数几种以浮游、附存(含附着、寄生、腐生)和共生方式生活的弧菌可以发光,其发光程度与毒性浓度呈负相关关系,可用于水环境样品的生物毒性检测[3]。除有固氮、降解多糖、发光等能力外,以霍乱弧菌(V.cholera)、副溶血弧菌(V.parahaemolyticus)、哈维氏弧菌、创伤弧菌(V.vulnificus)和溶藻弧菌(V.alginolyticu)为主的多种海洋弧菌还有致病性,除可感染鱼虾外,还可引发人类霍乱、胃肠炎和炎症等多种疾病[4]。不同盐度、深度、溶氧和pH 的海水中均有大量弧菌群,它们不仅在海洋生态系统元素循环中发挥重要作用,还关乎水产养殖发展和人类健康。
目前,弧菌科包含弧菌属、发光杆菌属、另类弧菌属、肠弧菌属、盐弧菌属、格里蒙氏菌属、海胆单胞菌属和链状球菌属等8 属,150 多种[5-6]。早期的传统表型鉴定分类方法是对弧菌进行纯培养,再根据包括菌落形态、生理特征以及免疫学特性等弧菌表型进行分类鉴定。Vandenberghe 等[7-8]使用Biolog GN 系统对各类水产养殖生物体内所有分离物进行表型鉴定,发现弧菌属是一个表型多样化的群体,在不同生长周期与环境下呈现不同的表型和理化特征。随着弧菌新种的增加,仅通过简单的表型分类难以对弧菌科种类进行合理分类[8-9]。如豚鼠气单胞菌(Aeromonas caviae)通常被鉴定为河流弧菌(V.fluvialis)[10],在未进行完整的形态特征筛选试验时,嗜水气单胞菌(Aeromonas hydrophila)和类志贺毗邻单胞菌(Plesiomonas shigelloides)会被误认为是弧菌[11]。当前,TCBS 培养基是常用弧菌分离筛选培养基之一,Cleland 等[12]报道,海水、蛤和牡蛎样品在TCBS培养基上分离出的53%的菌落可被鉴定为弧菌,Bolinches 等[13]从TCBS 培养基中挑取的83%的河口水样分离株是弧菌。但有研究显示,用表面荧光显微镜直接计数的活菌数始终高于相应的TCBS 平板计数,表明部分弧菌会进入不可培养状态[14]。所以依靠表型鉴定的分类学方法仅针对可培养弧菌,却无法有效筛选鉴定不可培养的弧菌类群。因此,人们开始转向利用现代分子生物学方法。从20 世纪60 年代开始,分子生物学技术的迅速发展使弧菌分类学研究进入分子生物学时代,许多新技术和方法在弧菌分类学研究中得到广泛应用。弧菌的16S rRNA 基因和其他功能基因等分子生物学方法已成为海洋弧菌分类鉴定的重要手段。笔者根据已有的弧菌分类学研究成果,阐述海洋弧菌鉴定与分类相关功能基因(表1)及其应用研究进展。

表1 常见功能基因的引物序列Table 1 Primer sequence of common functional genes
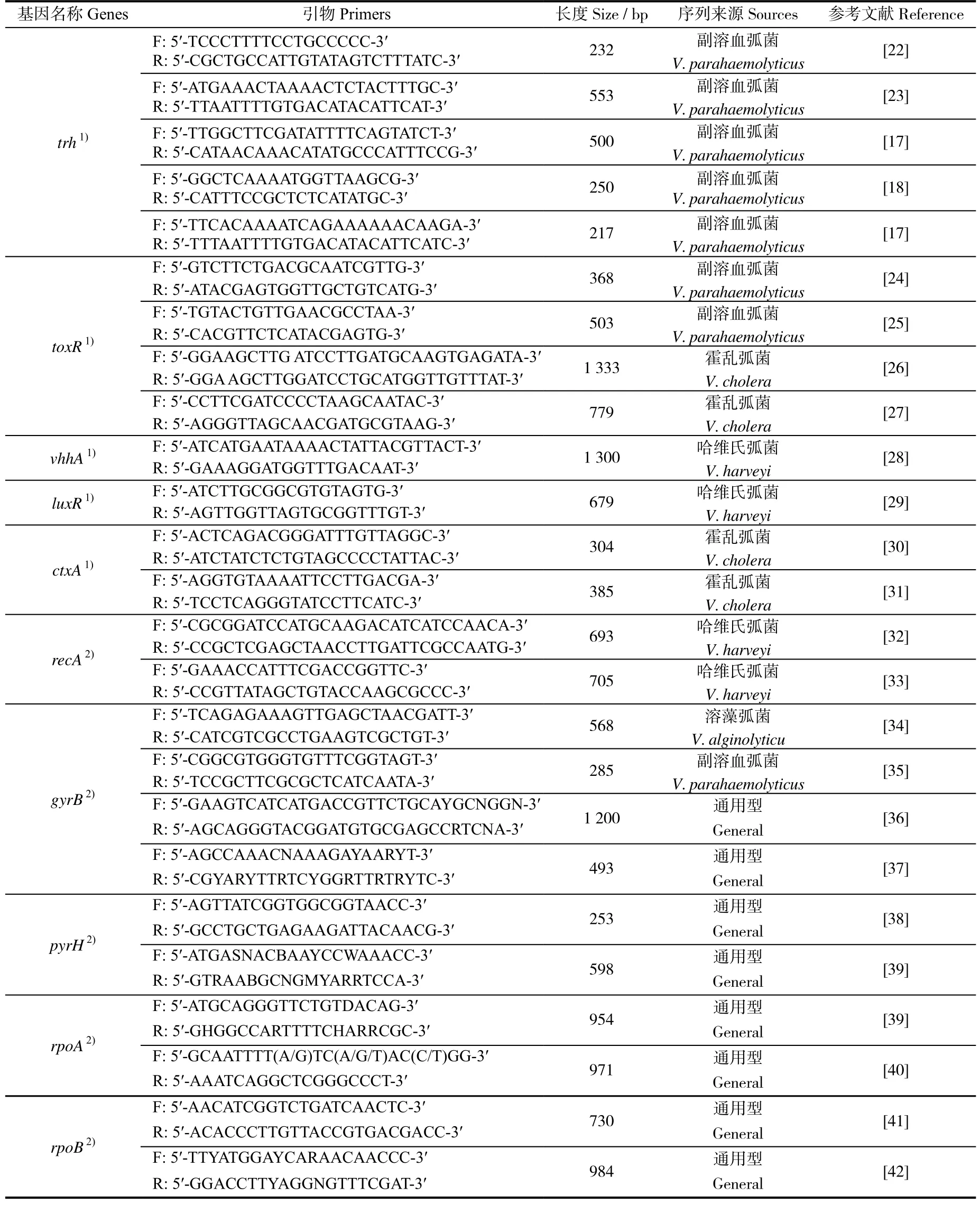
表1 续(Continued)
1 16S rRNA 基因
细菌的核糖体RNA 有3 种类型,即23S rRNA、16S rRNA 和5S rRNA,16S rRNA 基因为细菌、蓝藻、放线菌和支原体等原核生物所共有,其功能同源且最为古老,既含有保守序列,又含可变序列。保守序列区可反映生物物种的亲缘关系,为系统发育重建提供线索;可变序列区可揭示生物物种的特征核酸序列,是属种水平鉴定的重要分子依据。16S rRNA 基因的序列长度约1 500 bp,分子大小适合操作,序列变化与进化距离相适应[43]。通过比较各类原核生物16S rRNA 基因的序列,利用序列差异计算它们之间的进化距离,可绘制系统进化树,从而鉴定样本中的分类信息[43]。Kim 等[44-45]从16S rRNA 基因序列中寻找弧菌属保守但特异于其他菌属的可变区位点,在该可变区位点设计创伤弧菌的特异性引物,建立一种检测和鉴别创伤弧菌菌株的PCR 方法来代替传统表型鉴定法。尽管16S rRNA基因的生物信息学提供了鉴定弧菌菌株较为客观和可靠的方法,但它在种的水平上有一定局限性,16S rRNA 基因序列几近相同也不能保证两个弧菌菌株属于同一物种[46],因此,不能鉴定到种。人们开始尝试用其他的功能基因和特异性毒力基因进行海洋弧菌的系统发育学分析,这些功能基因可与16S rRNA 基因相结合,对同属不同物种作系统发育学分析。
2 管家基因(Housekeeping gene)
管家基因被认为是揭示高等分类学系统发育关系的潜在标记,可为弧菌系统发育结构寻找新的鉴定标记,提高弧菌分类的准确性。常用的弧菌物种鉴定基因分析方法包括扩增片段长度多态性(AFLP)、重复性外源回文元件PCR(rep-PCR)、DNA-DNA 杂交和多位点序列分析(MLSA),弧菌科的分类很快从使用单一基因发展到使用多个基因序列进行鉴定和系统发育分析[47]。例如,同时用8 个管家基因序列(ftsZ、gapA、gyrB、mreB、pyrH、recA、rpoA、topA)和16S rRNA 基因的MLSA 方案,为弧菌科鉴定和分类提供更高分辨率[48]。
2.1 recA
recA基因产物是一种多功能蛋白,有水解LexA阻遏蛋白的活性,最早发现于大肠杆菌(Escherichia coli),参与调控多种重要的细胞功能,包括同源重组、抗紫外线和X 射线以及SOS 修复DNA 损伤介导的突变[49]。Llyod 首先尝试用recA进行系统发生学研究[50]。1995 年Eiesn[51]分别以recA和16S rRNA基因为系统学标记,从 Genbank 中选择来自不同物种的DNA 序列,用相同NJ 建树方法构建系统发生树,发现二者的进化枝模式及分辨率极为相似,在系统发生树的变形细菌(Proteobacteria)、栖热菌属(Thermus)和耐辐射异常球菌属(Deinococcus radiodurans)等进化枝,recA分辨率优于16S rRNA基因。近年来,有研究表明recA基因作为系统学标记可有效地对弧菌属进行种的鉴定,结果显示,当弧菌菌株之间的16S rRNA 基因序列相似性大于98%时,弧菌recA基因之间的相似性为83%~ 99%,表明recA基因序列比16S rRNA 基因有更强的辨别力[52]。因此,相比于16S rRNA 基因,recA的某些区段有较高的物种专一性。
2.2 gyrB
gyrB基因常见于细菌中,编码DNA 促旋酶B亚基蛋白,是一个单拷贝基因,也具有PCR 引物开发的保守区域,在DNA 复制过程中起重要作用[53]。gyrB基因序列已用于假单胞菌(Pseudomonades)[54]、分枝杆菌(Mycobacterium)[55]、小单孢菌(Micromonospora)[56]的分类研究,表明gyrB是一个合适的系统发育标记,也可用于研究弧菌物种水平的系统发育和分类学关系[35]。Luo 等[34]对9 株溶藻弧菌的gyrB片段(约1.2 kb)进行测序,并分析它们与其它相似弧菌的系统发育关系,发现所有溶藻弧菌在系统发育树中分成一个强支持的簇,表明gyrB是溶藻弧菌成员鉴定和分类学分析的有效靶标,并成功开发了基于gyrB基因的PCR 方法。此外,gyrB基因也可与16S rRNA 基因序列结合进行灿烂弧菌(V.splendidus)相关菌株的系统发育分析[57]。副溶血弧菌和溶藻弧菌的16S rRNA 基因序列几近相同,仅基于16S rRNA 基因的系统发育关系难以对物种进行鉴定分类,但将它们的gyrB基因之间的系统发育距离放大后则可鉴定为不同物种[35]。通过gyrB序列数据分析弧菌新分离株的系统发育位置,每一群弧菌新分离株均满足序列多样性的阈值标准,为弧菌不同种属间的序列多样性提供了新依据[35]。
rpoA和rpoB分别编码RNA 聚合酶的α 亚基和β 亚基,核糖核酸亚基通过二聚作用启动α 聚合酶的组装,形成β 亚基相互作用的平台[58]。该序列比16S rRNA 基因进化更快,目前已有学者提出rpoB基因序列可作为细菌鉴定方法[59],已被认为适合于区分衣原体(Chlamydia)[60]、大肠杆菌(Escherichia coli)[61]和乳杆菌(Lactobacillus)[62],并用于鉴定许多分类群中的细菌分离物,包括假单胞菌属(Pseudomonas)[63]、棒状杆菌(Corynebacterium)[64]和葡萄球菌(Staphylococcus)[65]。此外,该基因还可用于弧菌的分类鉴定,Dalmasso 等[40]通过设计rpoA的特异性引物,比对所有弧菌属的rpoA基因序列,建立一种基于rpoA基因的弧菌属PCR 检测方法,并引入靶向16S rRNA 基因的细菌特异性引物作为非竞争性内部扩增对照来消除假阴性结果,结果表明,该rpoA和16S rRNA 基因结合的PCR检测方法专属性强、快速、可靠,为分离菌落中弧菌属的鉴定提供一种常规的筛选技术[40]。对于rpoB基因,Ki 等[41]通过对从沿海水域分离到的29 株表型不同的弧菌进行rpoB和16S rRNA 基因序列测定以及系统发育比较成功将29 株菌划分为11 个不同的种,表明rpoB在弧菌属系统发育树上的分辨率约为16S rRNA 基因的3 倍。多重PCR 主要针对保守管家基因的变异,Tarr 等[42]建立一个弧菌的rpoB参考数据库,确定rpoB基因的870 bp 部分核苷酸序列,并结合其他管家基因,鉴定无法基于表型或多重PCR分类的弧菌分离物,认为多重PCR和rpoB的组合测序可快速准确地鉴定出对人类有致病性的主要弧菌物种,rpoB可为弧菌属的其他种提供鉴定工具。
2.4 pyrH
pyrH是编码鸟苷酸激酶的管家基因,参与生物体内嘧啶核苷酸从头合成重要嘧啶代谢活动,一般与rpoA、recA等管家基因联合作为分子标记,在弧菌鉴定中起重要作用[37]。Thompson[39]利用rpoA、recA和pyrH的分子标记位点,包括16S rRNA 基因构建的系统发育树均与以往的多相分类研究基本一致,从而确定三个位点间的种间变异,发现弧菌种(Vibriospp.)、发光细菌(Photobacteria)、肠弧菌(Enterovibrio)和盐弧菌(Salinivibrio)在各分子标记位点上均有不同程度的分化,每个物种明显地形成了依基因序列相似性而分开的簇,同一弧菌属的不同菌株rpoA、recA和pyrh基因序列的一致性分别为98%、94%和94%,说明这三个基因位点在物种间的区分能力比16S rRNA 基因序列更强。霍乱弧菌和拟态弧菌(Vibriomimicus)的表型和基因组相似,两者难以快速分离鉴定,但同时利用管家基因pyrh、recA和rpoA的特定序列对45 株来自不同地理区域和寄主的代表性菌株进行检测,发现霍乱弧菌和拟态弧菌在每个基因的基础上形成了单独的种群,同时在这三个位点上,拟态弧菌比霍乱弧菌有更多的异质性,其中pyrH基因对区分霍乱弧菌和拟态弧菌的分辨率最高[66]。这些结果表明,采用rpoA、recA和pyrh基因的多位点序列分析方法可用于这两种弧菌的鉴定。此外,González-Castillo 等[67]除利用16S rRNA 基因和管家基因pyrH的测序外,还通过包括表型特征以及DNA-DNA杂交多相分类学方法,分离鉴定出Vibrio toranzoniae。
3 毒力基因(Virulence gene)
弧菌通常由于其毒力基因的表达而具有致病性,在水产养殖和疾病诊断中,致病性弧菌的快速检测显得尤为重要,然而毒力菌株的生长特性并不明显,且与其他细菌相比,它们的种群数量极低,所以传统的培养方法难以在临床和食品样品中检测到毒力菌株[68]。因此基于毒力基因的PCR 测定法在鉴定弧菌病原体的特异性标记物方面有较高的应用价值。
3.1 tdh、trh 和tlh
溶血素(hemolysin)是一种外毒素,可攻击血细胞膜并导致细胞破裂,可能是致病性弧菌中分布最广的毒素,在感染过程中发挥多种作用。而编码热稳定直接溶血素 (thermostable direct hemolysin)、热稳定直接溶血素相关溶血素(thermostable direct hemolysin-related hemolysin)和不耐热溶血素(thermolabile hemolysin)的毒力因子基因tdh、trh和tlh与人类病原体副溶血弧菌的毒力强烈相关,被认为是副溶血弧菌的特征分子标记,也是最简单和最常用的致病性诊断基因[16]。针对三种溶血素基因tlh、tdh和trh的多重PCR 方法已用于检测墨西哥湾海水中的副溶血弧菌,tlh基因是种特异性的标记物,而tdh和trh基因是致病性菌株的标记基因,结果显示三种靶向基因具有高度特异性,58%的牡蛎样品有tlh阳性,表明存在副溶血弧菌,而58%的牡蛎样品中21%为tdh阳性,0.7%为trh阳性,表明存在牡蛎样品中的副溶血弧菌是致病性菌株[16]。2010 年还报道了同时针对tlh、tdh和trh三种靶基因的单一反应,利用SYBRGreenTM的实时聚合酶链反应检测贝类和海湾水中总副溶血弧菌和致病性副溶血弧菌,该方法快速、特异、敏感和经济高效,有助于减少与海产品相关的副溶血弧菌疾病暴发[16]。需要指出的是,因为在一些非致病性菌株中并不存在这些毒力基因,这意味着这些毒力基因不能作为所有副溶血弧菌的特异性靶标,因此,准确鉴定副溶血弧菌需要更新和更准确靶标。
3.2 toxR
toxR基因虽然广泛分布于弧菌科细菌,但在不同弧菌中调控机制不尽相同。toxR基因最先在霍乱弧菌中发现,由它编码的跨膜转录调控蛋白ToxR参与调控霍乱弧菌的一些主要毒力基因和外膜蛋白的表达[69-70]。在创伤弧菌中的ToxR 蛋白可正调控高毒性溶血素vvh 基因的表达,使其表达量提高五倍[71]。而编码副溶血弧菌的主要致病因子——热稳定直接溶血素的tdh基因也受ToxR 蛋白调控[72]。霍乱弧菌、副溶血弧菌和创伤弧菌之间toxR基因核苷酸序列的相似性为50%~ 60%[69,71-72]。这种在弧菌科中广泛分布而种间相似性较低的特性使toxR基因成为弧菌科菌种鉴定的良好分子靶标。Franco等[73]采用PCR 方法扩增哈维氏弧菌的toxR基因片段,其序列分析和比对结果表明,哈维氏弧菌toxR基因与副溶血弧菌的toxR基因序列同源性为87%,与河流弧菌(Vibrio fluvialis)的同源性为84%,与创伤弧菌的同源性为83%,与坎氏弧菌(Vibrio campbellii)的部分序列相似;与16S rRNA 基因相比,toxR基因的系统发育树差异更大,易将哈维氏弧菌、坎氏弧菌和副溶血弧菌区分开。另外,将toxR基因序列和毒力基因(tdh和trh)结合,有助于快速检测从临床标本中分离的疑似副溶血弧菌菌株,从而特异性鉴定副溶血弧菌[24]。Fu 等[74]建立了一种基于环介导的等温扩增(LAMP)技术的快速诊断方法,对靶向溶藻弧菌的toxR基因进行引物设计,成功鉴定来自105 种不同细菌分离物的93 种溶藻弧菌菌株,并通过16S rRNA 基因测序证实它们的同一性。
3.3 ctxA 和hlyA
霍乱毒素和溶血素是霍乱弧菌产生致病性的主要原因,ctxA和hlyA是产生这两种毒素的编码基因,通过PCR 扩增霍乱毒素A 亚基基因(ctxA)的部分片段(564 bp)可鉴定产毒霍乱弧菌O1 类群菌株[75],亦可与ctxA毒素调节因子基因(toxR)、60 ku 伴侣蛋白产物基因(groEL)等其他多种致病相关基因结合作为检测的靶序列,对各种环境水样中产毒霍乱弧菌进行快速检测和鉴定[76]。此外,Shangkuan 等[77]用扩增ctxA2-B 基因片段的引物和针对hlyA基因的三个引物建立了多重PCR 技术,用于产毒素霍乱弧菌和O1 型霍乱弧菌的鉴定。
4 其他基因
Wang 等[78]以编码毒力调节蛋白irgB的基因为目标,建立了针对irgB、tdh和trh基因的多重PCR检测副溶血弧菌分离株和毒力菌株的方法,结果表明,irgB基因是一种新的、有效的副溶血弧菌检测标记。hsp60基因可作为海洋弧菌系统发育分析和物种鉴定的一个有用的替代目标,以补充更常规的鉴定系统[11]。hsp60基因在不同弧菌种属间的序列同源性为71%~ 82%,同种弧菌菌株之间的序列同源性为96%~100%,可明确区分目前研究中的绝大多数弧菌物种,以及经常被传统的生化方法误认为是弧菌的嗜水气单胞菌和类志贺毗邻单胞菌[11]。编码热休克蛋白的groESL在细菌中普遍存在且高度保守,groESL基因中的基因间隔区(ISR)不仅可检测弧菌种,还可特异性地检测副溶血弧菌和创伤弧菌[79]。与其他管家基因相比,dnaJ基因在区分溶珊瑚弧菌(Vibriocoralliilyticus)和海神弧菌(Vibrio neptunius)、哈维氏弧菌和半滑舌鳎病原菌轮虫弧菌(Vibrio rotiferianus)方面优于recA和rpoA,可作为鉴定弧菌种类的新工具[80]。Nhung 等[81]还利用dnaJ基因建立了一种适用于常规诊断实验室的PCR 方法,用于鉴定霍乱弧菌、副溶血弧菌、创伤弧菌、拟态弧菌和溶藻弧菌等5 种人类病原体;除这5 种弧菌和非弧菌菌株外,其他所有菌株均无特异性PCR 片段。Machado 等[69]利用基于103 个弧菌科菌株基因组的数据平台,发现fur基因的种内相似性大于95%,与16S rRNA 基因和MLSA 分析结果一致,证明fur基因在鉴定弧菌科物种中的高分辨率及其作为一个系统发育标记的作用。fur基因系统发育能力的发现和PCR 方法的发展可用于该基因的扩增和测序,无论是单独使用,还是和MLSA中的位点一起使用,都是人们普遍关注的问题。除上述功能基因外,还有tnaA、vhhA和luxR等基因正在逐渐被用于海洋弧菌的鉴定分类[28,82-83]。
5 展望
16S rRNA 基因的分子鉴定技术已较成功地用于弧菌分类鉴定,但该方法在特定情况下无法很好地鉴定弧菌种间差异。目前,一般采用recA、gyrB、pyrH等管家基因,tdh、tlh、trh等毒力基因和16S rRNA 基因相结合进行特定弧菌的系统鉴定与分类研究。此外,近年来,MLSA 技术分子等标记技术也常用于弧菌种类鉴定,尽管提高了弧菌属系统发育的分辨率,但此类技术需进行多个位点扩增和测序,不仅提高了研究成本,其鉴定结果也存在一定误差。基因组测序技术的快速发展和微生物基因组大数据的爆炸式增长将更有利于研究人员针对弧菌基因组信息,深入发掘可用于弧菌分类鉴定的功能性基因和管家基因资源,通过不断探索新型基因分子靶标和特异性引物,实现弧菌属精准鉴定,完善分类系统,从而促进海洋弧菌的多样性研究。总之,传统的弧菌检测方法,已无法满足当前海洋弧菌的多样性研究和致病性弧菌的监测和防控工作需要,采用PCR 技术,研发新型特异种属的功能基因检测势在必行。

