结肠癌SAE2表达水平与临床病理特征及预后的相关性
刘昭诗,赖人旭*,任江南,麦蕾,高敏照
(1中山大学附属第五医院消化内镜中心,珠海 519000; 2中山大学附属第五医院消化内科,珠海 519000)
结直肠癌在全球恶性肿瘤中发病率位居第三,死亡率位居第五[1]。随着经济的发展和生活方式的改变,我国结直肠癌的发病率及病死率均上升至恶性肿瘤的前五位[2]。小泛素相关修饰物(small ubiquitin-like modi fier,SUMO)修饰作为蛋白质翻译后修饰的一种,遍及体内细胞代谢的众多过程[3],在细胞离子通道和信号转导的调控、细胞迁移和凋亡中,SUMO发挥着重要的作用[4]。SAE2是SUMO化激活酶E1的亚基之一[5],其异常表达可导致SUMO化途径的失调。研究表明,SAE2的表达水平与多种肿瘤细胞的增殖、迁移和侵袭有着密切的关系,但有关其与结肠癌关系的研究较少。本文回顾性分析了93例结肠癌组织及相对应的71例癌旁正常组织中SAE2的表达情况,并进一步探讨其与结肠癌患者临床病理特征及预后之间的关系。
材料与方法
1 研究对象
收集2010年1月至2014年12月在中山大学附属第五医院就诊并接受手术治疗的164例结肠病理组织(其中结肠癌组织标本93例,相对应的癌旁正常组织标本71例,22例结肠癌病例无癌旁组织),所有结肠癌组织经病理证实为R0切除(即手术切缘镜下观察阴性)。纳入标准包括手术切除的肿瘤病灶、经手术病理证实为原发性结肠癌、具有完整临床资料、无术前放疗和化疗等治疗。排除标准包括原位癌(高级别上皮内瘤变)、直肠及盲肠和肛管恶性肿瘤、结肠转移性癌、同时存在其他部位原发恶性肿瘤、遗传性非息肉病性结肠癌。
2 病例临床特征
结肠癌患者医疗记录内容包括:社会人口学特征如年龄、性别等;临床病理资料如肿瘤部位、肿瘤直径、病理类型、分化程度、肠壁浸润深度、淋巴结转移情况、远处转移情况、术后有无放化疗等。肿瘤病理分期标准:采取美国癌症联合委员会或国际联合抗癌委员会(UICC/AJCC)的结肠癌(第七版)TNM分期系统进行结肠癌病理分期。解剖分布根据国际标准的第三版肿瘤分类法分为3组:右半结肠(包括升结肠、结肠肝曲、横结肠)组、左半结肠(包括结肠脾曲、降结肠、乙状结肠)组、其他(跨越多个肠段等)组。
3 免疫组织化学染色
采用免疫组织化学PV-6000二步法检测SAE2的表达,所使用的第一抗体为兔抗人SAE2多克隆抗体(1:100;Abcam公司,ab58451),以PBS溶液代替一抗作为阴性对照,以抗体说明书指示的肺腺癌组织(SAE2表达阳性)作为阳性对照。实验结果以细胞核或细胞质出现棕褐色的强度和面积作为SAE2蛋白表达程度的判断标准分为4级:无染色或染色面积<10%为SAE2(0);染色模糊且可见染色面积大于10%为SAE2(1+);中等染色面积大于10%为SAE2(2+);强染色面积大于10%为SAE2(3+)(由两名病理医生双盲法10倍物镜下随机观察10个视野;SAE2 0~1+为表达阴性表达,SAE2 2+~3+为表达阳性表达)。
4 随访记录
随访资料记录内容:随访起始时间为手术治疗日期;随访截止日期为2018年2月28日;终点事件是患者的主要死因为结肠癌转移、复发或结肠癌相关并发症;完全数据是指随访起始至终点事件出现;生存时间均以月为单位记录。计算病人1年、3年和5年生存率,如果病人生存时间超过1年,则将截断时间定义为1年;若病人因非肿瘤因素导致死亡或中途失访,生存时间即为截断时间;如果病人生存时间短于1年,则为发生终点事件。3年和5年生存率以此类推。
5 统计学方法
应用SPSS 22.0软件进行统计分析,SAE2的组间表达的差异比较应用分类变量的χ2检验;临床病理因素应用Kaplan-Meier单因素生存分析、Log-Rank法检验;应用 Cox 回归比例风险模型筛选影响结肠癌患者生存预后的独立危险因素。所有统计检验均为双侧检验,检验水准为α=0.05,P<0.05视为差异有统计学意义。
结 果
1 SAE2在结肠癌组织中高表达
SAE2在93例结肠癌标本中34例为阳性表达,59例为阴性表达,阳性表达率为36.6%(34/93);在71例癌旁正常结肠标本中2例为阳性表达,69例为阴性表达,阳性表达率为2.8%(2/71)。将结肠癌组织与癌旁正常组织镜下观察结果对比显示:SAE2表达水平在结肠癌组织标本中较癌旁正常组织标本高,差异具有统计学意义(χ2=26.756,P<0.001)(图 1和表1)。
2 SAE2表达水平与结肠癌临床病理因素相关
SAE2阳性表达率在不同性别、年龄、肿瘤大小、肿瘤部位、浸润深度、分化程度、病理类型中,差异无统计学意义(均P>0.05)。不同Dukes分期中,C+D期者SAE2阳性表达率为53.5%,A+B期者为22.0%,其差异具有统计学意义(χ2=12.956,P<0.001)。不同TNM分期中,SAE2阳性表达率在I期、II期、III期、IV期分别为0%、29.4%、32.4%、38.2%,差异具有统计学意义(χ2=11.480,P<0.05)。SAE2阳性表达率在有淋巴结转移者为51.4%,无淋巴结转移者为27.6%,差异具有统计学意义(χ2=5.350,P<0.05)。SAE2阳性表达率在有发生远处转移者为68.4%,无远处转移者为28.4%,差异具有统计学意义(χ2=10.452,P<0.001)(表2)。

图1 SAE2在结肠/结肠癌组织中的表达。A,阴性对照组;B,阳性对照组;C,SAE2(0);D,SAE(1+);E,SAE(2+);F,SAE(3+);比例尺,20μmFig.1 Expression of SAE2 in normal colon/colon cancer tissue. A, negative control;B, positive control;C, SAE2(0);D, SAE(1+);E, SAE(2+);F,SAE(3+); scale bar, 20μm
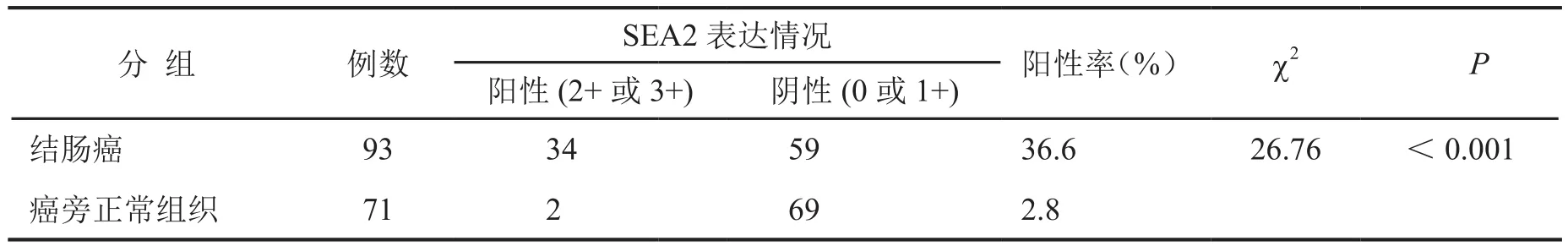
表1 SAE2在结肠癌和癌旁正常组织的表达Tab. 1 The expression of SAE2 in colon cancer and adjacent normal tissues

表2 SAE2与结肠癌临床病理因素的关系Tab. 2 Relationship between SAE2 and clinicopathological factors of colon cancer
3 SAE2表达水平与结肠癌患者预后相关
进行随访的93例结肠癌患者中,最短随访时间为0个月,最长随访时间为95个月,中位随访时间为41.0个月,平均随访时间为40.73个月,中位生存时间为26.00个月。直至2018年2月28日随访停止时,有65个受访者仍然存活。生存期超过5年的有24例,占患者总数的25.8%。有29例发生死亡,其中有28例死于结肠癌所致的复发或转移、并发症等,另有1例为因其他疾病死亡。有6名受访者在发生了复发或远处转移后,直到随访截止时仍然存活。
低年龄组1年生存率、3年生存率、5年生存率分别为98%、86%、76%,而高年龄组1年生存率、3年生存率、5年生存率分别为80%、54%、52%,差异具有统计学意义(P<0.05)。Dukes分期为A+B期者1年生存率、3年生存率、5年生存率分别为98%、93%、90%,C+D期者1年生存率、3年生存率、5年生存率分别为81%、45%、32%,差异具有统计学意义(P<0.001)。TNM分期为I期者5年生存率达100%,II期、III期、IV期者1年生存率分别为100%、94%、67%,3年生存率85%、69%、26%,5年生存率71%、69%、7%,差异具有统计学意义(P<0.001)。肿瘤浸润深度为T1+T2期、T3期、T4期1年生存率分别为100%、96%、76%,2年生存率分别为80%、82%、49%,5年生存率分别为80%、76%、35%,差异具有统计学意义(P<0.05)。无淋巴结转移组患者1年生存率、3年生存率、5年生存率分别为98%、86%、80%,有淋巴结转移组患者1年生存率、3年生存率、5年生存率分别为77%、48%、36%,较无淋巴结转移组的生存率下降,以5年生存率下降最为显著,差异具有统计学意义(P<0.001)。无远处转移患者1年生存率、3年生存率、5年生存率分别为90%、83%、68%,而有远处转移组患者生存率明显下降,其1年生存率、3年生存率、5年生存率分别为30%、10%、10%,其差异具有统计学意义(P<0.001)。SAE2表达阴性者1年生存率、3年生存率、5年生存率分别为96%、86%、80%, SAE2表达阳性者1年生存率、3年生存率、5年生存率分别为81%、50%、41%,5年生存率降低更为明显,其差异具有统计学差异(P<0.001)(表3和图2)
4 SAE2是结肠癌患者生存时间的独立影响因素
将单因素分析所得具有统计学意义的因素纳入Cox多元回归模型表4所示,不同Dukes分期、不同浸润深度、有无淋巴结转移和有无远处转移对生存时间影响的差异无统计学意义(均P>0.05)。SAE2表达阳性者较阴性者死亡风险升高(P<0.05)。高年龄组较低年龄组死亡风险升高(P<0.05)。高TNM分期者较低TNM分期者死亡风险升高(P<0.05)(表4)。

表3结肠癌患者预后的单因素分析Tab.3 Univariate analysis of prognosis in patients with colon cancer
讨 论
研究表明,SAE2的表达水平与多种肿瘤细胞如骨肉瘤细胞、乳腺癌、肝癌细胞、胆管癌、肺癌等的增殖、迁移和侵袭有着密切的关系[6-11],且SAE2的表达水平与肿瘤的TNM分期和肿瘤分化程度相关[12],同时与患者的生存预后成一定相关性,但与结肠癌关系尚不十分明确。本实验应用免疫组化法对164例结肠组织标本中SAE2的表达水平进行检测,结果发现93例结肠癌标本中阳性表达率达到36.6%(34/93),而在71例对应的癌旁正常标本中阳性表达率仅为2.8%(2/71),结肠癌组织中SAE2的阳性表达率明显高于癌旁正常组织。实验结果表明SAE2在结肠癌组织中高表达,提示着SAE2可能是结肠上皮细胞发生恶变的重要环节,有望成为结肠癌诊断和治疗的靶标。

图2 结肠癌患者生存状况的Kaplan-Meier单因素分析Fig. 2 Kaplan-Meier univariate analysis of survival status of colon cancer patients

表4 影响患者预后的Cox多元回归分析Table 4 Cox multivariate regression analysis of prognosis in patients
在Shao[13]的研究中,SAE2的表达与肿瘤浸润的深度、是否发生远处转移、患者的TNM分期有着明显的相关性,胃癌细胞的增殖和转移潜力在敲除SAE2降低其表达后得到减弱。而在Liu[11]课题组中,实验表明降低SAE2的表达后,不仅可以延缓肺癌细胞的生长、增加其凋亡的发生,还可降低肿瘤的迁移能力和侵袭性。Cheng[14]和Ji[15]的研究结果显示,SAE2可能通过Wnt/β-catenin信号通路影响结直肠癌或胃癌肿瘤细胞的侵袭性和迁移。以上结果均表明SAE2与肿瘤的发生和侵袭性密切相关,但目前国内外对SAE2与结肠癌发生、发展的关系研究较少且不深入。在本研究中,93例随访对象被按年龄、性别、Dukes分期、TNM分期、肿瘤部位及大小、浸润深度、分化程度、病理类型等分为不同亚组。通过统计学方法对不同亚组中结肠癌患者临床病理资料以及SAE2的表达水平进行分析后结果显示:SAE2在结肠癌组织中的表达水平与患者的性别、年龄、肿瘤大小、肿瘤部位、浸润深度、分化程度、病理类型无关,与患者的Dukes分期、TNM分期、是否发生淋巴结或远处转移有关。患者的Dukes分期越晚,SAE2阳性表达率越高,C+D期的患者SAE2阳性表达率高于A+B期。同时,随着TNM分期增加SAE2阳性表达率也在增加,I期、II期、III期、IV期患者的SAE2阳性表达率呈现递增趋势(I期为0%、II期为29.4%、III期为32.4%、IV期为38.2%),IV期的阳性表达率最高,显著高于阳性率为0%的I期患者。SAE2的阳性表达率在有淋巴结转移或远处转移的患者中显著高于无淋巴结或远处转移的患者。在肿瘤浸润深度上,SAE2的阳性表达率随着浸润深度的增加呈现上升的趋势,T1+T2中SAE2阳性率为16.7%,T3中SAE2阳性率为33.9%,T4中SAE2阳性率为48.0%,但各组间差异无统计学意义,考虑与所收集的组织标本主要集中在T3分期导致的组间分布不均对结果造成了一定的偏倚有关。SAE2与肿瘤的临床分期以及转移情况密切相关,提示SAE2的高表达可能在结肠癌的发生、发展、侵袭过程起着促进的作用,其异常不仅提示着肿瘤的存在,同时还可能反映肿瘤发展、浸润的程度,其可以预测结肠癌的转移情况,与前述研究发现具有一致性。
在本研究单因素分析中,患者的生存时间与年龄、Dukes分期、TNM分期、肿瘤浸润深度、有无淋巴结核转移或远处转移以及SAE2在结肠癌中的表达水平有关,与分化程度、病理类型、术后有无放化疗等无关。通过建立Cox多元回归模型分析得知年龄、TNM分期以及SAE2在肿瘤组织的表达水平是影响患者生存预后的独立危险因素。SAE2是结肠癌患者生存时间的独立影响因素,且其表达与肿瘤Dukes分期、TNM分期浸润深度、淋巴结转移、远处转移相关,预示其在评估结肠癌的转移情况、判断预后存在潜在价值,可作为判断结肠癌进展情况以及生存预后的一个重要标志物。
本研究属于回顾性研究,结肠癌患者部分资料,如患者其他感染情况、手术方式和治疗记录等情况登记不完整,故未对其与结肠癌患者总体生存期进行统计分析。另外,部分结肠癌患者的失访也造成了一定的信息偏倚。
综上所述,SAE2与结肠癌的发生、侵袭性以及预后密切相关,在结肠癌患者的诊治中结合TNM分期加入SAE2的检测,或许可使结肠癌诊治更具有客观性和个体化。

