小鼠胰腺石蜡切片制作程序优化与免疫荧光染色探索
赵晶晶,庄宝祥,李如江*
(1潍坊医学院组织学与胚胎学教研室,山东省高校重点实验室;2潍坊医学院形态学实验室,潍坊261053)
石蜡切片是组织学常规制片最广泛应用的方法,经取材、固定、脱水、透明、浸蜡、包埋、切片、摊片、贴片和烤片等一系列步骤而成[1,2]。因小鼠胰腺为非实体器官,外分泌部腺泡呈散在分布,故其石蜡切片常常碎裂不完整,组织褶皱,免疫组织化学染色时易脱片,严重影响后续研究;笔者在以1型糖尿病小鼠进行研究时发现,胰腺组织免疫荧光染色易致假阳性结果。对此,笔者通过系统实验,探索1型糖尿病小鼠胰腺石蜡切片及其免疫荧光染色的优化策略,以制备优质的石蜡切片和规避免疫荧光假阳性染色,以期为后续胰腺相关研究提供技术保障。
材料与方法
1 实验动物
3月龄雄性C57BL/6J小鼠,购自济南动物实验中心。
2 主要试剂和实验仪器
鼠抗高血糖素抗体(BOSTER)、兔抗高血糖素抗体(BOSTER)、FITC-山羊抗兔二抗(ZSGBBIO)、FITC-山羊抗小鼠二抗(ZSGB-BIO)。石蜡包埋机、切片机(LEICA RM2235轮转切片机)、摊烤片机(科迪KD-T电脑生物组织摊烤片机)。
3 模型制作和取材固定
链脲佐菌素 40mg/(kg·d)连续5d腹腔注射,诱导小鼠1型糖尿病。颈椎脱臼处死,取胰腺,于滤纸上堆积成型,浸于4%多聚甲醛固定48h。
4 脱水、透明、浸蜡和包埋
脱水:将固定的胰腺梯度酒精脱水,依次为70%乙醇30 min、80%乙醇20 min、95%乙醇5/10/15/20 min×2次、100%乙醇4/6/8/10 min×2次,即95%、100%乙醇脱水分别尝试4个不同的时间。
透明:分别选用二甲苯、氯仿、苯3种透明试剂,各尝试3个时间段。苯10/15/20 min×2次,或氯仿10/15/20 min×2次,或二甲苯透明时间为6/8/10 min×2次。
浸蜡:浸蜡时仅一次硬蜡,65℃,分别浸蜡60、90、120 min。
包埋:石蜡包埋,凝固备用。
5 切片与免疫荧光染色
切片后进行如下常规处理:47℃摊片、贴片后61℃烤箱1 h、37℃烤箱1周。
常规免疫荧光染色[3],其中一抗为小鼠抗高血糖素抗体(1:100)、兔抗高血糖素抗体(1:100),二抗为FITC-山羊抗小鼠抗体(1:100)、FITC-山羊抗兔抗体(1:100)。
结 果
1 脱水时程过短或过长均致组织碎裂
95%、100%乙醇脱水,时间过短致透明不全,时间过长致组织变脆,过短、过长皆导致切片时组织碎裂不能成型。如95%乙醇5/10min×2次、100%乙醇4min×2次时小鼠胰腺透明不全;95%乙醇20min×2次、100%乙醇10min×2次时小鼠胰腺组织脆,难以切片成型。
2 苯的透明效果较好
二甲苯透明速度快,但8/10min×2次时已使胰腺组织变脆,严重影响切片质量;氯仿、苯透明速度较二甲苯慢,但15/20min×2次时已完全透明,且组织脆性尚可,切片成型、皱褶较少,不过氯仿透明的石蜡切片显微镜下可见许多蜂窝状空洞(图1A)。

表1 不同时间对小鼠胰腺石蜡切片质量的影响Tab. 1 The effect of different time on the quality of paraf fin sections of pancreas from mice
3 石蜡切片的综合时程效果
95%乙醇15min×2次、100%乙醇6min×2次、苯15min×2次、浸蜡90min后石蜡包埋,切片时未出现组织过脆、破碎等现象,其切片质量较好、组织完整、皱褶较少,镜下胰腺结构清晰(表1,图1A)。
为进一步优化切片质量,在上述实验基础上对各时间稍作微调,其结果显示95%乙醇15min×2次、100%乙醇Ⅰ6min、100%乙醇Ⅱ7min、苯Ⅰ15min、苯Ⅱ18min、浸蜡90min时其切片质量最优(表1)。
4 小鼠源抗体免疫染色1型糖尿病小鼠胰腺时易出现假阳性荧光
1型糖尿病小鼠胰腺石蜡包埋时以氯仿透明,致使胰腺组织内出现许多空洞(图1A)。以小鼠抗高血糖素抗体或PBS代替一抗+FITC-山羊抗小鼠抗体进行免疫荧光染色时,胰岛周围或胰腺淋巴组织内易出现假阳性的荧光染色(图1B、1C);以兔抗高血糖素抗体进行免疫荧光染色时胰岛呈阳性反应(图1A),但鉴于1型糖尿病胰岛常有淋巴细胞浸润,为除外上述淋巴细胞假阳性染色的可能,以兔抗高血糖素抗体行胰腺(含淋巴组织)免疫荧光染色,胰腺淋巴组织内未见阳性荧光(图1D)。
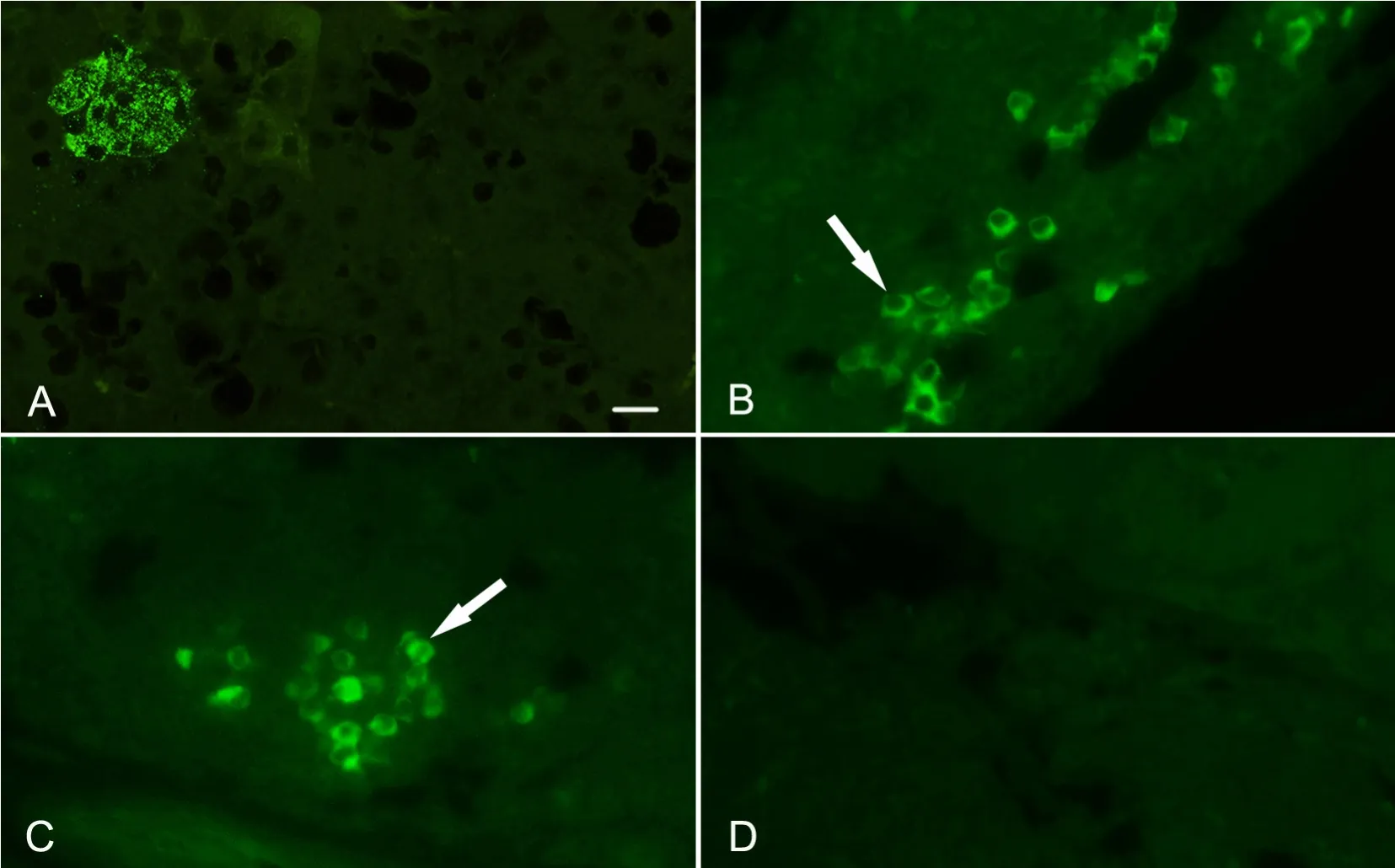
图1 1型糖尿病小鼠胰腺高血糖素免疫荧光染色。A,石蜡包埋时以氯仿透明,致使胰腺组织内出现许多空洞(一抗为兔抗高血糖素抗体);B,胰岛周围或胰腺淋巴组织内的假阳性染色(箭头):无一抗(以PBS替代),二抗为FITC-山羊抗小鼠抗体;C,胰岛周围或胰腺淋巴组织内的假阳性染色(箭头):一抗为小鼠抗高血糖抗体;D,无假阳性染色:一抗为兔抗高血糖素抗体;标尺,20μmFig. 1 Immuno fluorescent staining for glucagon in the pancreas from type 1 diabetic mice. A, transparency by chloroform during paraf fin embedding caused many cavities in the pancreatic tissue, rabbit anti-glucagon antibody as primay antibody; B, false-positive immuno fluorescent staining around pancreatic islets or inside pancreatic lymphoid tissue (arrows): without primay antibody (replaced by PBS), FITC-conjugated goat-anti-mouse antibody as secondary antibody; C, false-positive immuno fluorescent staining around pancreatic islets or inside pancreatic lymphoid tissue (arrows); mouse anti-glucagon antibody as first antibody; D, no false-positive immuno fluorescent staining; rabbit anti-glucagon antibody as first antibody; scale bar, 20μm
讨 论
脱水,即用脱水剂除去组织水分,并使组织进一步固化,为后续透明及浸蜡创造条件[3]。脱水不足,影响透明浸蜡效果;脱水过度,组织易脆,切片时组织难以成型,易碎裂。高浓度乙醇脱水效果强,但需严格控制时间,故本实验探索了95%、100%乙醇脱水时间,尤其是100%乙醇脱水,以免脱水过度。诸多文献表明[4,5],动物器官(切成0.5×0.5×0.5 cm3左右)石蜡包埋时,95%乙醇、100%乙醇梯度脱水分别超过1h、甚至3h以上。本实验中小鼠胰腺为非实体性器官,其梯度乙醇脱水时间与前述文献不同,室温下95%乙醇15 min×2次、100%乙醇Ⅰ6 min、100%乙醇Ⅱ7 min时效果最佳。
苯、二甲苯以及氯仿等因混溶于乙醇及石蜡,故可应用于组织浸蜡前的透明。研究发现,透明可导致组织收缩、变硬、变脆,故须严格控制透明时间[6]。本实验发现:二甲苯透明速度快,但8/10 min×2次时已使胰腺组织变脆,严重影响切片质量。故二甲苯透明作用虽强,但胰腺透明时不易控制时间,极易透明过度。已有实验表明:苯在透明心、肝、肺和脑等器官(厚约0.3 cm)时,透明时间可达8 h左右,且透明效果好[7],故本实验为更好把控透明时间,选用了苯或氯仿作为透明试剂,发现两者透明效果较为缓和,时间可控,又能明显减轻组织过脆的现象,但氯仿挥发性较强,透明组织内氯仿易挥发,致使组织浸蜡常常不充分,其切片染色后呈现诸多空洞。综上,胰腺组织透明时应将苯作为首选透明剂。
浸蜡是使石蜡逐渐置换透明剂,以达到支持组织的目的。浸蜡进一步提高了组织的硬度和脆性,同时浸蜡时间不足,组织内可留有孔洞,无法切出完整切片,故浸蜡时间仍需探索。本实验中浸蜡时间1.5h为最优,以避免浸蜡不足,切片不完整,或浸蜡过度,组织过度收缩、变硬和变脆。
以1型糖尿病小鼠胰腺进行研究时发现,利用小鼠抗高血糖素抗体进行免疫荧光染色时在胰岛周围或胰腺淋巴组织内呈现明显的免疫荧光染色,为求进一步确认,本实验又以兔抗高血糖素抗体进行免疫荧光染色,并未呈现前者的荧光,同时又以PBS替代一抗进行免疫染色时,也呈现了如小鼠抗高血糖素抗体免疫荧光染色时相似的染色结果,故推测在胰岛周围或胰腺淋巴组织内的阳性荧光染色为假阳性荧光染色。
胰岛炎症,即胰岛周围和内部免疫细胞浸润,为1型糖尿病病理标志。1型糖尿病小鼠胰腺组织中单核巨噬细胞、B淋巴细胞、部分T细胞等可含IgG[8],本实验中FITC-山羊抗小鼠二抗便可与之特异性结合,导致假阳性染色。所以,1型糖尿病或胰腺炎时,为避免胰腺免疫组化染色的假阳性,应尽量避免选择同种动物源的一抗等,同时实验过程中常规做阳性、阴性对照,以明确阳性结果。

