肌萎缩侧索硬化症小鼠海马神经元内CaMKII-α减少而CAMKII-β增多
蒋欣 ,管英俊,陈燕春,刘金梦 ,周风华,王巧真,张皓云
(潍坊医学院,1临床医学院,2神经疾病与再生修复实验室,潍坊261053)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种以运动系统损害为特征的神经系统变性疾病,其发病机制尚未阐明[1]。错误折叠的超氧化物歧化酶1(superoxide dismutase 1, SOD1)累积所造成的氧化应激异常及神经毒性是ALS发病的重要原因之一[2]。除了运动系统病变外,部分ALS患者也出现认知障碍和进行性海马病理学改变[3]。
钙/钙调蛋白依赖性蛋白激酶II(calcium/calmodulin-dependent protein kinase-II, CaMK II)是一种多功能蛋白激酶,主要由α和β亚基组成,它们在脑组织中的分布是非神经组织的20~50倍,尤以海马区更高[4],但海马CaMKII-α和CaMKII-β在ALS发病中的作用尚未阐明。本实验选取模拟ALS的SOD1-G93A转基因模型小鼠,应用形态学和分子生物学方法检测海马中CaMKII-α和CaMKII-β的表达变化及其细胞类型,明确与ALS病变的关系,为从新的角度系统阐明ALS发病机制提供理论依据。
材料与方法
1 实验动物
SOD1-G93A转基因小鼠和野生型(wild-type,WT)小鼠,购自Jackson实验室。按Chen等[5]方法进行基因型鉴定,于发病早期(95d)、中期(108d)和晚期(122d)进行实验取材。
2 实验试剂
CaMKII-α兔多克隆抗体,Proteintech公司;CaMKII-β兔多克隆抗体, abcam公司;GAPDH兔单克隆抗体,GAPDH小鼠单克隆抗体,Proteintech Group 公司;Cy3标记的羊抗兔IgG和FITC标记的羊抗小鼠IgG,Jackson Immunoresearch实验公司;小鼠抗β-tubulinⅢ,R&D 公司;反转录试剂盒,TOYOBO公司。
3 CaMKII-α、CaMKII-β 免疫荧光染色
鼠脑冷冻切片PBS清洗3次,每次5 min,滴加10%山羊血清,37℃孵育40min,甩掉羊血清,分别滴加兔抗CaMKII-α(1:150)和小鼠抗β-tubulinⅢ(1:100)或者兔抗CaMKII-β(1:150)与小鼠抗β-tubulinⅢ(1:100)混合一抗,4℃孵育过夜。次日,PBS清洗5min,重复3次,滴加FITC标记的羊抗小鼠和Cy3标记的羊抗兔荧光二抗(终浓度为1:400),37℃避光孵育40min,滴加Hoechst标记细胞核,37℃避光孵育15min,防淬灭荧光封片剂封片,对照组一抗用PBS代替。在荧光显微镜下观察CaMKII-α、CaMKII-β 及 β-tubulin Ⅲ表达情况。
4 CaMKII-α、CaMKII-β mRNA RT-PCR 检测
参照Chen等[5]方法进行RNA提取及逆转录反应。PCR扩增反应:CaMKII-α上游引物5'-AGTCAGCCTGCATCGCCTAT-3',下游引物5'-TGTGGAAGTGGACGATCTGC-3';CaMKII-β上游引物5'-TACCGGCCATGAGTATGCAG-3',下游引物5'-GGCGTACAATGTTGGAATGC-3';β-actin引物序列见Chen等[5]文章;2 × Flash Hot Start Master Mix 10μl,CaMKII-α 或 CaMKII-β 上下游引物各0.5μl,β-actin上游引物、下游引物各0.5μl,1μl逆转录产物作为模板,组成 PCR 反应体系。PCR仪中运行程序:94℃预变性3min,94℃变性30s,58℃退火30s,72℃延伸30s,共30个循环,72℃延伸5min后冷却至4℃。琼脂糖凝胶电泳,紫外灯下观察结果,拍照保存图像。
5 CaMKII-α、CaMKII-β Western Blot检测
取ALS小鼠和WT小鼠海马,加入裂解液冰上裂解30min,期间超声破碎3次,4℃、12000 rpm/min离心15min,取其上清,检测蛋白浓度。配制12% SDS-DAGE凝胶,电泳后孵育一抗GAPDH(1:2000)、CaMKII-α(1:800)、CaMKII-β(1:1000),4℃过夜。次日,常温孵育羊抗小鼠或羊抗兔二抗(1:10000)2h,PBS清洗后滴加ECL孵育,化学发光凝胶成像系统成像,拍照保存图像。
6 统计学分析
应用IPP6.0图像分析软件测量CaMKII-α、CaMKⅡ-β mRNA与β-actin mRNA阳性条带、CaMKII-α、CaMKⅡ-β蛋白和GAPDH蛋白阳性条带的光密度值,样本中目的基因与管家基因mRNA和蛋白光密度值的比值来反映其含量变化。SPSS20.0软件处理实验数据,以均数±标准差(x±s)表示计量检测结果。两组比较采用独立样本t检验,当P<0.05时表示差异有统计学意义。
结 果
1 CaMKII-α定位于海马神经元且在ALS转基因小鼠表达降低
免疫荧光分析显示,在ALS转基因小鼠与WT小鼠海马中均可检测到CaMKII-α免疫阳性细胞,分布在海马DG区和CA区,并与β-tubulin Ⅲ标记的神经元共存。与WT小鼠相比,CaMKII-α在ALS转基因小鼠海马CA区和DG区细胞中免疫反应性95d无明显变化,108d和122d均明显降低(图1)。
RT-PCR检测显示,在ALS转基因小鼠与WT小鼠海马中均可见CaMKII-α mRNA阳性条带。与WT小鼠相比,ALS转基因小鼠海马CaMKII-α mRNA的变化不明显。
免疫印迹分析表明,ALS转基因小鼠与WT小鼠海马均可检测到明显的CaMKII-α蛋白条带。与WT小鼠相比,ALS转基因小鼠CaMKII-α蛋白在95d无明显变化,108d和122d均明显降低(图2)。
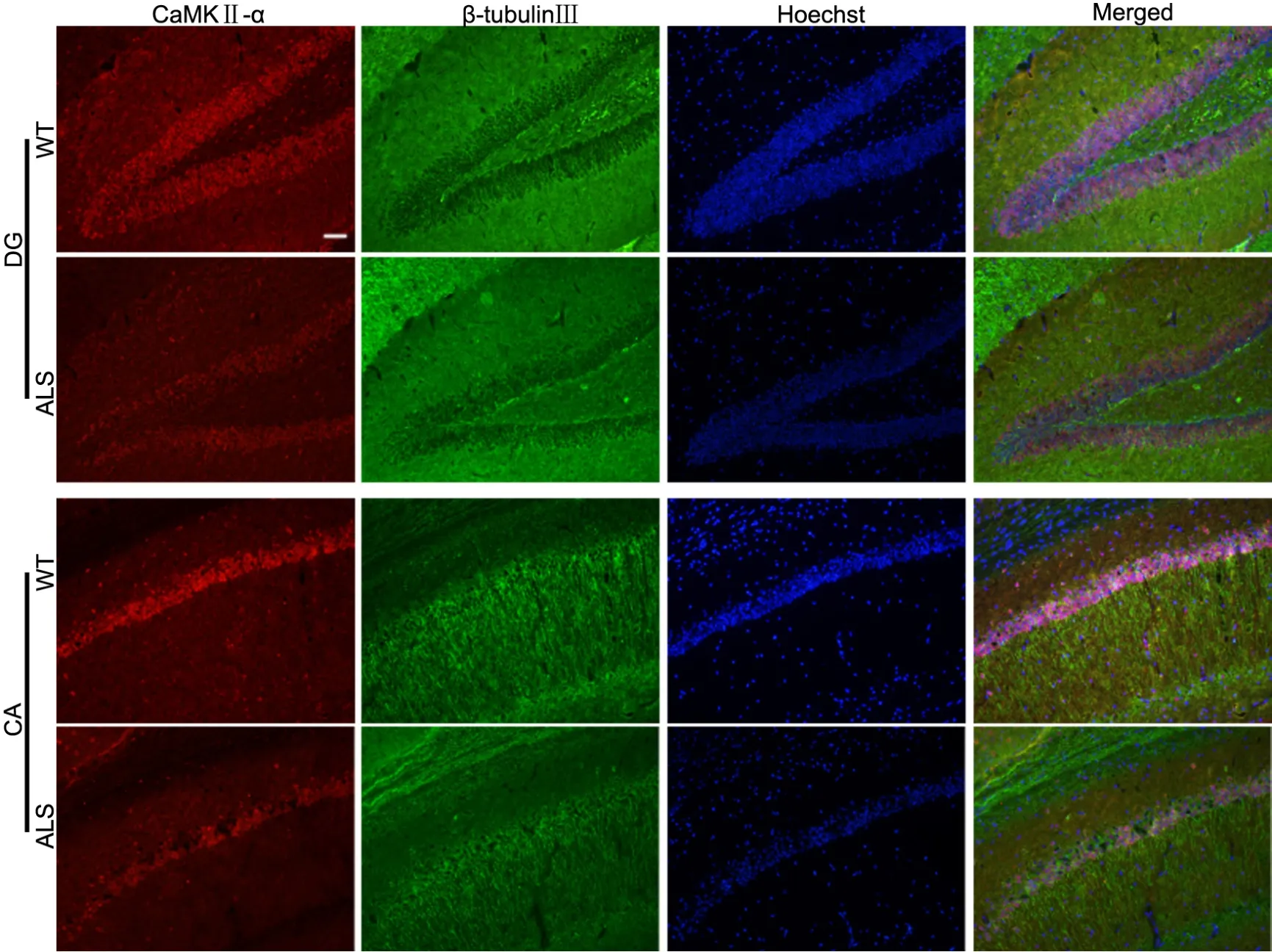
图1 108d ALS转基因小鼠海马CA区和DG区CaMKII-α表达变化及与β-tubulin III共定位的免疫荧光检测。比例尺,50μmFig. 1 Immuno fluorescent examination for CaMKII-α expression change and co-localization with β-tubulin III in the CA and DG areas of the hippocampus in 108-day-old ALS mice. Scale bar, 50μm
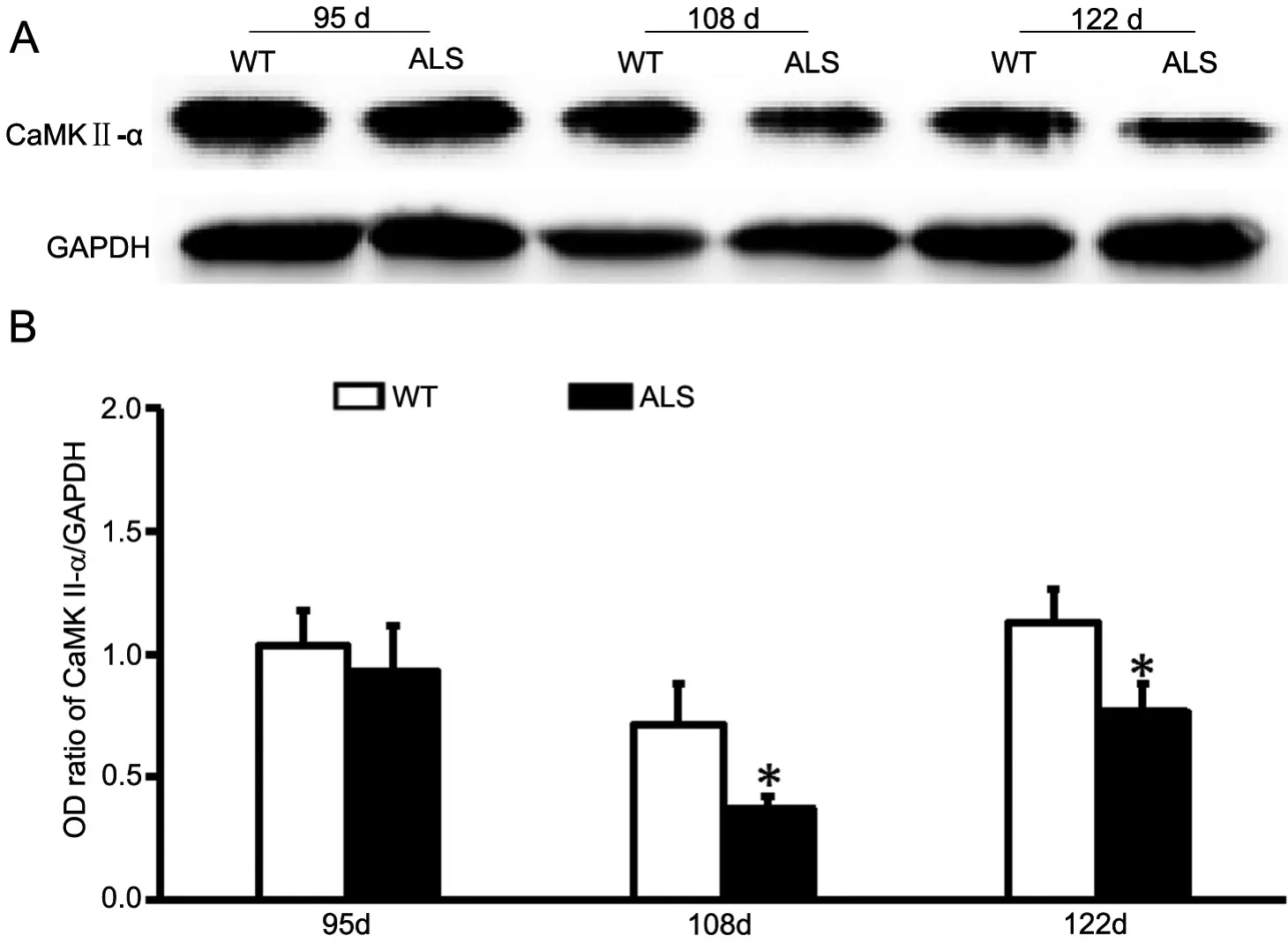
图2 ALS转基因小鼠海马中CaMKII-α表达变化的Western blot检测(A)与统计学分析(B)。*,与WT小鼠比较,0.01<P<0.05;n = 4Fig. 2 Western blotting (A) and statistical analysis (B) for CaMKII-α expression change in the hippocampus of ALS mice. *, 0.01<P<0.05 vs WT mice;n = 4
2 CaMKII-β定位于海马神经元且在ALS转基因小鼠表达升高
免疫荧光染色显示,在ALS转基因小鼠与WT小鼠海马中均可检测到CaMKII-β免疫阳性细胞,分布在海马DG区与CA区,与β-tubulin Ⅲ标记的神经元共存。与WT小鼠相比,CaMKII-β在ALS转基因小鼠海马CA区和DG区细胞中免疫反应性95d无明显变化,108d和122d明显升高(图3)。
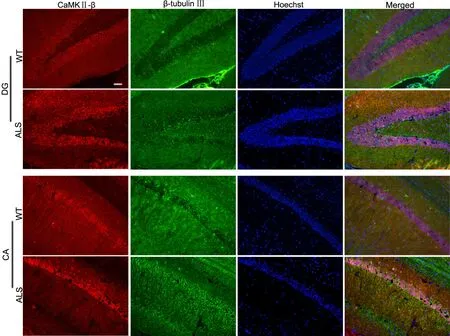
图3 108d ALS转基因小鼠海马CA区和DG区CaMKII-β表达变化及与β-tubulin III共定位的免疫荧光检测。比例尺,50μmFig. 3 Immuno fluorescent examination for CaMKII-β expression change and co-localization with β-tubulin III in the CA and DG areas of the hippocampus in 108-day-old ALS mice. Scale bar, 50μm
RT-PCR分析表明,在ALS转基因小鼠与WT小鼠海马中均可见CaMKII-β mRNA阳性条带。与WT小鼠相比,ALS转基因小鼠海马CaMKII-β mRNA的变化不明显。
免疫印迹结果显示,ALS转基因小鼠与WT小鼠海马均可检测到明显的CaMKII-β蛋白条带。与WT小鼠相比,ALS转基因小鼠CaMKII-β蛋白在95d呈升高的趋势,108d和122d均明显升高(图4)。
讨 论
一般认为ALS是一种运动系统疾病,但临床上发现部分患者出现运动系统外的症状,如痴呆、感觉障碍等,其确切发病机制尚不明确[1]。海马是大脑内与学习、记忆等高级神经活动有关的结构。临床研究证明,ALS影响大脑中的皮质下结构,如丘脑、壳核、苍白球和海马体[6]。Westeneng等[7]发现,MRI显示ALS患者海马体的体积减少,表明海马可能参与ALS神经退行性过程。Quarta等[8]发现,SOD1-G93A突变的ALS小鼠海马中间神经元的减少会导致焦虑样行为和选择性学习障碍的发生。
大多数CaMKII全酶是α/β异源体,α/β为3:1,且二者比率具有可变性[4]。研究表明,阿尔兹海默症发病过程中,神经突触CaMKII活性的降低发挥重要作用[9]。本实验以CaMKII为突破点,探究ALS转基因小鼠海马中CaMKII-α和CaMKII-β的变化。实验结果显示,与WT小鼠相比,ALS转基因小鼠海马中CaMKII-α蛋白在发病过程中降低,而CaMKII-β蛋白则升高。提示CaMKII-α蛋白和CaMKII-β蛋白的异常表达与ALS发病相关。
Thiagarajan 等[4]发现,CaMKII-α 和 CaMKII-β的比率随神经元活动性增加而增大,神经元活动性降低而减小。体内神经突触根据对谷氨酸和γ-氨基丁酸敏感性的不同可分为兴奋性神经突触和抑制性神经突触,兴奋性突触使突触后膜去极化导致神经元兴奋性升高,抑制性突触通过阴离子门控通道使突触后膜超极化导致神经元兴奋性降低。研究发现,在体内CaMKII的α亚单位只表达在兴奋性中间神经元,但是β亚单位除表达在兴奋性神经元外,也表达于抑制性中间神经元[10]。研究证明,记忆形成过程取决于CaMKII-α与受体结合的持续作用,并未发现有CaMKII-β的作用[11]。本实验发现CaMKII-α蛋白在ALS发病过程中降低,CaMKII-β蛋白则升高,该结果与Thiagarajan等研究结果一致。CaMKII-α和CaMKII-β mRNA水平没有发生改变,而蛋白水平有变化,推测这种现象可能是受到miRNA的调节所致。MiRNA是约22个核苷酸的小RNA,与许多mRNA上的互补区域结合,促进它们的降解并抑制它们的翻译。Zhou等[12]发现mir-124可通过靶向调控ALS转基因小鼠中的下游基因来调节神经干细胞的分化,下游基因蛋白水平显著改变,mRNA水平保持不变,表明ALS病变过程有miRNA的参与。Kocerha等[13]研究发现,C57BL/6J小鼠中mir-219具有负性调节CaMKII的作用。

图4 ALS转基因小鼠海马中CaMKII- β表达变化的Western blot检测(A)与统计学分分析(B)。*,与WT小鼠比较,0.01<P<0.05;n= 4Fig. 4 Western blotting (A) and statistical analysis (B) for CaMKII- β expression change in the hippocampus of ALS mice. *, 0.01<P<0.05 vs WT mice;n = 4
CaMKII作为Wnt非经典通路下游重要信号分子,参与调控Wnt信号通路。Wnt信号通路在短期调控海马神经元活动中发挥重要作用。本课题组前期研究发现,多种Wnt信号分子在ALS转基因小鼠脑组织中表达异常[14,15]。CaMKII表达变化与Wnt信号通路的关系及其在ALS发病中的作用机制有待进一步阐明。

