白藜芦醇通过失活FoxO1及激活Sirt1在IL-1β处理的SW1353细胞中发挥抗骨关节炎效应
顾海伦,徐小磊,刘旭丹,刘莉
(1中国医科大学附属盛京医院骨科;2中国医科大学公共卫生学院营养与食品卫生教研室,沈阳 110004)
骨关节炎(osteoarthritis, OA)是一种发病率很高的风湿免疫性疾病,主要发生于中老年人。目前,中国有OA患者约1.2亿,是老年人致残的主要原因之一。OA的发病与年龄、肥胖、创伤等许多因素有关,目前并无治愈的有效方法。白藜芦醇(resveratrol,RES)是一种植物抗毒素,属于多酚类植物化学物,在葡萄、花生、虎杖中含量丰富。许多文献报道,RES具有抗OA作用[1],在防治OA方面具有潜在的应用前景,但其机制仍需探讨。
叉头框转录因子O1(forkhead transcription factors O1,FoxO1)是哺乳动物FoxO家族中的一员,几乎在所有组织中表达[2],在调控发育、老化、氧化应激等方面发挥重要作用。近年来,FoxO1在OA中的作用也备受关注,据报道,随年龄增加,软骨浅表层的FoxO1会显著减少[3];在OA软骨细胞中,过表达FoxO1可以减少炎性介质、减少软骨降解酶、增加保护性基因表达并拮抗IL-1β的效应,而FoxO1敲除的小鼠OA的发病则显著增加[4]。
细胞沉默信息调节子1(silent information regulator 1,Sirt1)是NAD+依赖性组蛋白去乙酰化酶,是治疗各种代谢性紊乱如2型糖尿病的主要靶点[5]。Sirt1控制FoxO的核转位及转录活性,并根据靶基因或细胞类型正向或负向调节FoxO的活性[6]。尽管FoxO1和Sirt1之间的关联在许多疾病中逐渐被阐明,但是在OA中的研究还有待探讨。RES是多酚类化合物中Sirt1最强的激活剂,FoxO1-Sirt1之间的关联是否参与了RES的抗OA作用值得进一步研究。因此,本研究通过体外细胞培养实验,探讨FoxO1-Sirt1之间的关联在RES抗OA中的作用,为阐明OA的发病机制及寻找有效的营养防治措施提供理论依据。
材料与方法
1 主要仪器和试剂
Multiskan MK3 酶标仪(美国Thermo);EPS-300电泳仪(中国上海天能科技有限公司);VE-180垂直电泳槽(中国上海天能科技有限公司);电泳凝胶成像系统(美国 Bio-Rad公司);倒置荧光显微镜(Leica DMi8);7500 Real-Time PCR仪(美国 ABI公司 )。RES(美国 Sigma);IL-1β(美国PeproTech);ELISA 试剂盒(武汉博士德);BCA蛋白定量试剂盒、RIPA裂解液(中国碧云天);βactin、Sirt1抗体(美国Santa Cruz Biotechnology);FoxO1、p-FoxO1抗体(美国CST公司);TRITC-山羊抗兔IgG(北京鼎国昌盛生物技术有限责任公司);HRP山羊抗小鼠二抗IgG(美国 Earthox);DAPI(上海碧云天生物技术有限公司)预染蛋白Marker、化学发光底物(美国Thermo)。FoxO1小干扰片段序列(FoxO1 siRNA)及随机阴性对照序列委托广州锐博生物科技有限公司合成。
2 细胞培养
SW1353软骨肉瘤细胞购于中国科学院上海生科院细胞资源中心,采用DMEM完全培养基(含10%FBS和1%双抗),37℃、5%CO2培养箱中培养;取对数生长期细胞接种于100mm的培养皿中,待融合为单层后进行处理。
3 细胞分组及处理
本研究对细胞的处理共有4个方面,具体为:①将细胞分成对照组(培养基含有2‰ DMSO)、IL-1β组(IL-1β终浓度为10ng/ml)、IL-1β+RES组(IL-1β和RES同时加入培养基中,IL-1β终浓度为 10ng/ml,RES终浓度为12.5或 50μmol/l),处理24h后收集细胞,Western blot法检测细胞Sirt1水平;②将细胞分为对照组、IL-1β组、IL-1β+RES(50μmol/l)组,处理30 min后收集细胞,免疫细胞化学技术检测FoxO1的定位表达,Western blot法检测FoxO1 及p-FoxO1水平;③将细胞分为对照组、阴性对照组、FoxO1 siRNA组。FoxO1siRNA组细胞加入含50nmol/L FoxO1 siRNA的DMEM(10%FBS)无双抗的培养基,阴性对照组加入含50nmol/L FoxO1 siRNA阴性对照的DMEM(10% FBS)无双抗的培养基,48h后荧光显微镜下观察转染效率,Western blot法检测FoxO1的抑制效果及对Sirt1的影响;④将细胞分为对照组、IL-1β组、IL-1β+RES组、IL-1β+FoxO1 siRNA 组、IL-1β+RES+FoxO1 siRNA组,转染各组细胞分别加入含50nmol/L FoxO1 siRNA的DMEM(10%FBS)无双抗的培养基,48h后弃去原培养基,随后加入含IL-1β(10ng/ml)或IL-1β与RES(50μmol/L)混合的DMEM(0.5% FBS)培养基处理24h,收集细胞和培养基上清,Western blot法检测细胞Sirt1蛋白表达,ELISA法检测培养基上清IL-6的水平。
4 siRNA转染沉默细胞FoxO1基因
取对数生长期细胞,接种于6孔板,1×104细胞/孔。待细胞融合约30%,弃培养基,PBS冲洗3次,转染,转染方法和步骤按riboFECTTM CP转染试剂盒说明进行。首先用30μl 1×riboFECTTM CP Buffer稀释1.25μl 20μM siRNA储存液,轻轻混匀,室温孵育5min;然后制备混合液,加入3μl riboFECTTM CP reagent,轻轻吹打混匀,室温孵育15min;将riboFECTTM CP混合液加入到465.75μl培养基中,轻轻混匀;置于37℃、5% CO2及饱和湿度条件下继续培养48h。荧光显微镜下观察转染效率。
5 ELISA法检测细胞培养上清中细胞因子IL-6的水平
按照ELISA说明书操作。未稀释或稀释后的样品100μl,37℃反应90 min。反应后甩去酶标板内液体,将生物素抗人IL-6抗体工作液按每孔100μl依次加入,37℃反应60 min;0.01 mol/L PBS洗涤3次,每次浸泡1~2 min;将ABC工作液按每孔100μl依次加入,37℃反应30min;0.01mol/L PBS洗涤5次,每次浸泡1~2 min;每孔依次加入已经在37℃平衡30 min的TMB显色液90μl,37℃避光反应25min;每孔加入100μl TMB终止液,酶标仪450nm下测定OD值。
6 Western blot检测蛋白水平
RIPA裂解细胞,BCA蛋白定量,每孔上样20μg总蛋白,电泳,转膜,5%脱脂奶粉室温封闭1.5h,PBS-T洗膜,一抗(1:1000)4℃过夜,漂洗,二抗(1:5000)室温2h,漂洗后于ECL成像系统中发光显影。β-actin做为内参,图像光密度扫描进行半定量分析。
7 免疫荧光检测FoxO1定位表达
细胞爬片后用4%的多聚甲醛固定爬片15min,0.2%的Triton X-100室温通透20min,加山羊血清于湿盒内封闭,室温孵育30min;取出片子,甩去封闭液,稀释一抗兔抗人FoxO1(1:100),滴加一抗,覆盖标本,于湿盒内4℃孵育过夜;第二天取出湿盒后室温复温 1h;滴加荧光基团标记的二抗(TRITC-山羊抗兔 IgG,1:100 稀释)于湿盒内,避光在 37℃孵育 1h;1µg/ml DAPI 复染细胞核,避光复染孵育5min。避光条件下,采用含有防荧光催灭物质的甘油进行封片,立即在荧光显微镜下观察采集图像。
8 数据分析
采用SPSS 20.0软件进行统计分析,实验结果以¯x±s表示。使用单因素方差分析法比较组间差异,P<0.05认为差异有统计学意义。
结 果
1 白藜芦醇上调IL-1β处理的SW1353细胞Sirt1水平
Western blot检测显示(图1),IL-1β处理24h对SW1353细胞Sirt1水平无明显影响;与IL-1β组相比,同时给予12.5或50μmol/L RES均可显著增加Sirt1水平;而RES12.5及RES50处理组相比,在对Sirt1蛋白表达方面无明显差别。
2 IL-1β与白藜芦醇处理促进FoxO1由胞核向胞质转位
免疫荧光和DAPI染色显示,对照组FoxO1主要定位在SW1353细胞的细胞核;经IL-1β或IL-1β与RES共同处理30min后,FoxO1主要在细胞质表达(图2)。
3 白藜芦醇增加IL-1β处理SW1353细胞内p-FoxO1水平
Western blot检测表明,与对照组相比,IL-1β处理30min可以显著上调SW1353细胞p-FoxO1水平,RES与IL-1β共同处理则进一步增加p-FoxO1水平,但FoxO1总蛋白表达水平在各组间均无明显差异(图3)。
4 FoxO1siRNA有效抑制SW1353细胞FoxO1表达
Western blot检测证明,转染FoxO1siRNA后,SW1353细胞内FoxO1表达被显著抑制,抑制率达70%,但转染阴性对照的细胞其FoxO1表达与对照组(未进行任何转染的SW1353细胞)相比未见明显改变(图4)。

图1 RES对IL-1β处理的SW1353细胞Sirt1表达的影响。A,Sirt1水平的Western blot检测;B,Sirt1水平的统计学分析;与对照组比较,*0.01<P<0.05;与 IL-1β 组比较,#0.01<P<0.05;n=3Fig. 1 Effect of resveratrol on Sirt1 level in SW1353 cells treated with IL-1β. A, Western blot detection for Sirt1 level; B, statistical analysis for Sirt1 level; *0.01<P<0.05, compared with the control group; #0.01<P<0.05, compared with group IL-1β; n=3
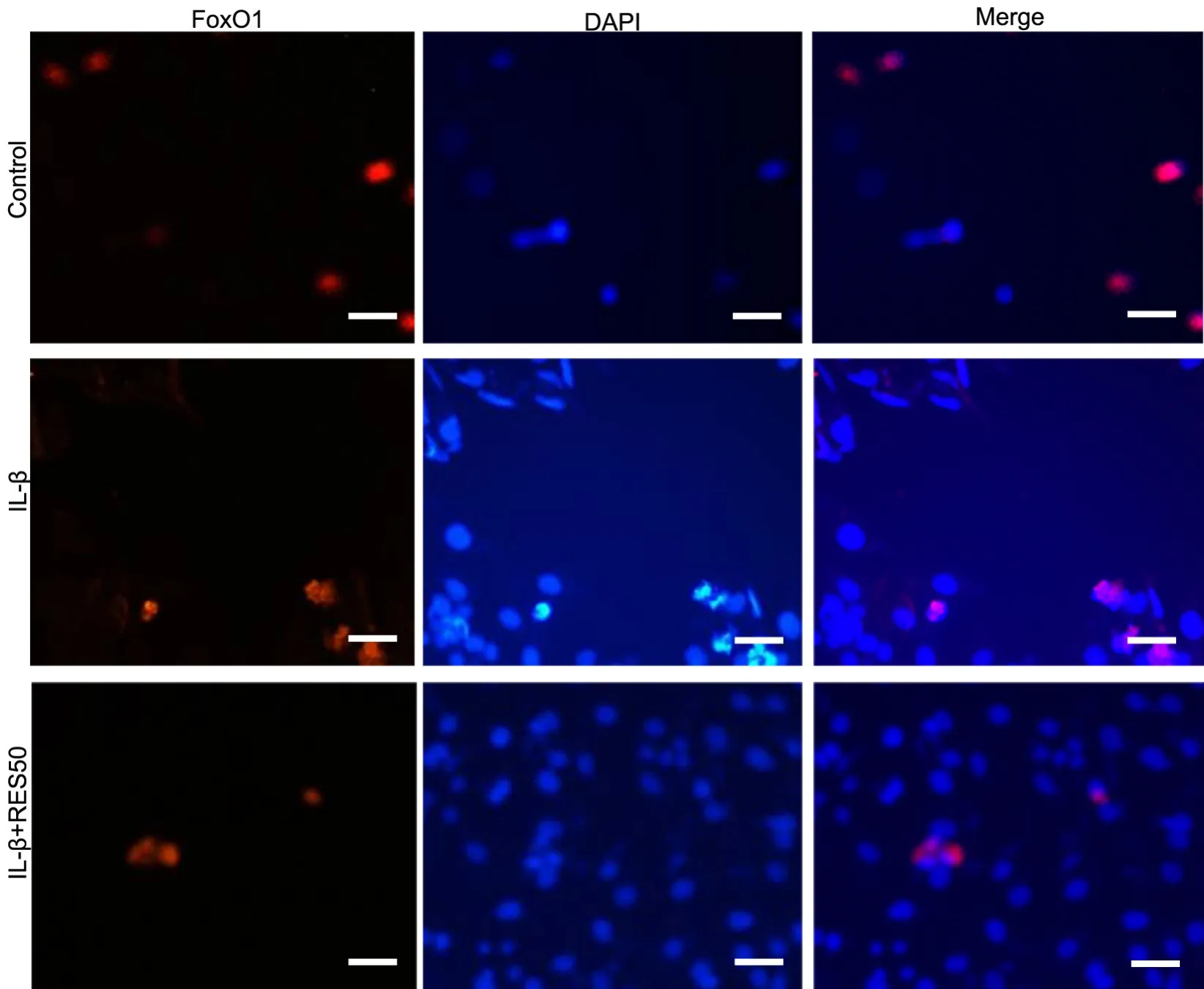
图2 IL-1β/RES处理对SW1353细胞FoxO1定位的影响。红色荧光代表FoxO1蛋白表达;蓝色荧光代表细胞核被DAPI染色;merge代表前二组图片融合,表达FoxO1定位表达。比例尺,50μmFig. 2 Effect of IL-1β/RES treatment on FoxO1 location in SW1353 cells. Red fluorescence represents FoxO1 protein expression.The blue fluorescence represents the nucleus stained by DAPI. Merge represents the fusion of the first two groups of images and represents the FoxO1 localization expression. Scale bar, 50μm
5 沉默FoxO1下调SW1353细胞内Sirt1水平
Western blot分析显示,与对照组相比,阴性对照组Sirt1水平无明显变化;而相比阴性对照组,转染FoxO1siRNA的SW1353细胞内Sirt1水平明显降低(图5)。

图3白藜芦醇对IL-1β处理的SW1353细胞p-FoxO1及FoxO1水平的影响。A,FoxO1水平的Western blot检测;B,FoxO1水平的统计学分析;与对照组比较,*0.01<P<0.05;与IL-1β组比较,#0.01<P<0.05;n=3Fig. 3 Effect of resveratrol on the levels of p-FoxO1 and FoxO1 in SW1353 cells treated with IL-1β. A, Western blot detection for FoxO1 level; B,statistical analysis for Sirt1 level; *0.01<P<0.05, compared with control group; #0.01<P<0.05, compared with group IL-1β; n=3

图4 FoxO1siRNA沉默 FoxO1表达。A,FoxO1水平的Western blot检测;B,FoxO1水平的统计学分析;与对照组比较,*0.01<P<0.05;与阴性对照组比较,#0.01<P<0.05;n=3Fig. 4 FoxO1siRNA silences FoxO1 expression in SW1353 cells. A,Western blotting detection for FoxO1 level; B, statistical analysis for Sirt1 level; *0.01<P<0.05, compared with control group; #0.01<P<0.05,compared with negative control siRNA group; n=3
6 FoxO1基因沉默降低RES对SW1353细胞内Sirt1的上调
Western blot检测显示,与IL-1β组相比,同时给予FoxO1 siRNA预处理并不引起SW1353细胞Sirt1水平明显变化,进一步加入RES后对Sirt1水平也无显著影响。与IL-1β+RES组相比,同时给予FoxO1 siRNA预处理则显著抑制RES对Sirt1水平的上调(图6)。
7 RES和沉默FoxO1抑制IL-1β对SW1353细胞分泌IL-6的促进作用
ELISA检测表明,与对照组相比,IL-1β处理可显著增加SW1353细胞分泌IL-6;在IL-1β处理的同时给予RES或以FoxO1 siRNA沉默FoxO1表达,IL-1β促进IL-6分泌的作用明显减弱;对同时以IL-1β和FoxO1 siRNA处理的细胞给予RES,IL-1β促进IL-6分泌的作用减弱更为明显(图7)。

图5 沉默FoxO1对SW1353细胞内Sirt1水平的影响。A,FoxO1水平的Western blot检测;B,FoxO1水平的统计学分析;与对照组比较,*0.01<P<0.05;与阴性对照组比较,#0.01<P<0.05;n=3Fig. 5 Effect of silencing FoxO1 gene on Sirt1 level. A, Western blot detection for FoxO1 level; B, statistical analysis for Sirt1 level; *0.01<P<0.05,compared with control group; #0.01<P<0.05, compared with negative control siRNA group; n=3

图6 沉默FoxO1对白藜芦醇上调IL-1β处理的SW1353细胞Sirt1水平影响。A,Sirt1水平的Western blot检测;B,Sirt1水平的统计学分析;与对照组比较,*0.01<P<0.05;与 IL-1β 组比较,#0.01<P<0.05;与 IL-1β+RES 组比较,$0.01<P<0.05;n=3Fig. 6 Effect of silencing FoxO1on upregulation of Sirt1 level by resveratrol in SW1353 cells treated with IL-1β. A, Western blot detection for FoxO1 level; B, statistical analysis for Sirt1 level; *0.01<P<0.05, compared with control group; #0.01<P<0.05, compared with group IL-1β; $0.01<P<0.05,compared with group IL-1β+RES; n=3

图7 IL-1β、白藜芦醇和沉默FoxO1对SW1353细胞分泌IL-6影响的统计学分析。与对照组比较,*0.01<P<0.05,**P<0.01;与IL-1β组比较,##P<0.01;与IL-1β+RES组比较,^0.01<P<0.05;与IL-1β+FoxO1 siRNA 比较 , &0.01<P<0.05;n=2Fig. 7 Statistical analysis for effect of IL-1β, resveratrol and silencing FoxO1I on IL-6 secretion of SW1353 cells. *0.01<P<0.05, **P<0.01,compared with control group; ##P<0.01, compared with group IL-1β;^0.01<P<0.05, compared with group IL-1β+RES; &0.01<P<0.05, compared with group IL-1β+FoxO1 siRNA; n=2
讨 论
本研究采用IL-1β作为诱导剂对SW1353细胞进行处理,在体外模拟OA的环境。据报道,OA的软骨细胞Sirt1表达下调[7],但本实验结果发现,IL-1β处理组和对照组的Sirt1表达并无明显差异,这可能因为SW1353软骨细胞Sirt1的基线表达水平较低,因此加入IL-1β也显示不出明显的降低;但同时给予12.5或50μmol/LRES处理后,则显著增加Sirt1的表达,说明RES可上调Sirt1表达,进而发挥生物学效应。在我们先前的研究中发现,RES浓度为12.5μmol/L可促进SW1353细胞增殖,而RES浓度为50μmol/L对细胞的增殖无明显影响[8],因此在本研究的后续实验中我们选择了对细胞增殖无明显影响的浓度RES 50μmol/L作为处理浓度。
Sisrt1除了通过组蛋白和非组蛋白的脱乙酰化调节生理活动外[9],还靶向调节许多转录因子,包括p53,FoxO,E2F1及NF-κB[10]。RES激活SIRT1后,可以通过抑制NF-κB信号通路发挥抗OA效应[11]。此外,Sirt1也通过调控FoxO1发挥作用,FoxO1活性受翻译后修饰(包括磷酸化和乙酰化)调节,磷酸化的FoxO1从核内转移至胞质中,使FoxO1不能作用于其靶向基因,从而使FoxO1丧失了其转录因子活性[12];乙酰化的FoxO1加速和促进FoxO1的磷酸化,致使FoxO1的活性降低[13]。在氧化应激过程中,FoxO1转位至细胞核并与Sirt1相互作用,导致FoxO1脱乙酰化。根据FoxO1的翻译后情况,Sirt1可以抑制FoxO1活性,保护细胞免受氧化应激[14]或增加FoxO1的活性,从而导致基因激活[15],发挥相应的生物学功能。
关于FoxO1受Sirt1调控的研究很多,本研究则主要探讨了RES抗OA效应中FoxO1对SIRT1的调控作用。结果发现,IL-1β处理显著上调p-FoxO1水平(FoxO1失活增加),而RES处理则进一步增加p-FoxO1的表达,提示RES可以通过增加FoxO1的磷酸化水平引起FoxO1的失活;而FoxO1基因沉默后,在未施加任何处理因素时,Sirt1的蛋白表达也降低,提示Sirt1受FoxO1的调控,与文献报道一致,即内源性FoxO1是Sirt1的正向转录调节子[16]。与IL-1β组相比,FoxO1 siRNA+IL-1β组Sirt1蛋白表达无明显变化,而RES处理后细胞的Sirt1蛋白表达也无显著变化,提示RES对Sirt1表达的上调作用是由FoxO1介导。与IL-1β+RES组相比,FoxO1 siRNA显著降低了Sirt1的水平,进一步表明FoxO1在RES上调Sirt1表达中的重要作用。
外源性IL-1β显著增加细胞分泌IL-6的水平,而FoxO1基因沉默可抑制IL-1β对IL-6表达的诱导作用,说明抑制FoxO1可以改善SW1353细胞的OA炎症状态,而同时给予RES处理则进一步降低了IL-6水平,说明RES的抗OA效应除了与抑制FoxO1/Sirt1有关外,还涉及其他机制。综上所述,在IL-1β处理的SW1353细胞中,RES可以通过失活FoxO1,增加Sirt1的水平发挥抗OA效应,FoxO1与Sirt1在RES的抗OA效应中存在相互调控关系。因此,对FoxO1-Sirt1信号的调控研究可能有助于进一步阐明OA的发病机制,并可为寻找治疗OA的新靶点提供思路。

