苯基丙氨酸修饰石墨烯平面电极对西酞普兰的灵敏检测
崔一鸣, 路丽琴, 罗红霞*
(中国人民大学化学系,北京 100872)
西酞普兰(CIT)是一种选择性5-羟色胺再摄取抑制剂(SSRI),为外消旋体。CIT可以选择性地抑制5-羟色胺(5-HT)转运体[1],阻断突触前膜对5-HT的再摄取,延长和增加5-HT的作用[2],从而产生抗抑郁作用[3],该药已被广泛应用于抑郁症的治疗中。近年来,关于CIT以及其他类抗抑郁药物的研究,尤其是在关于患者血清[4]乃至母乳内的药物含量测定[5]引起了广泛的关注。因此对CIT进行快速准确的检测方法的需求也日益增加。目前已有多种关于CIT的检测方法,其中包括比色法[6]、质谱法[7]、电泳法[8]以及电化学方法等。其中,电化学方法简便、快捷、灵敏、成本低,倍受研究者们的关注[9]。
苯基丙氨酸(PHE)是人体必需的氨基酸之一,它有着特殊的生物活性,被广泛应用于食品、药品以及营养品工业中[10]。在分析检测中,PHE以及聚PHE分子由于其与生物分子特有的作用效果、催化性质以及π-π共轭的作用,常被用于电极的改良,并取得了显著效果[11 - 12]。石墨烯是一种二维碳纳米材料,它由sp2杂化的C原子组成。因其比表面积大,导电导热性好,电化学稳定,机械强度高,石墨烯几乎可以被应用于材料研究的所有领域[13 - 14]。在众多制备石墨烯的方法中,由化学气相沉积法(CVD)制备而得的石墨烯具有可以大面积制备、层数可控、电化学性能好等优势[15 - 16]。因此CVD法制得的石墨烯可以不经处理直接被应用于制作电极并应用于电化学测定[17],而且该石墨烯的边缘和面都具有较好的电化学性能[18]。我们研究小组曾将CVD法石墨烯的边缘制备成纳米线电极,应用于一些生物分子的高灵敏检测[19 - 20]。我们还将CVD法石墨烯面转移到聚对苯二甲酸乙二醇酯(PET)表面,制成石墨烯平面电极(GPE),并通过电化学方法再对GPE表面进行修饰,实现了对多种生物分子的选择性或同时检测[21 - 22]。本研究在上述工作的基础上,通过电化学方法在GPE上沉积PHE,并将得到的PHE/GPE用于CIT的检测。该体系结合了GPE优越的电化学性质以及PHE的独特生物活性,实现了对CIT灵敏快捷地测定。这种检测方法检出限低、稳定性好、简单方便,有望应用于生命、医学的研究领域。
1 实验部分
1.1 仪器及试剂
CHI660D型电化学工作站(上海辰华仪器有限公司),采用三电极系统:工作电极为GPE或PHE/GPE,参比电极为Ag/AgCl电极,对电极为铂丝电极。Sartorius PB-10 pH计(德国,Sartorius);扫描电子显微镜和能谱仪(日本,JEOL 7401F)、拉曼光谱仪(日本,Lab Ram HR Evolution)。
铜基底少层CVD法石墨烯(深圳六碳科技有限公司);聚甲基丙烯酸甲酯(PMMA)(Aladdin);L-缬氨酸(Aladdin);PET(厚度为250 mm,深圳市极致薄膜科技有限公司);葡萄糖(国药集团化学试剂有限公司);苯基丙氨酸、腺嘌呤、鸟嘌呤、尿酸(BIO BASIC INC);多巴胺(Acros-Organics);西酞普兰(Adamas-Beta);支持电解质为0.1 mol/L的KH2PO4-Na2HPO4缓冲溶液(PBS)。所有试剂均为分析纯,实验用水为Milli-Q(美国Millipore公司)去离子水。
草酸艾司西酞普兰片(山东京卫制药有限公司)。
1.2 实验方法
1.2.1 石墨烯电极的制备如图1所示,采用高分子支撑法,将铜基底上的大面积少层石墨烯(GR)转移到柔性透明的PET基底上。具体步骤如下:在铜基底的石墨烯上均匀涂抹1%(w/w)的PMMA苯甲醚溶液,自然晾干,以作为石墨烯薄膜的支撑,避免在转移过程中造成破损;在恒温箱中于120 ℃干燥5 min,自然冷却。然后将PMMA/GR/Cu浸泡在1 mol/L FeCl3和0.1 mol/L HCl混合溶液中刻蚀掉Cu;用去离子水清洗PMMA/GR,并转移到PET基底上,室温干燥。将PMMA/GR/PET在丙酮中浸泡24 h,以去除支撑石墨烯的PMMA。取出晾干,用绝缘胶带将GR/PET缠成0.3×0.3 cm的薄片,石墨烯和电极引线之间通过铜胶带连接,即可得到GPE[15 - 16]。
2.2.2 PHE/GPE的制备以GPE为工作电极,在含2 mmol/L PHE和0.1 mol/L PBS(pH=6.0)中,在-0.4~1.6 V范围内连续扫描40圈,将苯基丙氨酸修饰到GPE上,得到PHE/GPE(图1)。
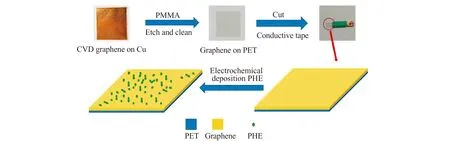
图1 石墨烯平面电极(GPE)和苯基丙氨酸修饰石墨烯平面电极(PHE/GPE)的制备过程示意图Fig.1 The schematic illustration of the construction of the graphene platform electrode(GPE)and the PHE modified GPE(PHE/GPE)
2 结果与讨论
2.1 PHE/GPE的表征
从石墨烯在铜基底(图2A)以及PET基底(图2B)上的扫描电镜(SEM)图可以看出,石墨烯在转移到PET上后延续了其在铜基底上完整和平滑的性质。而在PHE/GPE的扫描电镜图(图2C,2D)中可以看出,经过电化学沉积后PHE已经成功修饰在了GPE表面,并呈现棒状聚集的形态,每个粒子的大小在2 μm左右。在PHE/GPE的能谱(EDS)图中,N元素具有较高的峰,而PET基底和石墨烯中都没有N元素的存在,这也说明含氮的PHE成功地修饰在了GPE上(图2E)。同时修饰后的电极O、C比变大,说明在修饰过程中石墨烯发生了活化。在活化的过程中,石墨烯的结构上形成了诸多含氧基团,从而提高了GPE的电极活性[23]。
电化学阻抗图谱能够展现出电子在电极上的传输情况,由图3A可以看出,PHE/GPE与GPE相比,图谱在高频区的半径变小,说明修饰过程使电子在电极表面传递的电阻Ret变小[24];而用于K3[Fe(CN)6]的循环伏安测定时(图3B),PHE/GPE上峰电流要小于GPE上的峰电流,这可能是苯基丙氨酸在溶液中呈现负电,与[Fe(CN)6]3-相斥所造成的[25]。

图2 (A)铜片上石墨烯的扫描电镜(SEM)图;(B)GPE的SEM图;(C、D)PHE/GPE的SEM图;(E)GPE的能谱(EDS)图;(F)PHE/GPE的EDS图Fig.2 (A)The SEM image of graphene on Cu;(B)The SEM image of GPE;(C and D)The SEM image of PHE/GPE;(E)The EDS of GPE;(F)The EDS of PHE/GPE
通过拉曼光谱图(图3C)可以看出,石墨烯在1 327 cm-1、1 563 cm-1和2 676 cm-1处有三个特征峰,其中峰G和峰2D的大小接近,说明实验所用的石墨烯为少层石墨烯,而通过峰D和峰G的大小之比的变化,说明缺陷程度增大,证明了在转移过程中石墨烯发生了活化[26]。
2.2 CIT在PHE/GPE上的电化学响应
图3D为CIT在PHE/GPE以及GPE上的循环伏安图。从图中可以看出,PHE/GPE以及GPE都可以对CIT产生特定的电化学响应并产生一个氧化峰,而CIT在PHE/GPE上产生的峰电流要明显高于在GPE上产生的峰电流。这说明PHE对石墨烯电极测定CIT具有促进作用。PHE修饰在GPE上后,电极的比表面积明显增大,同时由于PHE特有的生物活性以及氧化还原性质[27],对CIT在电极上的氧化起到了明显的催化作用。

图3 (A)GPE和PHE/GPE在含有1 mmol/L [Fe(CN)6]4-/3-和0.1 mol/L KCl溶液中的阻抗谱图(频率从0.01 Hz到100 Hz);(B)GPE和PHE/GPE在[Fe(CN)6]3-溶液中的循环伏安(CV)图;(C)转移在PET基底上的石墨烯(a)和铜基底上石墨烯(b)的拉曼光谱图;(D)GPE(a、c)和PHE/GPE(b、d)在不含CIT(a、b)和含有20 μmol/L CIT(c、d)的0.1 mol/L PBS(pH=9.0)中的CV图(扫速:0.025 V/s)Fig.3 (A) Nyquist plot of pristine GPE and PHE/GPE in 0.1 mol/L KCl containing 1 mmol/L [Fe(CN)6]4-/3-(between 0.01 Hz and 100 Hz);(B)CVs obtained at GPE(a and c) and PHE/GPE(b and d) in 0.1 mol/L KCl containing 1 mmol/L [Fe(CN)]3-);(C) The Raman spectra of graphene on silicon wafer(a) and copper sheet(b);(D) CVs obtained at GPE(a and c) and PHE/GPE(b and d) in 0.1 mol/L PBS(pH=9.0) in the absence(a and b) and presence(c and d) of 20 μmol/L CIT(Scan rate:0.025 V/s)
2.3 PHE在GPE上修饰条件以及CIT检测条件的优化
从图4A可以看出,增加沉积圈数可以使相应的CIT响应峰电流增大,且当沉积圈数达到40圈时峰电流达到最大,当沉积圈数超过40圈时,峰电流减小。这是因为在沉积圈数增大时,沉积在GPE上的PHE颗粒增多,使电极的表面积以及活性都能增大,但是当PHE颗粒沉积过多时,会发生团聚,破坏了石墨烯的完整性,阻碍了电极上电子的传递,使峰电流减小。在本实验中,我们选择在沉积40圈条件下修饰得到的PHE/GPE[15]。从PHE/GPE在0.5~1.1 V电位扫描范围内测定20 μmol/L的CIT循环伏安图(图4B)中可以看出,在扫速从10~100 mV的范围内,CIT在电极上的峰电流随扫速的增加而增大。通过对扫速和其对应峰电流的拟合,可以得出扫速的对数和峰电流的对数呈线性关系(图4C),线性方程为:logIp(μA)=0.5576logv(V/s)-0.9287(R2=0.9928),斜率接近0.5,说明CIT在此电极上的氧化反应是一个受扩散控制的过程[28]。

图4 (A)沉积PHE时的扫描圈数对修饰电极的影响;(B)PHE/GPE在含有20 μmol/L CIT的0.1 mol/L PBS(pH=9.0)中在扫速为10~100 mV/s下的循环伏安(CV)图;(C) B图的峰电流的对数和扫速的对数的线性拟合图Fig.4 (A) Effect of cycle number toward the depositon of PHE on GPE;(B) CVs obtained at PHE/GPE in 0.1 mol/L PBS(pH=9.0) containing 20 μmol/L CIT at scan rates from 10 to 100 mV/s;(C) The plot of logv vs.logIp
支持电解质的pH值对CIT在PHE/GPE电极上响应具有很大的影响。如图5A所示,当pH值增大时,CIT的峰电位随之负移,且峰电位PBS的pH值呈线性关系(图5B),线性方程为:Ep=1.3868-0.0533pH,斜率为-53.3 mV/pH,接近理论值59 mV/pH,说明CIT在电极上的反应是一个质子与电子转移数相等的过程[29 - 30]。在不同pH值的条件下,CIT的峰电流大小也不尽相同(图5C),我们发现在pH=9.0的条件下,峰的形状和峰电流都达到最优。因此,本实验我们选择在pH=9.0的条件下检测CIT。
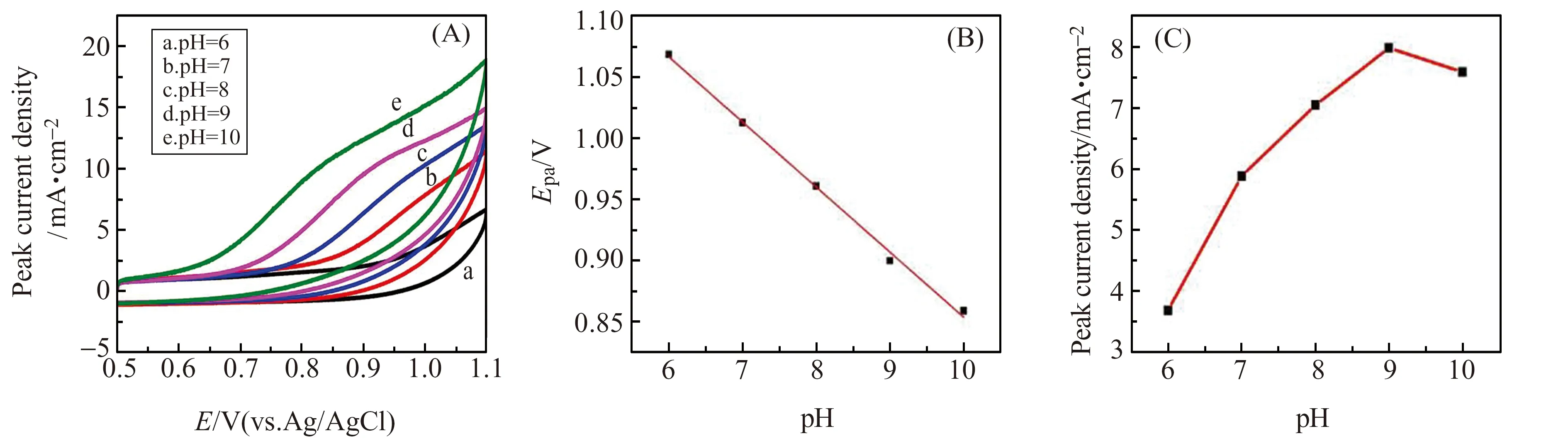
图5 (A) PHE/GPE在含有20 μmol/L CIT的0.1 mol/L PBS中的循环伏安(CV)图(扫速为0.025 V/s);(B)pH值在6~10变化时峰电流与pH的线性拟合图;(C)峰电流随pH的变化关系Fig.5 (A) CVs obtained at PHE/GPE in 0.1 mol/L PBS containing 20 μmol/L CIT(scan rate is 0.025 V/s);(B) The plot of pH vs.Epa;(C) the plot of Ip vs.pH
2.4 检出限和检出范围
在搅拌条件下每50 s向0.1 mol/L PBS中连续滴加CIT。图6A为在恒电位0.9 V的条件下,CIT在PHE/GPE上的计时电流曲线,从图中可以看出,在0.5~15 μmol/L和15~88 μmol/L的范围内,响应电流与CIT浓度呈分段线性关系(图6B),线性方程分别为:I(μA)=0.04322c(μmol/L))+0.05927(R2=0.9884);I(μA)=0.0031c(μmol/L)+0.6519(R2=0.9775)。检出限(S/N=3)为0.044 μmol/L。与文献中的其他方法相比,本方法检出限较低,线性范围较宽(表1)。
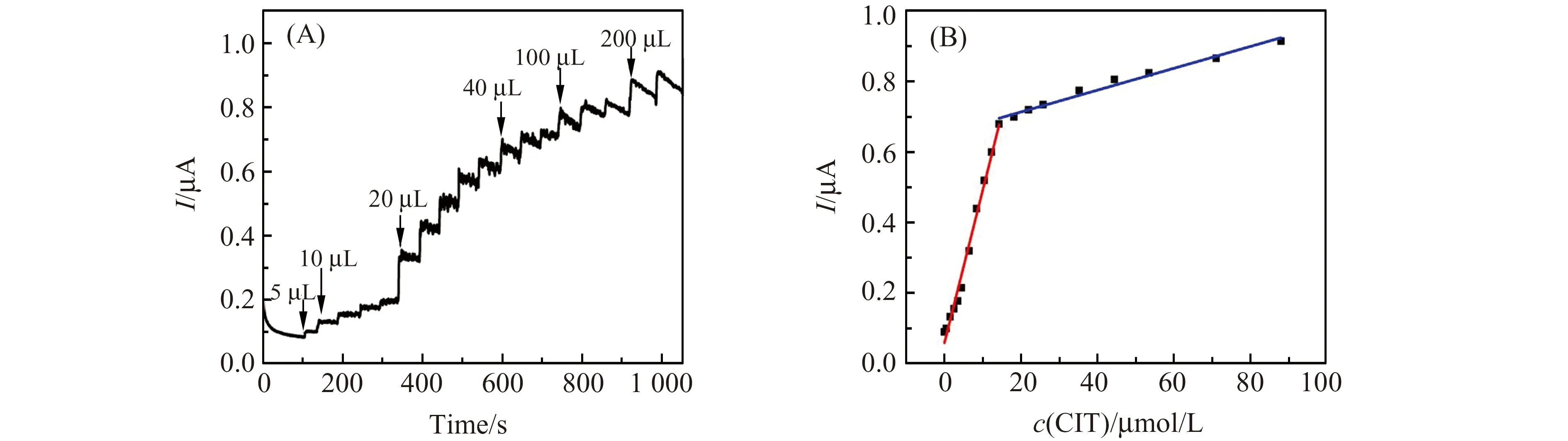
图6 (A)恒电位0.90 V下PHE/GPE对CIT的计时电流曲线(0.1 mol/L PBS,pH=9.0),CIA浓度范围0.5~88 μmol/L;(B)CIT氧化电流与浓度的线性关系Fig.6 (A)Typical amperometric responses of PHE/GPE to successive additions of several concentrations of CIT(from 0.5 to 88 μmol/L) at applied potential of 0.90 V in 0.1 mol/L PBS(pH=9.0);(B) The calibration plot of currents obtained at PHE/GPE against concentrations of CIT

表1 PHE/GPE与其它西酞普兰传感器的一些参数比较Table 1 Comparison of the analytical parameters of the PHE/GPE sensor with some other sensors for determination of citalopram
2.5 PHE/GPE电极的稳定性、重现性和干扰实验
通过计时电流法来检测PHE/GPE的抗干扰能力。如图7A所示,在0.9 V的恒电位下,加入CIT响应电流会有明显变化,加入L-缬氨酸、KCl、腺嘌呤、NaCl、Na2SO4、葡萄糖时响应电流均无明显变化,再加入CIT时仍有响应,说明PHE/GPE对CIT有良好的选择性。如图7B所示,在0.9 V的恒电位条件下,加入50 μmol/L的CIT后,经过90 min的电解,电流可以维持在初始值的90%以上,说明该电极稳定性较好。将此电极置于20 μmol/L的CIT溶液中连续测量10次,响应电流的相对标准偏差小于5%,说明该电极的重现性良好。

图7 (A)PHE/GPE对CIT、100 μmol/L L-缬氨酸、1 000 μmol/L KCl、100 μmol/L腺嘌呤、1 000 μmol/L NaCl、1 000 μmol/L Na2SO4和1 000 μmol/L葡萄糖的安培响应;(B)恒电位0.90 V下PHE/GPE对20 μmol/L CIT的 0.1 mol/L PBS的安培响应Fig.7 (A)Amperometric response of PHE/GPE to the addition of CIT,100 μmol/L L-valine,1 000 μmol/L KCl,100 μmol/L Adenine,1 000 μmol/L NaCl,1 000 μmol/L Na2SO4 and 1 000 μmol/L glucose;(B)Amperometric responses of PHE/GPE with 20 μmol/L CIT in 0.1 mol/L PBS at the potential of 0.90 V
2.6 实际样品检测
将草酸艾司西酞普兰片配制成浓度为10 μmol/L和15 μmol/L的溶液,通过标准加入法对四份草酸艾司西酞普兰溶液进行测定。结果如表2所示,回收率在96.4%~104.8%之间,说明PHE/GPE可以用于实际样品中CIT的测定。

表2 西酞普兰药片的检测结果
3 结论
本文通过高分子支撑法,将CVD法制得的石墨烯转移到柔性PET基底上制成GPE,并通过电化学方法将PHE沉积在GPE表面得到PHE/GPE。该电极具备石墨烯的高导电性等良好的电化学性质,以及PHE的生物活性和催化能力,能够对CIT进行精确的检测。本方法具有灵敏度高、稳定性好、抗干扰能力强,以及制备简单、成本低廉等特点,检出限(S/N=3)达到0.044 μmol/L,可以对实际样品中CIT进行检测,有望广泛应用于电化学传感器领域。柔性PET基底还使电极有望应用于便携乃至可穿戴传感器的开发。

